Управление апплетом:
Лиганды:
Контакты:
Скачать скрипты в одном архиве
Введение
Тубулин — это белок, который представляет собой основную часть микротрубочки и состоит из молекул альфа и бета тубулина (соответственно, A-цепи с UniProt ID B6A7R0 и B-цепи с UniProt ID P02554). PDB ID комплекса 5SUC. В них, а также в цитоплазме клеток он находится в форме димера. Нами был выбран именно этот вариант белка в связи с тем, что он обладает структурой с наиболее высоким разрешением (3,5Å) [из доступных]. Данный тубулиновый комплекс принадлежит Sus scrofa – дикой свинье.
В связи с тем, что мы работаем с комплексом, состоящим из основных структурных элементов микротрубочек, логично будет описать строение и функционирование микротрубочек, описав тем самым и наш комплекс. При этом другие типы тубулинов не будут рассмотрены, так как они могут иметь строение, отличное от α- и β-тубулинов.
Итак, микротрубочки — белковые внутриклеточные структуры, входящие в состав цитоскелета. Их наружный диаметр составляет около 25 нм, что соответствует 13 субъединицам, которые можно единовременно видеть в поперечном разрезе. Клетки способны образовывать микротрубочки длиной до нескольких сантиметров. Они принимают участие во многих процессах транспорта и циркуляции веществ в клетках. Столь активное использование микротрубочек клеткой связано с их некоторыми интересными особенностями строения и функционирования. Главная из них – то, что микротрубочки состоят из одинаковых мономеров, способных полимеризоваться в присутствии GTP и выстраиваться в потенциально бесконечную периодическую структуру, что обеспечивает быстрое нарастание.[3] Вторая особенность – динамическая нестабильность. Микротрубочки как комплекс достаточно непостоянны. Стоит гидролизоваться молекуле GTP, которая стабилизируется ионом магния, и трубочка начинает распадаться на мономеры. Именно эта особенность позволяет быстро разбирать микротрубочки, что активно используется, например, при клеточном делении.[3] Клетка может бороться с этим процессом, кэпируя микротрубочки и останавливая их саморазборку. Наконец, микротрубочки выступают отличным субстратом для связывания моторными белками, что вкупе с полярностью микротрубочек (можно выделить "+" и "-" концы) позволяет направленно транспортировать необходимые структуры.[4]
Как было сказано выше, для функционирования микротрубочек необходим GTP. Помимо него данный белок содержит и другие лиганды, которые представлены в таблице ниже:
Peroluside A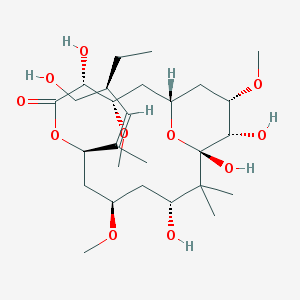 Название по IUPAC: (1S,3S,4R,7R,9R,11R,13S,14S,15S)-4,11,13,14-тетрагидрокси-7-[(2Z,4S)-4-(гидроксометил)гекс-2-ен-2-ил]-3,9,15-триметокси-12,12-диметил-6,17-диоксабицикло[11.3.1]гептадекан-5-он Брутто-формула: C27H48O11 Молярная масса: 548.67 г/моль PubChem |
Гуанозин-5’-трифосфат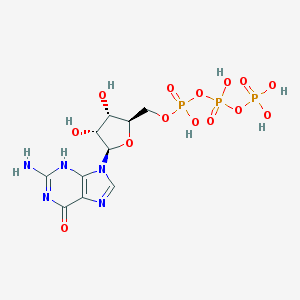 Название по IUPAC: [[(2R,3S,4R,5R)-5-(2-амино-6-оксо-3H-пурин-9-ил)-3,4-дигидроксиоксолан-2-ил]метилокси-гидроксифосфорил] фософоно фосфорная кислота Брутто-формула: С10H16N5O14P3 Молярная масса: 523.18 г/моль PubChem |
Гуанозин-5’-дифосфат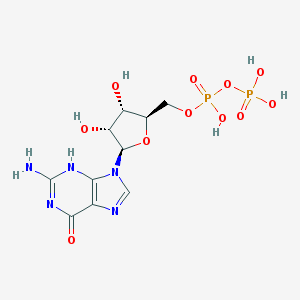 Название по IUPAC: [(2R,3S,4R,5R)-5-(2-амино-6-оксо-3H-пурин-9-ил)-3,4-дигидроксиоксолан-2-ил]метил фосфоно фосфорная кислота Брутто-формула: C10H15N5O11P2 Молярная масса: 443.2 г/моль PubChem |
Магний (II)Название по IUPAC: Магний(2+)Брутто-формула: Mg2+ Молярная масса: 24.305 г/моль PubChem |
Информация о белок-белковых контактах:
Наиболее важными лиганд-белковыми контактами можно считать контакты А цепи и Mg2+. Сам контакт достаточно прост, но важна его функциональная нагрузка. Магний крепится солевой связью к Glu-71. Но у него остаётся валентность, которая уходит на стабилизацию молекулы GTP, располагающейся рядом. Связи магния отображены в апплете (Mg).
Для начала отметим, что, в связи со схожестью молекул тубулина (пространственное выравнивание не выявило резких отличий), в данной части обе цепи тубулина (и α, и β) будут рассматриваться как идентичные и именоваться как "тубулин".
В связи с функциональной нагрузкой мономеров тубулина (умением быстро организовываться в полимеры и, наоборот, саморазбираться), нами было выявлено лишь три типа межмолекулярнных связей: водородные связи, гидрофобные взаимодействия и солевые мостики. Соответственно, ковалентные межмолекулярные связи в тубулиновых комплексах не распространены.
При этом важно отметить, что JMol идентифицировал всего одну межмолекулярную водородную связь; это свидетельствует о том, что этот тип связей играет наименее важную роль в образовании комплекса. В связи с этим дальнейшее рассмотрение роли водородных связей представлено не будет. Водородную связь можно посмотреть в приложении выше.
Роль остальных связей довольно интересна и требует описания. Во-первых рассмотрим роль гидрофобных взаимодействий. Как показано в апплете, гидрофобное ядро достаточно большое и имеет несколько выходов на поверхность. В торцевых частях молекул наблюдаются наиболее гидрофобные области, что подтверждается исследованиями[1]. Видно, что происходит соприкосновение двух частей гидрофобных ядер.
Третий тип контактов в между тубулинами – солевые мостики. Конечно, эти контакты располагаются и на торцевых поверхностях молекул, но там они вторичны (что не мешает вам видеть их в апплете), так как основная нагрузка всё же лежит на гидрофобных взаимодействиях и взаимодействиях типа "белок-лиганд-белок". А основную связывающую роль они играют на боковых частях молекул, в местах соединения протофиламентных нитей, образованных димерами, в микротрубочку. Как вы можете видеть, вся боковая поверхность обильно усеяна аминокислотами, необходимыми для образования солевых мостиков. Это наше предположение также находит подтверждение в статьях[2].
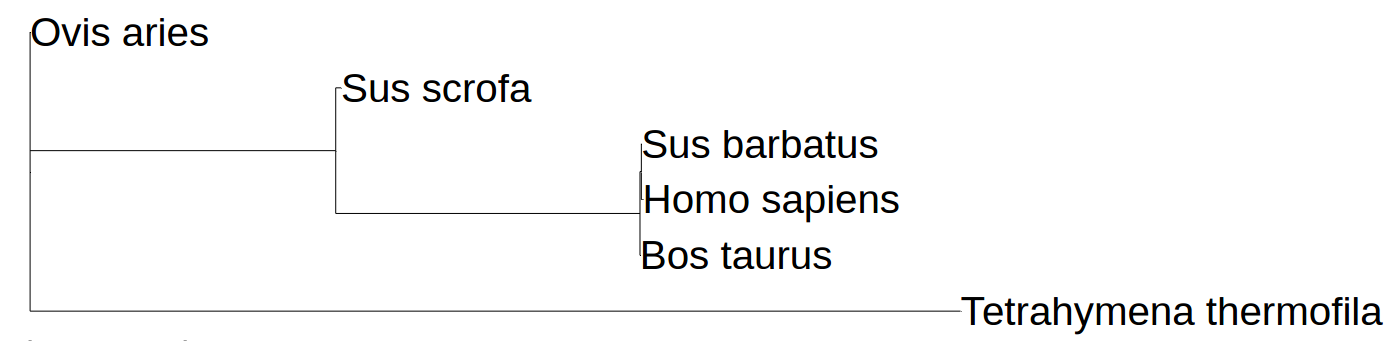
Для того, чтобы получить возможность рассматривать A и B цепи как одинаковые, нами было произведено пространственное выравнивание белков с помощью программы PyMol. Результаты пространственного выравнивания были достаточно интересными. Как вы можете видеть, структуры белков не имеют существенных отличий. Наиболее значительные отличия можно найти в нескольких местах, обозначенных синим/красным цветами. Это дало нам возможность рассматривать цепи тубулина как фактически идентичные, чем мы и воспользовались. Но из-за этого возникли другие вопросы, например, об эволюции тубулинов и возможности использовать его как белок, на основе которого можно строить филогенетические деревья. Но тут мы столкнулись с достаточно серьезными проблемами. Во-первых структура обоих цепей тубулинов нашлась лишь для нескольких видов. Во-вторых, как выяснилось в этом исследовании окончательно, тубулин является достаточно консервативным белком, а это затрудняет его использование для построения филогенетических деревьев. С приблизительным результатом наших попыток построения дерева вы можете ознакомиться на рисунке. Видно, что программа филогенетической реконструкции не может чётко разделить позвоночных. (Хотя это действительно трудно сделать по ~100 остаткам консервативного белка) Некоторые места даже остаются неразрешёнными, то есть практически не имеют дихотомического ветвления [крайне короткие ветви]. Структурно человеческий тубулин настолько же слабо отличается от свиного. Всё это подтверждает гипотезу о консервативности данного белка.
Личный вклад:
Арсений Логиновский написал скрипты для апплета, оформил веб-страницу с отчетом, осуществил пространственные выравнивания и попытку реконструкции филогении; нашёл на PubChem и описал лиганды.
Алексей Попов написал текст и описал контакты, найдя для этого соответствующие статьи.
Источники информации:
- А. Ленинджер – Основы биохимии
- D. Sackett, J. Knutsonf, J. Wolff – Hydrophobic Surfaces of Tubulin Probed by Time-resolved and Steady-state Fluorescence of Nile Red, J. Biol. Chem.
- J. Cueva, J. Hsin, K. Huang, M. Goodman – Posttranslational Acetylation of α-Tubulin Constrains Protofilament Number in Native Microtubules
- D. Sept – Microtubule Polymerization: One Step at a Time, Current Biology
- Walker RA, O'Brien ET, Pryer NK, Soboeiro MF, Voter WA, et al. – Dynamic instability of individual microtubules analysed by video light microscopy: rate constants and transition frequencies., J. Cell Biol.
© Arsenii Loginovskii, Alexei Popov, 2017
