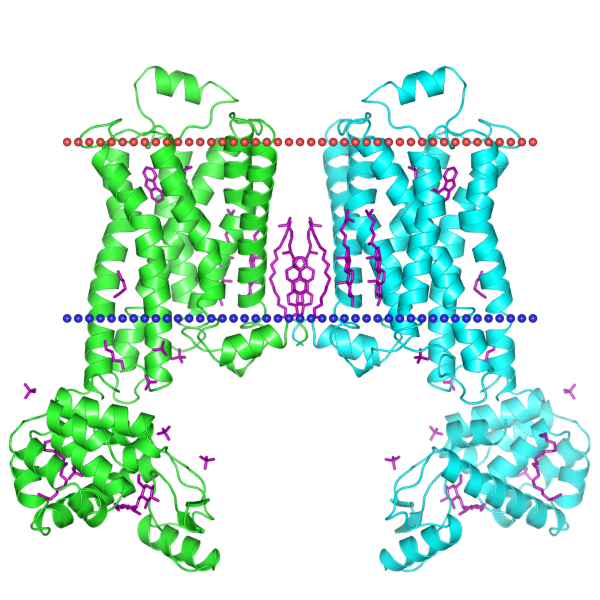
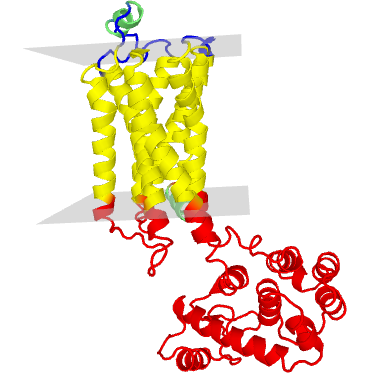
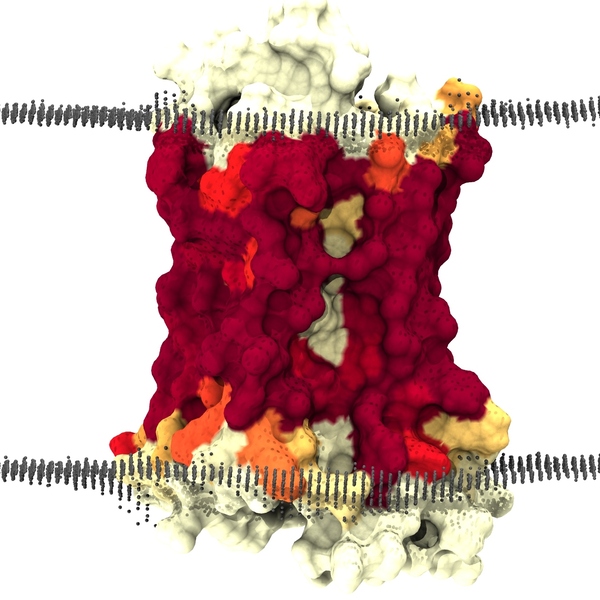
Атлас контактов β2-адренергического рецептора
Техническое замечание
Введение
β2-адренергический рецептор, или β2-адренорецептор, или β2AR (PDB ID: 2RH1, Uniprot ID: P07550) является одним из модельных трансмембранных рецепторов, чья структура и функция досконально изучена и на примере которых были разработаны основные методы для работы с трансмембранными белками. В нашей работе приведена общая характеристика β2AR, подробно рассмотрены различные типы контактов с его участием, их геометрические параметры, выдвинуты предположения о структурной и функциональной роли этих контактов, по возможности подкреплённые доказательствами из литературы.
Биосигнализация
β2AR относится к классу рецепторов, сопряжённых с G-белком (англ. G-protein-coupled receptors, GPCRs). β2AR опосредует катехоламин-индуцированную активацию аденилатциклазы через действие G-белков, находящихся на внутренней стороне мембраны. Gs-белки, участвующие в биосигнализации, стимулируют синтез cAMP аденилатциклазой. cAMP, в свою очередь, аллостерически активирует протеинкиназу A (PKA), которая фосфорилирует другие белки, активируя их [1]. Дальнейшая часть молекулярного каскада обеспечивает эффекты агонистов β2AR (Рис. 1).
Физиологическая роль
Ген, кодирующий β2AR, экспрессируется во многих тканях, в основном в гладких мышцах, жировой ткани и лейкоцитах [2]. В гладких мышцах активация рецептора стимулирует их расслабление, в жировых клетках активирует липолиз, в лейкоцитах по-разному изменяет их активность в зависимости от типа, возраста и цитокинового окружения лейкоцита [3], [4], [5]. Следовательно, мутации в гене β2AR тесно связаны с предрасположенностью к бронхиальной астме, сердечно-сосудистым заболеваниям и сахарному диабету II типа [6], [7].
Структура
β2AR Состоит из семи пронизывающих мембрану гидрофобных α-спиралей по 20-25 аминокислот в каждой, 3-х внеклеточных и 3-х внутриклеточных гидрофильных петель, внеклеточного N-концевого и внутриклеточного C-концевого доменов, формирующего α-спираль, присущую, как считается, всем GPCRs. Также α-спираль формирует середина второй внеклеточной петли [8]. Помимо этого в 2-х трансмембранных α-спиралях обнаружено по одной π-спирали, обеспечивающие их изгиб.
Из аминокислотных остатков наиболее важными являются остатки, составляющие центр связывания лиганда (см. Обратный агонист (S)-каразолол). Не менее важны остатки, отвечающие за связывание с G-белком, но в исследуемой структуре большая их часть удалена вместе с 3-ей внутриклеточной петлёй, поэтому в данной работе они не рассматриваются.
В нашей работе рассматривается структура химерного белка – β2AR-T4L: 3-я внутриклеточная петля человеческого β2AR заменена на T4-лизоцим (T4L) – небольшой гидрофильный и хорошо кристаллизуемый фермент бактериофага T4 (его аминокислотные остатки пронумерованы в pdb-файле четырёхзначными числами). Введение белков с такими свойствами в структуру трансмембранных белков способствует их кристаллизации. Также в исследуемой структуре отсутствуют 28 N-концевых и 22 C-концевых аминокислотных остатка, так как их электронная плотность на этих участках была получена в низком разрешении, и пространственное положение данных остатков определить было невозможно. Химерный белок не способен взаимодействовать с G-белком, но на другие функции β2AR T4-лизоцим не влияет. В работе в основном рассматриваются контакты, присутствующие в цельном β2AR [8], [9].
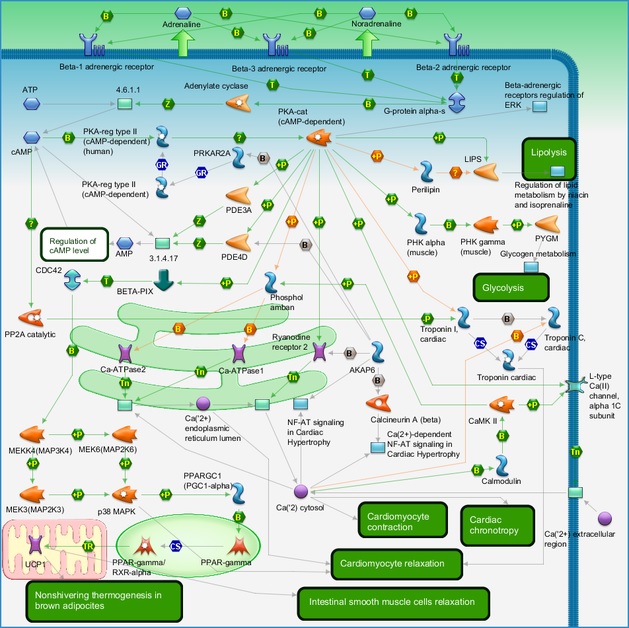
Рисунок 1. Карта сигнальных путей β-адренергических рецептов.
По ссылке дана функциональная версия карты с возможностью посмотреть описание каждого элемента каскада.
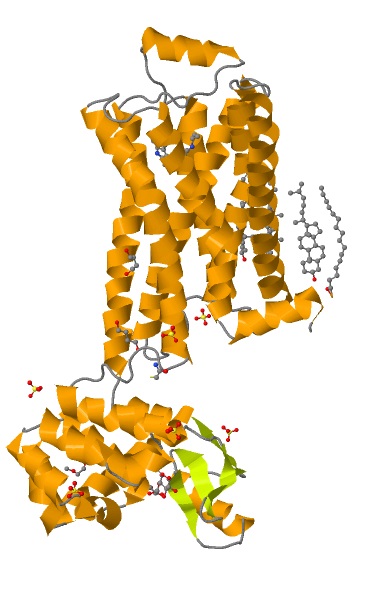
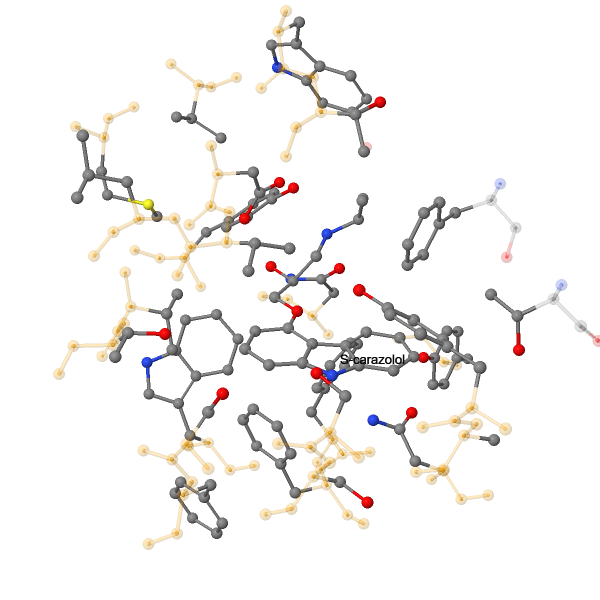
Рисунок 2. Общий вид молекулы с лигандами. Окраска по структуре.
Описание лигандов
| Название в номенклатуре IUPAC | Химическая формула | Брутто-формула | Молярная масса, г/моль | Ссылка на PubChem | Функция | Как лиганд оказался в модели |
|---|---|---|---|---|---|---|
| Сульфат-ион |
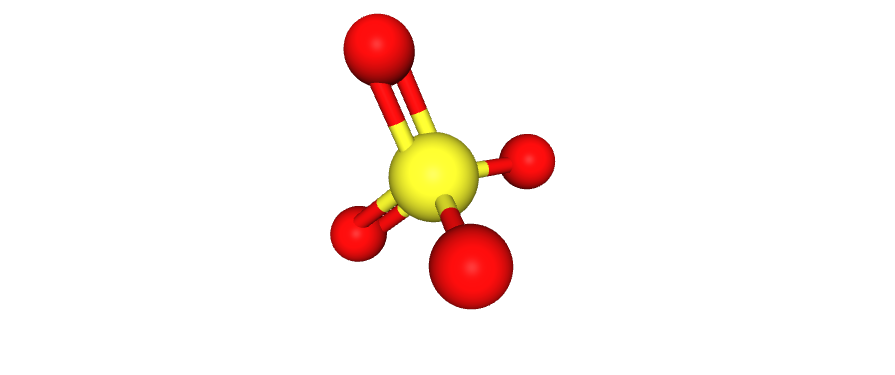
|
SO4 | 96.07 | 1117 | Необходим для кристаллизации [8] | Компонент смеси для кристаллизации |
| Ацетамид |
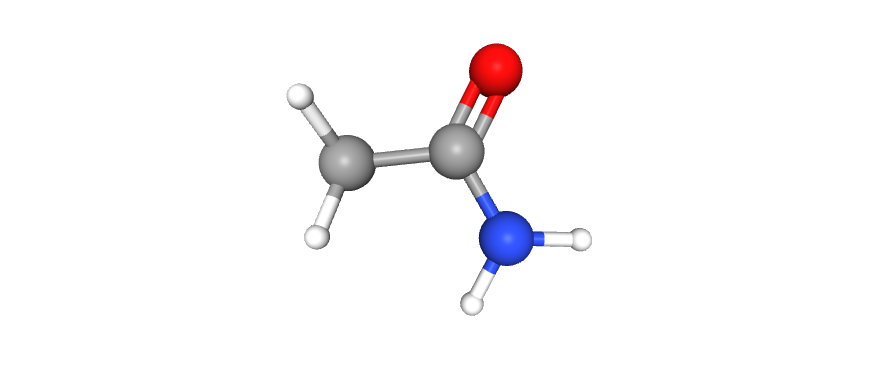
|
C2H5NO | 59.07 | 178 | Используется для связывания свободных тиольных групп [10] | После обработки им рецептора ковалентно связался с Cys265 |
| (2S)-1-(9H-карбазол-4-илокси)-3-(изопропиламино)пропан-2-ол |
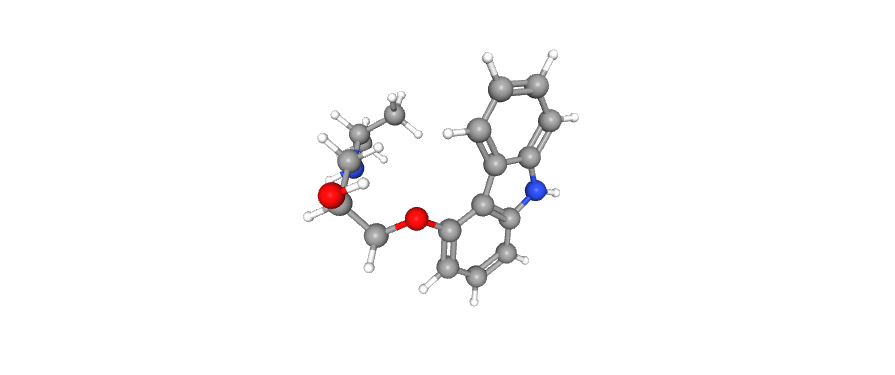
|
C18H22N2O2 | 298.4 | 13023332 | Частично обратный агонист | Природный лиганд |
| Пальмитиновая кислота |
|
C16H32O2 | 256.42 | 985 | Для кристаллизации, заякоривание в мембране [11] | Как компонент для упаковки в кристалл, одна из молекул ковалентно связана с белком |
| 1,4-бутандиол |
|
C4H10O2 | 90.12 | 8064 | Повышает дифракционное разрешение кристалла [8] | Компонент смеси для кристаллизации |
| Холестерол |
|
C27H46O | 386.7 | 5997 | Заякоривает белок в мембране, обеспечивает взаимодействие рецептор-рецептор и образование димеров рецептора, повышает дифракционное разрешение кристалла [8] | Компонент смеси для кристаллизации |
| Додекаэтиленгликоль |
|
C24H50O13 | 546.6 | 81248 | Необходим для кристаллизации [8] | Компонент смеси для кристаллизации |
| α-D-глюко-гексопиранозил-(1->4)-α-D-глюко-гексопираноза |
|
C12H22O11 | 342.3 | 6255 | Отсутствует | Вероятно, прочно связалась с рецептором на стадии наработки белка |
Визуализация структуры β2AR-T4L в JMol-апплете
Ниже находится JMol-апплет с возможностью запустить скрипты, показывающие различные контакты. Запустить скрипт можно по соответствующей кнопке. Большинство скриптов состоят из нескольких фрагментов. Кнопка "Далее" осуществляет переход к следующему фрагменту. Кнопка "Сохранить изображение" сохраняет экран апплета в формате JPEG. Стартовый скрипт возвращает структуру в исходное состояние. Тексты скриптов приведены в сопроводительных материалах.
Белок-белковые контакты
Поиск всех белок-белковых контактов кроме дисульфидных мостиков и π-водородной связи осуществлялся с помощью сервиса PIC [12]. Полученные данные приведены в сопроводительных материалах. Поиск π-спиралей был выполнен вручную, по паттерну расположения водородных связей i – i+5 (i – номер а.о., образующего водородную связь). Одна из π-спиралей также имеет i – i+4 водородные связи, но её можно распознать по большему, чем у α-спирали, радиусу [13].
Водородные связи
| № | Донор - акцептор | Длина связи (Å) |
|---|---|---|
| α-спирали | ||
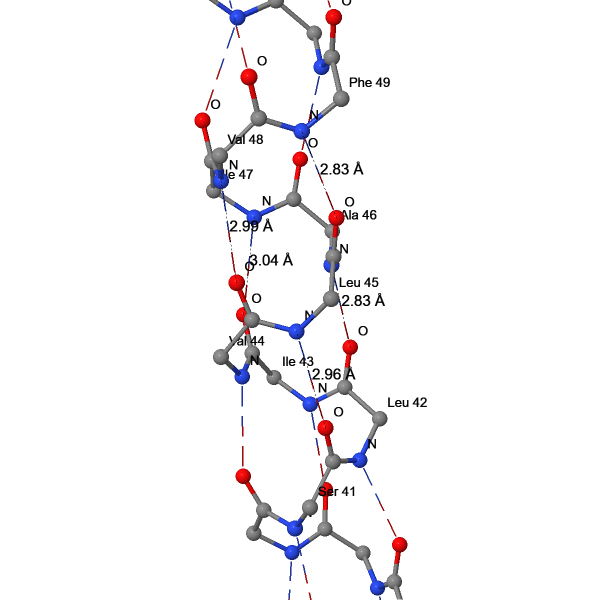
| 1 | O(SER41) – N(LEU45) | 2.96 |
| 2 | O(LEU42) – N(ALA46) | 2.83 |
| 3 | O(ILE43) – N(ILE47) | 3.04 |
| 4 | O(VAL44) – N(VAL48) | 2.99 |
| 5 | O(LEU45) – N(PHE49) | 2.83 |
| Среднее значение | 2.93 | |
| Ожидаемое среднее значение [14] | 2.99±0.14 | |
| β-тяжи | ||
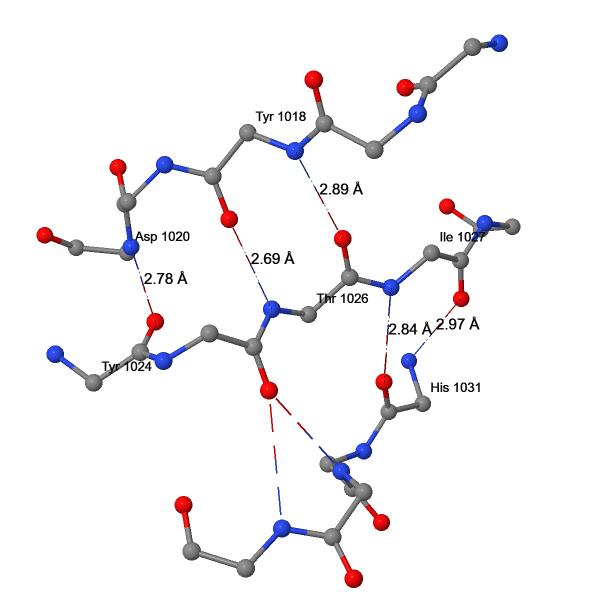
| 6 | O(TYR1024) – N(ASP1020) | 2.78 |
| 7 | O(TYR1018) – N(THR1026) | 2.69 |
| 8 | O(THR1026) – N(TYR1018) | 2.89 |
| 9 | O(HIS1031) – N(ILE1027) | 2.84 |
| 10 | O(ILE1027) – N(HIS1031) | 2.97 |
| Среднее значение | 2.83 | |
| Ожидаемое среднее значение [14] | 2.91±0.14 | |
| π-спирали | ||
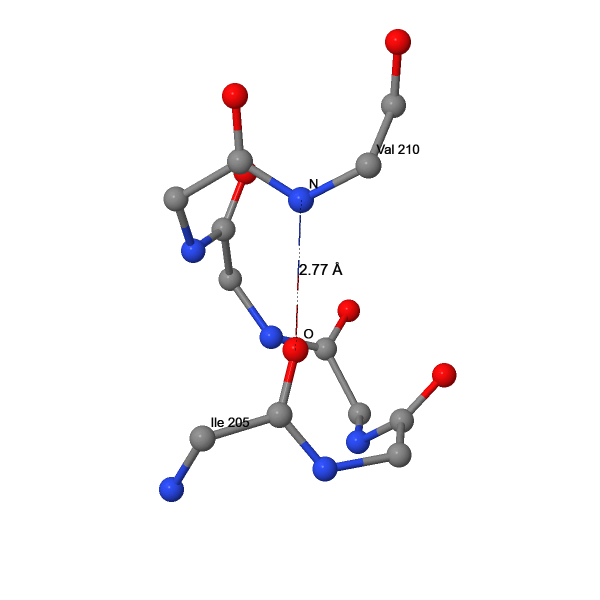
| 11 | O(ILE205) – N(VAL210) | 2.77 |
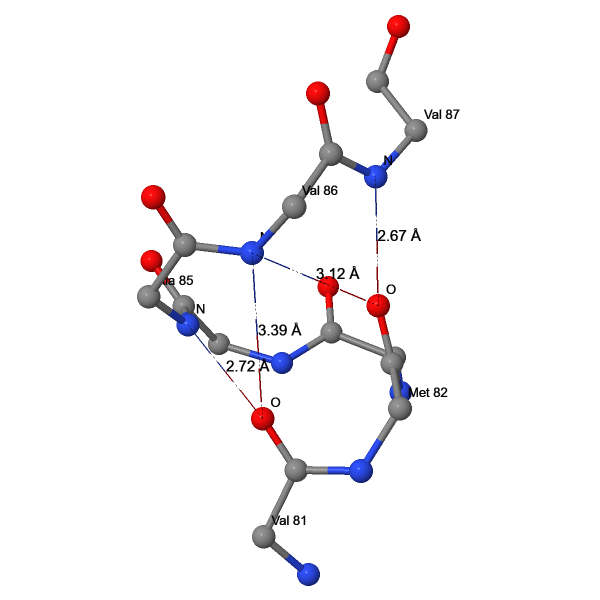
| 12 | O(VAL81) – N(ALA85) | 2.72 |
| 13 | O(VAL81) – N(VAL86) | 3.39 |
| 14 | O(MET82) – N(VAL86) | 3.12 |
| 15 | O(MET82) – N(VAL87) | 2.67 |
| Среднее значение | 2.93 | |
| Между боковым радикалом и остовом | ||
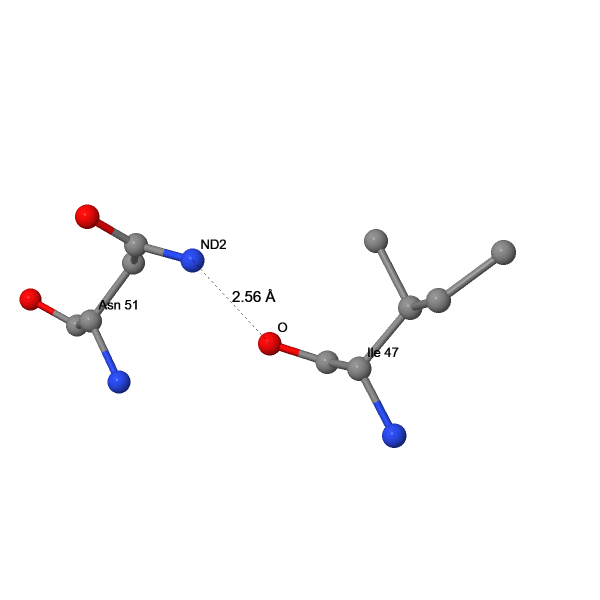
| 16 | O(ILE47) – ND2(ASN51) | 2.56 |
| Ожидаемое значение [14] | 2.95±0.17 | |
| Между двумя боковыми радикалами | ||
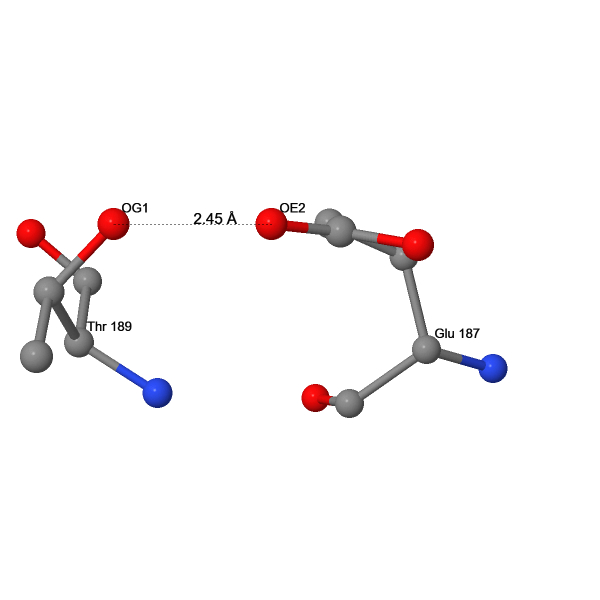
| 17 | OE2(GLU187) – OG1(THR189) | 2.45 |
| Ожидаемое значение [14] | 2.78±0.22 | |
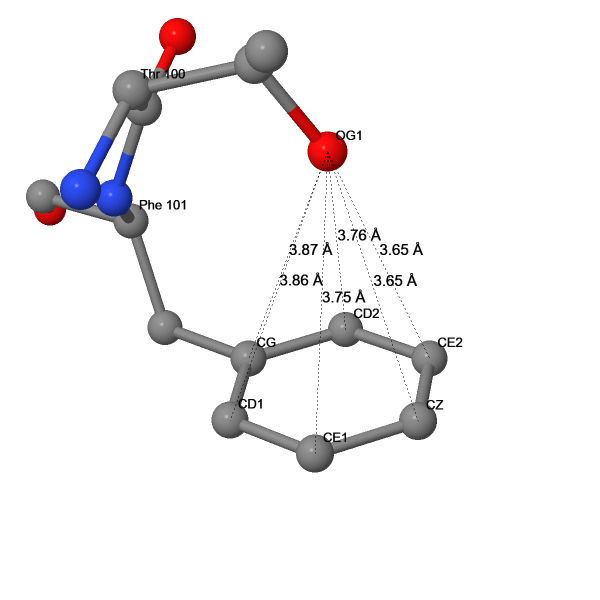
| π-водородная связь | ||
| 18 | OG1(THR100) – CG(PHE101) | 3.87 |
| 19 | OG1(THR100) – CD1(PHE101) | 3.86 |
| 20 | OG1(THR100) – CD2(PHE101) | 3.76 |
| 21 | OG1(THR100) – CE1(PHE101) | 3.75 |
| 22 | OG1(THR100) – CE2(PHE101) | 3.65 |
| 23 | OG1(THR100) – CZ(PHE101) | 3.65 |
| Среднее значение | 3.76 | |
| Ожидаемое среднее значение [15] | 3.412 | |
Водородная связь – это слабая нековалентная связь между одним электроотрицательным атомом (акцептором протона) и атомом водорода, связанным с другим электроотрицательным атомом (донором протона). Образуется за счёт того, что на атоме водорода есть δ+, а на не связанном с ним электрооттрицательном атоме есть δ-, что обеспечивает их притяжение.
Межостовные водородные связи в большинстве случаев поддерживают вторичную структуру белка. В β2AR за счёт таких связей сформированы α-спирали, β-листы и π-спирали (Рис. 3-6). В рассматриваемой α-спирали и β-листе длины водородных связей соответствуют ожидаемым значениям (Табл. 2). В π-спирали они в среднем совпадают с таковыми в α-спиралях, однако если не учитывать неканоничные для π-спиралей i – i+4 связи (№12 и №14) и связь на границе с α-спиралью (№13), то длина водородных связей в π-спиралях (2.72 Å) окажется заметно меньше, чем в α-спиралях, что соответствует литературным данным о меньшем подъёме (rise) π-спирали.
Водородные связи между боковыми радикалом и остовом или между двумя боковыми радикалами могут поддерживать вторичную, третичную и четвертичную структуру белка. Водородная связь O(Ile47)–ND2(Asn51) (Рис. 7) стабилизирует α-спираль, в которой находятся эти остатки, связывая два соседних её витка. Водородная связь OE2(Glu187)–OG1(Thr189) (Рис. 8) создаёт резкий поворот второй внеклеточной петли на 180°, благодаря которому она не закрывает карман с центром связывания лиганда.
В π-водородной связи в качестве акцептора протона выступает π-электронное облако ароматического кольца. Поиск данной связи 4L-β2AR осуществлялся визуально в JMol. Рассматриваемый пример (Рис. 9) иллюстрирует взаимодействие между гидрофобным ядром (Phe101) и гидрофильной внеклеточной поверхностью рецептора (Thr100).
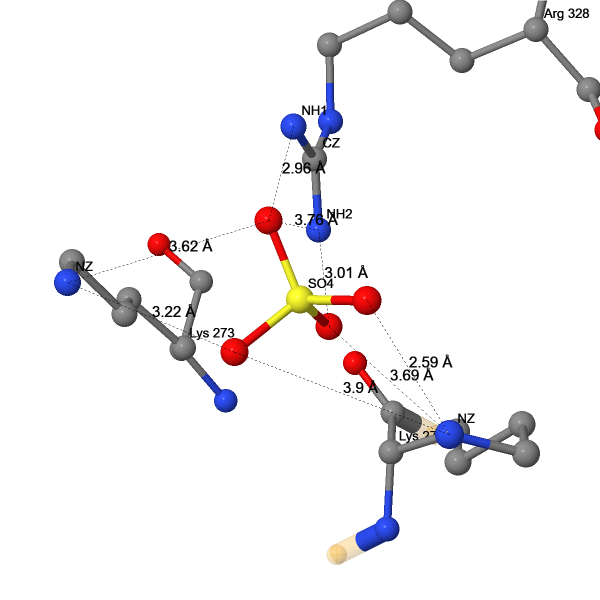
Солевые мостики
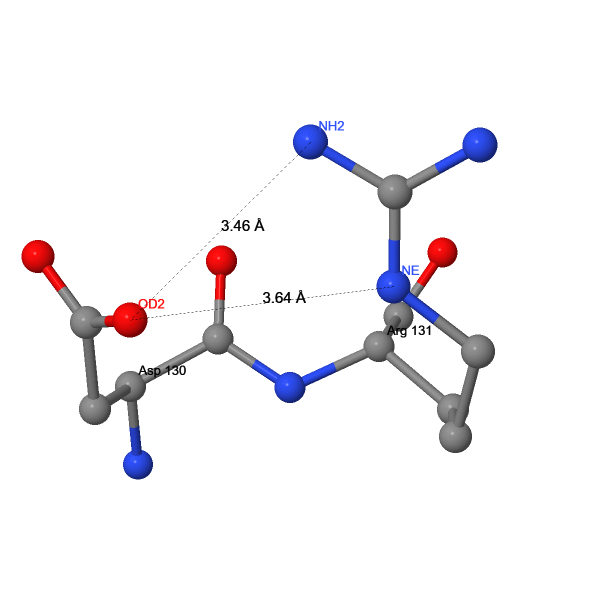
Солевые мостики – вид электростатического взаимодействия в белке, возникающий между положительно и отрицательно заряженными атомами боковых цепей аминокислотных остатков. Солевые мостики в β2AR находятся на концах трансмембранных спиралей и во внеклеточных доменах (Рис. 10). Мы рассмотрели два наиболее каноничных из них (Рис. 10, 11), длины которых не выходят за рамки среднестатистических значений (Табл. 3).
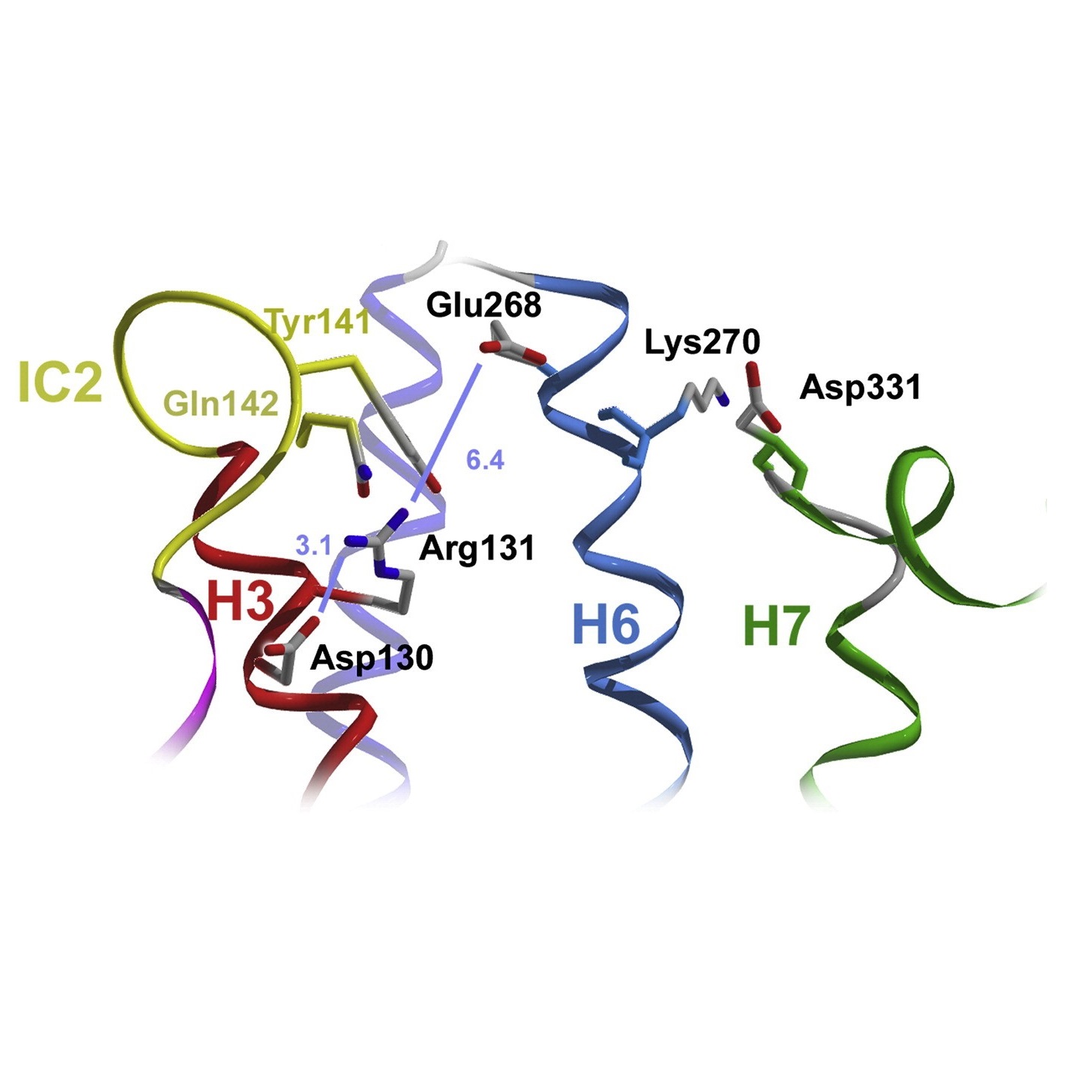
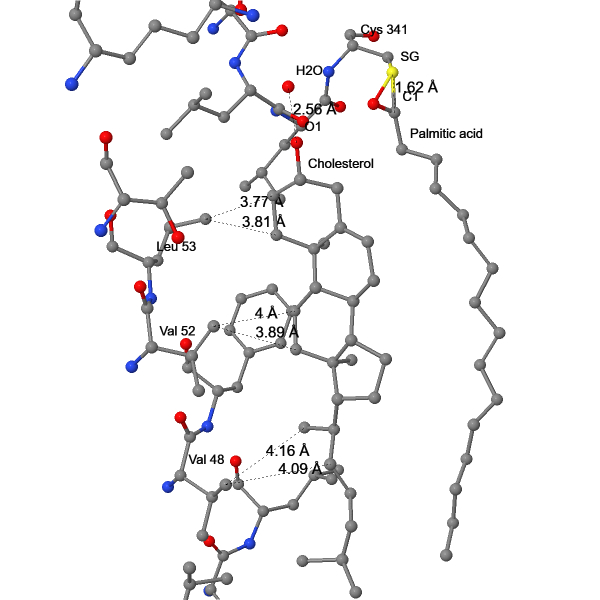
Солевой мостик, образованный парой Arg131/Asp130, способствует формированию другого солевого мостика, Arg131/Glu268, который соединяет внутриклеточные концы 3 и 6 трансмембранных спиралей, создавая "ионный замок" [16]: при образовании этого мостика рецептор неспособен взаимодействовать с G-белком (Рис. 12). Так как в рассматриваемой структуре рецептор связан с обратным агонистом, то он находится в активной форме, поэтому мостик Arg131/Glu268 здесь отсутствует.
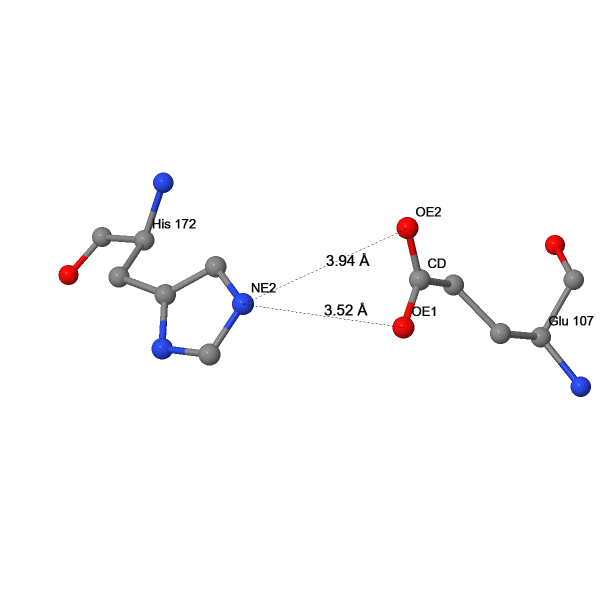
Солевой мостик His172/Glu107 связывает внеклеточные концы 3 и 4 трансмембранных спиралей. Вероятно, это фиксирует их пространственное положение.
| № | Катион – анион | Длина связи (Å) |
|---|---|---|
| 1 | NH2(131ARG) – OD2(130ASP) | 3.46 |
| 1 | NE(131ARG) – OD2(130ASP) | 3.64 |
| 2 | NE2(172HIS) – OE1(107ASP) | 3.52 |
| 2 | NE2(172HIS) – OE2(107ASP) | 3.94 |
| Ожидаемые значения[17] | 1.75–4.00 | |
Дисульфидные мостики
| № | Имена атомов | Длина связи (Å) |
|---|---|---|
| 1 | SG(106CYS) – SG(191CYS) | 2.05 |
| 2 | SG(184CYS) – SG(190CYS) | 2.06 |
| Среднее значение | 2.055 | |
| Ожидаемое среднее значение [18] | 2.05 | |
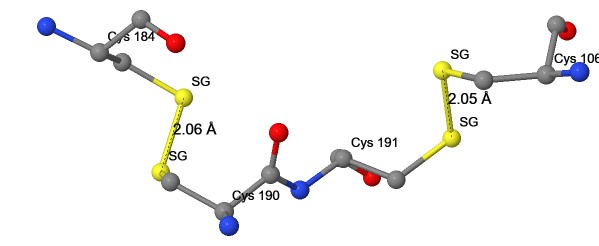
Рисунок 13. Дисульфидные связи.
Дисульфидная связь – это ковалентная связь между двумя атомами серы остатков цистеина. Образуется при окислении двух несвязанных остатков цистеина [1]. В исследуемом белке обнаружены две дисульфидные связи (Рис. 13). Они были найдены путём выделения в белке остатков цистина - димера цистеина. Длины дисульфидных связей соответствуют ожидаемым значениям (Табл. 4). Данные 2 дисульфидных мостика находятся на 2-х внеклеточных петлях рецептора, один из них соединяет эти петли. Видимо, это играет важную роль в обеспечении взаимодействия лиганда с рецептором, так как замещение формирующих мостики цистеинов вызвало снижение аффинности связывания агонистов на величины от 1 до 3 порядков и на 1 порядок для антагонистов [19]. Скорее всего это вызвано тем, что 2-я внеклеточная петля без фиксирующих её положение дисульфидных мостиков загораживает карман с центром связывания, создавая физическую преграду для проникновения туда лиганда.
Стэкинг
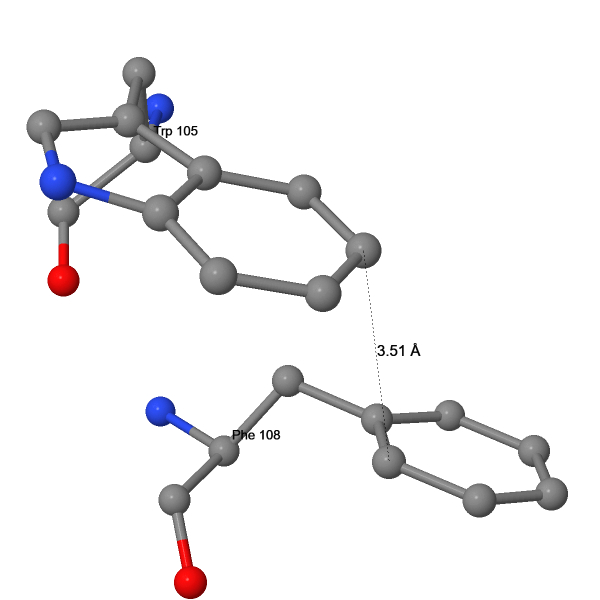
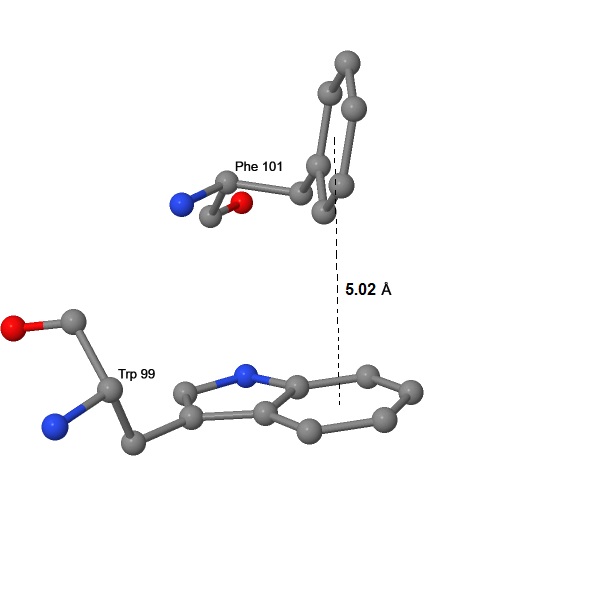
Стэкинг-взаимодействия – нековалентные взаимодействия ароматических колец, обусловленные притяжением между положительно заряженными атомами одного кольца и отрицательно заряженным π-электронным облаком по обе стороны от другого кольца, в результате чего перекрываются π-орбитали двух колец. Выделяют параллельно сдвинутый стэкинг – с параллельно расположенными кольцами, и Т-стэкинг – с перпендикулярными кольцами. В β2AR стэкинг обильно представлен в гидрофобных ядрах (Рис. 14-15). В нашей работе рассмотрены типичные примеры таких взаимодействий (Табл. 5).
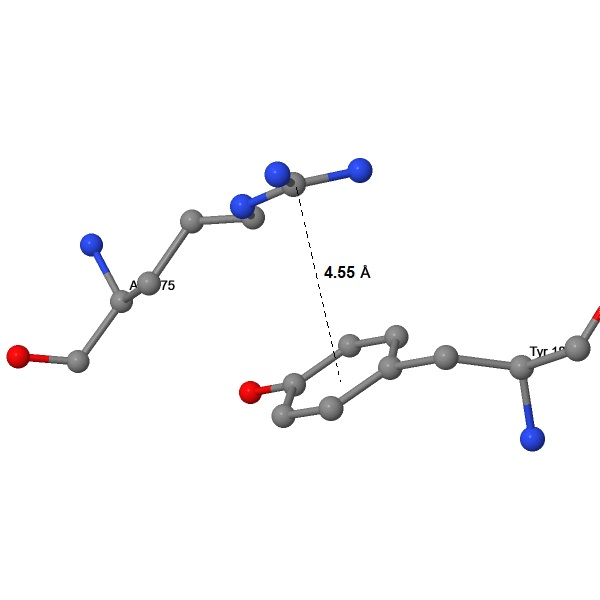
π-катионный стэкинг (π-катионные взаимодействия) – нековалентные взаимодействия между π-электронным облаком ароматического кольца и расположенным над ним катионом, в случае белков с радикалами аргинина или лизина. В исследуемом белке обнаружено взаимодействие аргинина с тирозином во 2-ой внеклеточной петле (Рис. 16). Скорее всего оно обеспечивает компактную укладку петли вместе с дисульфидными мостиками и водородной связью №17.
| Взаимодействующие остатки | Тип стэкинга | Расстояние (Å) | Угол (°) | ||
|---|---|---|---|---|---|
| Trp105 и Phe108 | Параллельно сдвинутый | Между плоскостями ароматических колец | ≈3.51 | Между плоскостями ароматических колец | 11.96 |
| Ожидаемые значения [20] | 3.3–3.6 | 0 | |||
| Trp99 и Phe101 | Т-стэкинг | Между центрами ароматических колец (6-членного у Trp) | 5.02 | Между плоскостями ароматических колец | 74.13 |
| Ожидаемые значения [20] | 4.96 | 90 | |||
| Arg175 и Tyr185 | π-катионный | Между CZ аргинина и центром кольца тирозина | 4.55 | Между плоскостями гуанидиновой группы и ароматического кольца | 23.31 |
| Ожидаемое значение при данном угле [21] | 4.1±0.2 | ||||
Исследование гидрофобного ядра
Гидрофобные взаимодействия – явление слипания гидрофобных радикалов в белке в гидрофобные ядра, обусловленное тем, что образование контактов между водой и неполярными молекулами термодинамически не выгодно: любая гидрофобная молекула в водном растворе окружена структурированной оболочкой из молекул воды (сольватной оболочкой). Возрастание упорядоченности молекул воды в сольватной оболочке по сравнению с чистой водой характеризуется неблагоприятным с термодинамической точки зрения понижением энтропии. Однако если неполярные группы растворенного вещества собираются вместе и образуют кластеры, то размеры сольватной оболочки уменьшаются, так как тогда не вся поверхность неполярных групп экспонирована в раствор, энтропия повышается. Поэтому по второму закону термодинамики образуются гидрофобные взаимодействия [1]
Так как β2AR трансмембранный, гидрофобные ядра представлены в нём в большом количестве (Рис. 17). Их можно найти командой select hydrophobic, а выделить из них одно гидрофобное ядро можно с помощью соответствующего сервиса [22].
Для исследования плотности упаковки атомов в гидрофобном ядре было выбрано окружение тирозина Tyr326. Атомы на расстоянии в 1 ангстрем отсутствуют, и только начиная с расстояния в 2 ангстрема, появляются два атома. Начиная с расстояния в 7 ангстрем, атомы Tyr326 практически полностью закрыты. Для вычисления характерного расстояния между соседними не связанными ковалентно атомами в гидрофобном ядре было рассчитано среднее 25 расстояний (Рис. 18). Среднее расстояние оказалось равным 4,24 ангстрем (Табл. 6). Межатомное расстояние, необходимое для размещения молекулы воды (принимается за один атом кислорода, так как атомы водорода пренебрежимо малы) можно рассчитать, исходя из ван-дер-ваальсовых радиусов кислорода (1,4 Å) и углерода (1,85 Å) [23]. Оно равно: 2*1,4 + 2*1,85 = 6,5. Так как максимальное измеренное расстояние между атомами меньше этого значения, то молекула воды поместиться в это гидрофобное ядро не может. Расчёт проведён для атомов углерода, так как при рассмотрении размещения воды между другими атомами не учитываются их соседние атомы углерода, из-за которых реальное свободное пространство между атомами может оказаться меньше рассчитанного (именно углерода, так как у него наибольший радиус).

Рисунок 17. Топография гидрофобных ядер в T4-β2AR (выделены зелёным).
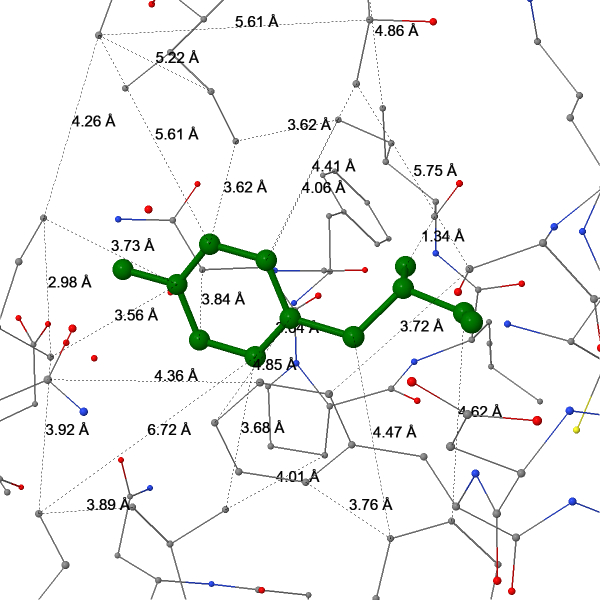
Рисунок 18. Расстояния между атомами в гидрофобном ядре.
| № | Имена атомов | Расстояние (Å) |
|---|---|---|
| 1 | СD2(326TYR) – СG2(274THR) | 4.41 |
| 2 | СE2(326TYR) – СD2(275LEU) | 5.61 |
| 3 | СB(274THR) – СD2(275LEU) | 5.61 |
| 4 | СD2(275LEU) – СG1(278ILE) | 5.22 |
| 5 | СB(329SER) – СG2(274THR) | 5.75 |
| 6 | СD1(332PHE) – СB(329SER) | 3.72 |
| 7 | СE1(332PHE) – СG(69ASN) | 4.36 |
| 8 | СD1(278ILE) – СD1(325ILE) | 3.62 |
| 9 | СG2(325ILE) – СA(274THR) | 4.86 |
| 10 | СE2(326TYR) – СD1(278ILE) | 3.62 |
| 11 | СE2(336PHE) – С(326TYR) | 4.62 |
| 12 | СZ(336PHE) – СB(326TYR) | 4.47 |
| 13 | СD2(332PHE) – СZ(336PHE) | 3.76 |
| 14 | СZ(332PHE) – СG(326TYR) | 4.85 |
| 15 | СD1(326TYR) – СG2(54VAL) | 3.68 |
| 16 | СD1(325ILE) – СD1(322ASN) | 4.06 |
| 17 | СG1(54VAL) – СD1(58ILE) | 3.89 |
| 18 | СZ(326TYR) – СG2(72ILE) | 3.56 |
| 19 | СB(322ASN) – СE1(326TYR) | 3.84 |
| 20 | СG2(54VAL) – СB(323PRO) | 4.01 |
| 21 | СD1(326TYR) – С(322ASN) | 3.64 |
| 22 | СD1(58ILE) – СG2(72ILE) | 3.92 |
| 23 | СZ(326TYR) – СD1(72ILE) | 3.73 |
| 24 | СD1(72ILE) – СG2(72ILE) | 2.98 |
| 25 | СD2(275LEU) – СD1(72ILE) | 4.26 |
| Среднее значение | 4.24 | |
| Максимальное значение | 5.75 | |
| Необходимое для размещения молекулы воды расстояние | 5.10 | |
Взаимодействия с лигандами
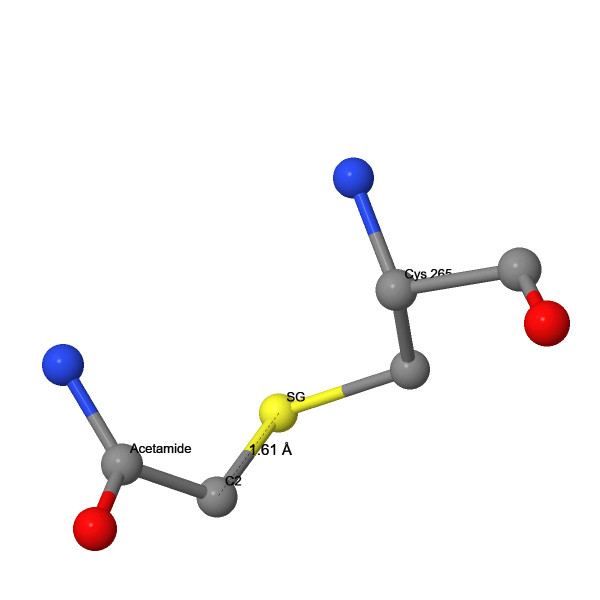
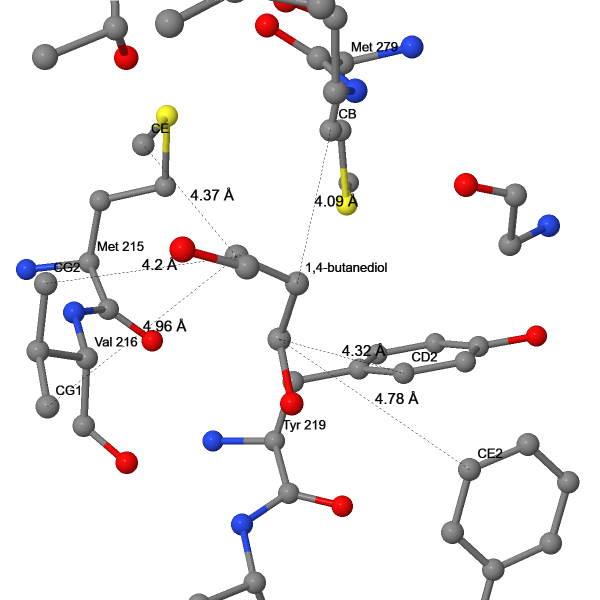
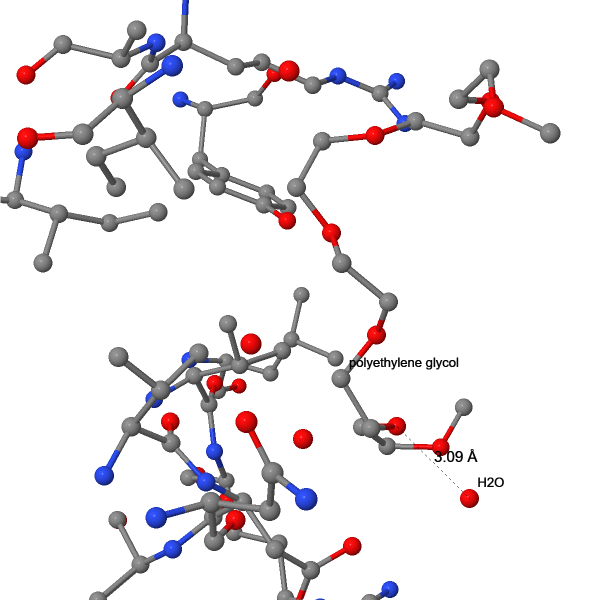
При рассмотрении взаимодействий лигандов (Табл. 1) с рецептором было найдено большинство типов связей, описанных ранее (Рис. 19-24). Поиск связей осуществлялся визуально после применения команды select within('Group', within(6.0, <Код лиганда>)), которая выделяет все аминокислотные остатки, способные взаимодействовать с лигандом. Сульфат связан с белком многочисленными ионными мостиками, ацетамид – прочной ковалентной связью через цистеин, пальмитиновая кислота – тоже через цистеин, тиоэфирной связью. Пальмитилирование Cys341 способствует заякориванию C-конца рецептора и имеет большое функциональное значение: замена этого остатка приводит к образованию нефункциональной формы рецептора, неспособной взаимодействовать с G-белком [10]. Также пальмитиновая кислота гидрофобно взаимодействует с холестеролом. Холестерол имеет обширные гидрофобные взаимодействия с остатками валина и фенилаланина. 1,4-бутандиол и додекаэтиленгликоль тоже гидрофобно слипаются с белком. Это подтверждается расстояниями между атомами углерода в этих лигандах и белке, близкими к таковым расстояниям в исследованном гидрофобном ядре. Длины измеренных связей других типов тоже не сильно отличаются. Также холестерол и додекаэтиленгликоль образуют водородные связи с молекулами воды.
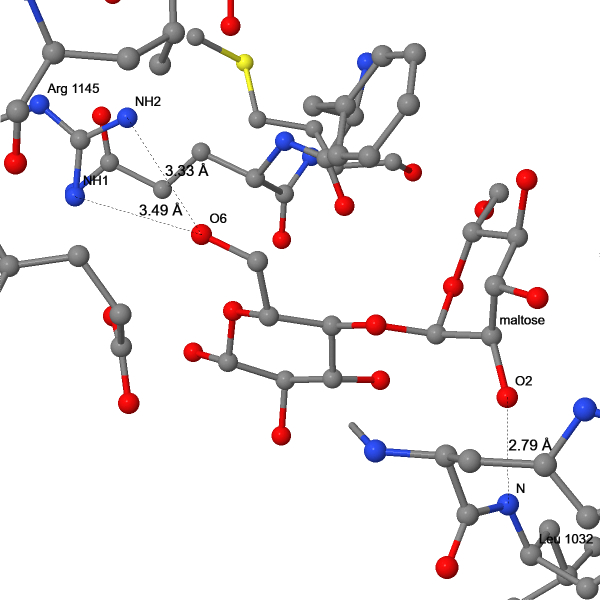
Мальтоза (α-D-глюко-гексопиранозил-(1->4)-α-D-глюко-гексопираноза по IUPAC) связана с T4L-доменом водородными связями. Она находится в активном центре лизоцима [24], из чего следует, что он также может связывать углеводы с α-гликозидной связью.
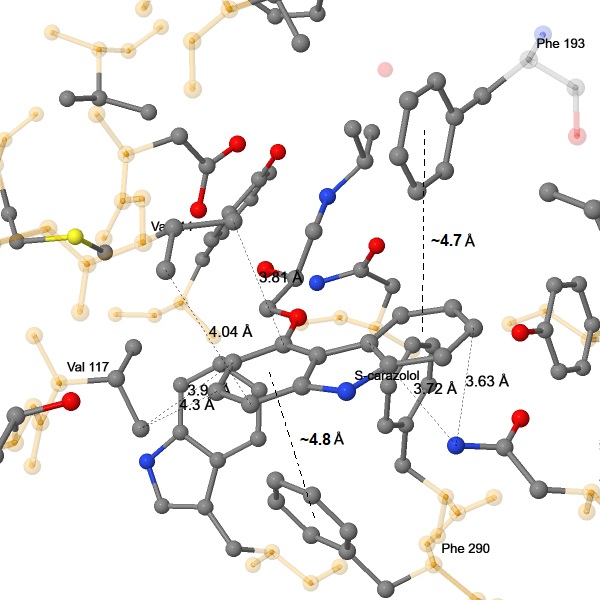
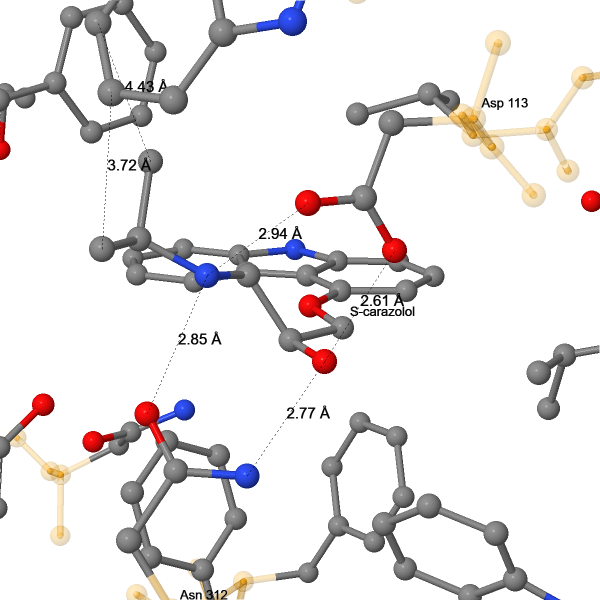
Обратный агонист (S)-каразолол
Особое внимание стоит уделить взаимодействию β2AR с (S)-каразололом (по IUPAC – (2S)-1-(9H-карбазол-4-илокси)-3-(изопропиламино)пропан-2-олом) – частично обратным агонистом, создающим эффекты, обратные β2-адренергическим (см. Физиологическая роль). (S)-каразолол находится в глубоком кармане внеклеточной поверхности рецептора (рис. 25). Его карбозольное кольцо связано с рецептором гидрофобными взаимодействиями, T-стэкингом и π-водородной связью (рис. 26). Эти же связи могут возникать при связывании ароматическаих колец катехоламинов. Хвост (S)-каразолола удерживается четырьмя водородными связями, а также гидрофобными взаимодействиями (рис. 27). Так как в молекуле адреналина тоже есть алкиламинная и гидроксильные группы на хвосте, то с адреналином эти связи также образуются, из чего следует, что перечисленные взаимодействия являются ключевыми для связывания лигандов. Исходя из полученных данных, центр связывания лиганда в β2AR состоит из 8 аминокислотных остатков: Phe193, Phe290, Val114, Val117 и Asn293 связывают ароматическое кольцо лиганда, а Asn312, Asp113 и Trp109 связывают его хвост. Это число является максимальным, так как лиганды с шестичленными ароматическими кольцами будут образовывать меньше связей, чем (S)-каразолол.
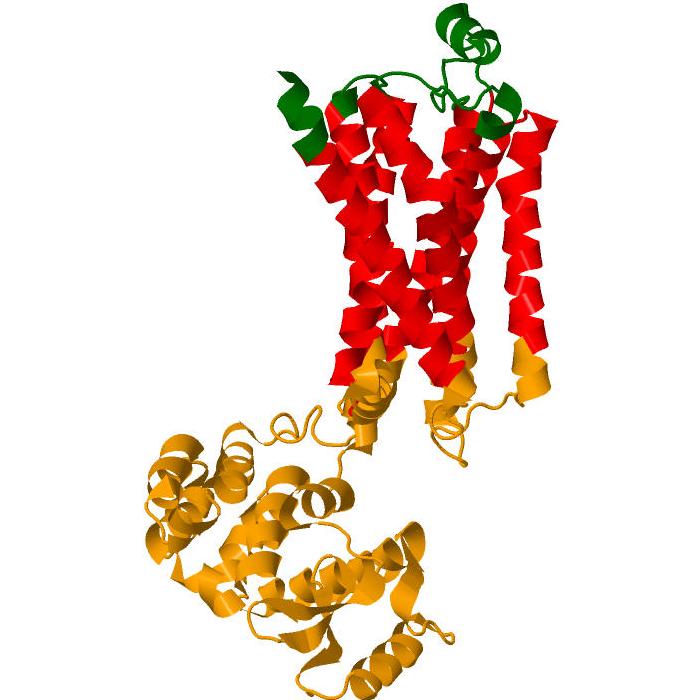
Положение в мембране
Предсказание программы TMHMM (Рис. 32, Табл. 7) подтверждает наличие у β2AR 4 трансмембранных участка в виде α-спиралей, находящихся N-концом наружу. На Рис. 28 изображена разметка белка, сделанная по данным о положении элементов относительно мембраны, взятым из базы данных Uniprot, в Jmol, на которой зелёный, красный, оранжевый цвета обозначают внеклеточные, мембранные и внутриклеточные фрагменты соответственно. В других базах данных и программах положение рецептора относительно мембраны не отличается (Рис. 27, 30, 31) [25], [26], [27], [28]. Причём положение одинаково для β2AR и β2AR-T4L. Следовательно, T4-лизоцим не влияет на взаимодействие рецептора с мембраной, и большинство структурных предсказаний для трансмембранных участков β2AR можно получать на примере β2AR-T4L.
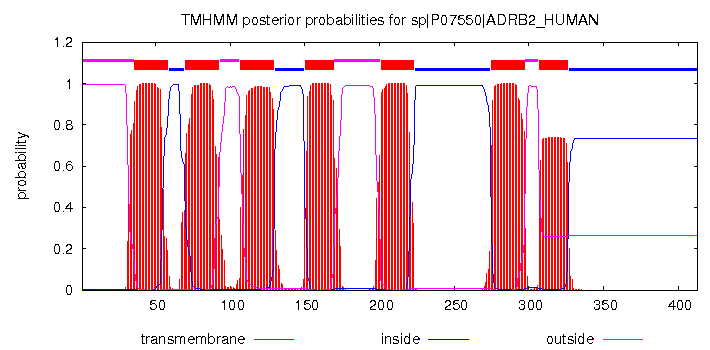
Рисунок 32. Предсказание TMHMM.
| № участка | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внеклеточные | 1-35 | 93-106 | 170-200 | 298-306 | |||||||||||
| Трансмембранные | 36-58 | 70-92 | 107-129 | 150-169 | 201-223 | 275-297 | 307-326 | ||||||||
| Внутриклеточные | 59-69 | 130-149 | 224-274 | 327-413 |
Личный вклад
Альфия Алимова: общая характеристика, структура, скрипт и текст про солевые мостики.
Артём Васильев: скрипты и текст про водородные связи, дисульфидные мостики, стекинг и взаимодействия с лигандами, доработка остальных частей, вёрстка страницы с отчётом.
Артём Батин: текст, скрипт и рисунок по исследованию гидрофобных взаимодействий.
Егор Шмарион: текст и картинки по исследованию положения в мембране, вёрстка "карусели" для рисунков.
Сопроводительные материалы
- Тексты скриптов.
- Данные о белок-белковых контактах.
Список литературы
- Д.Нельсон, М.Кокс. Основы биохимии Ленинджера: в 3 т. Т.1: Основы биохимии, строение и катализ. Пер. с англ. – 3-е изд, испр. – М.: Лаборатория знаний, 2017. – 694 с. ISBN: 978-5-00101-014-2
- Страница β2AR в базе данных Tissue atlas портала The human protein atlas.
- Johnson M. "Molecular mechanisms of beta(2)-adrenergic receptor function, response, and regulation". The Journal of Allergy and Clinical Immunology. 2006 Jan; 117 (1): 1824, quiz 25. DOI: 10.1016/j.jaci.2005.11.012
- Kurylowicz A., Jonas M., Lisik W., Jonas M., Wicik Z.A., Wierzbicki Z. et al. Obesity is associated with a decrease in expression but not with the hypermethylation of thermogenesis-related genes in adipose tissues. J Transl Med 2015; 13: 31. DOI: 10.1186/s12967-015-0395-2
- Sanders V.M. The beta2-adrenergic receptor on T and B lymphocytes: do we understand it yet? Brain Behav. Immun. 2012; 26:195200. DOI: 10.1016/j.bbi.2011.08.001
- Contopoulos-Ioannidis D.G., Manoli E.N., Ioannidis J.P. Meta-analysis of the association of beta2-adrenergic receptor polymorphisms with asthma phenotypes. J Allergy Clin Immunol. 2005 May; 115(5):963-72. DOI: 10.1016/j.jaci.2004.12.1119
- Dallongeville, Helbecque N., Cottel D., Amouyel P., Meirhaeghe A. The Gly16–>Arg16 and Gln27–>Glu27 polymorphisms of beta2-adrenergic receptor are associated with metabolic syndrome in men. J Clin Endocrinol Metab, 88:4862-4866. DOI: 10.1210/jc.2003-030173
- Cherezov V., Rosenbaum D.M., Hanson M.A., Rasmussen S.G., Thian F.S., Kobilka T.S., Choi H.J., Kuhn P., Weis W.I., Kobilka B.K., Stevens R.C. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. J Science. 2007; 318(5854):1258–65. DOI: 10.1126/science.1150577.
- Mathew, E., Ding, F.-X., Naider, F., & Dumont, M. E. Functional fusions of T4 lysozyme in the third intracellular loop of a G protein-coupled receptor identified by a random screening approach in yeast. Protein Engineering Design and Selection. 2012; 26(1), 5971. DOI: 10.1093/protein/gzs070.
- Liu D., Zhang L. Structure and Properties of Soy Protein Plastics Plasticized with Acetamide. J Macromolecular Materials and Engineering. 2006; 291(7), 820–828. DOI: 10.1002/mame.200600098.
- O'Dowd B.F., Hnatowich M., Caron M.G., Lefkowitz R.J., Bouvier M. Palmitoylation of the human beta 2-adrenergic receptor. Mutation of Cys341 in the carboxyl tail leads to an uncoupled nonpalmitoylated form of the receptor. J Biol Chem. 1989; 264(13):7564-9. PMID: 2540197.
- Сервис для поиска белковых взаимодействий.
- Kumar P., Bansal M.. Dissecting πhelices: sequence, structure and function. FEBS J., 2015; 282 , 4415 4432 2017; 18:279. DOI: 10.1111/febs.13507.
- Baker, E. N., & Hubbard, R. E. Hydrogen bonding in globular proteins. Prog Biophys Mol Biol. 1984; 44(2):97-179. DOI: 10.1016/0079-6107(84)90007-5.
- Scheiner S., Kar T., Pattanayak J. Comparison of Various Types of Hydrogen Bonds Involving Aromatic Amino Acids. J. Am. Chem. Soc. 2002; 124, 1325713264. DOI: 10.1021/ja027200q.
- Dror R.O., Arlow D.H., Borhani D.W., Jensen M.Ø., Piana S., Shaw D.E. Identification of two distinct inactive conformations of the β2-adrenergic receptor reconciles structural and biochemical observations. Proc. Natl. Acad. Sci. USA 2009; 106:468994. DOI: 10.1073/pnas.0811065106.
- Barlow D.J., Thornton J.M. Ion-pairs in proteins. J Mol Biol. 1983 Aug 25;168(4):867-85. DOI: 10.1016/s0022-2836(83)80079-5.
- Sun M.A., Wang Y., Zhang Q., Xia Y., Ge W., Guo D. Prediction of reversible disulfide based on features from local structural signatures. BMC Genomics. 2017; 18:279. DOI: 10.1186/s12864-017-3668-8.
- Ostrowski J., Kjelsberg M.A., Caron M.G., Lefkowitz R.J. Mutagenesis of the beta2-Adrenergic Receptor: How Structure Elucidates Function. J Annual Review of Pharmacology and Toxicology, 1992; 32(1), 167–183. DOI: 10.1146/annurev.pa.32.040192.001123.
- Sinnokrot, M. O., & Sherrill, C. D. High-Accuracy Quantum Mechanical Studies of ππ Interactions in Benzene Dimers. The Journal of Physical Chemistry A, 2006; 110(37), 1065610668. DOI: 10.1021/jp0610416.
- Crowley, P. B., & Golovin, A. (2005). Cation-π interactions in protein-protein interfaces. Proteins: Structure, Function, and Bioinformatics, 59(2), 231239. DOI: 10.1002/prot.20417.
- Программа для поиска гидрофобных ядер
- Эмсли Дж. Элементы. (The Elements, 1991). Перевод с английского Е.А. Краснушкиной. Справочно-энциклопедическое издание. Москва: Издательство Мир. Редакция литературы по химии, 1993.
- Запись о T4L в базе данных UniProt, в которой указаны остатки, формирующие активный центр T4L.
- Программа TMHMM для определения положения белка в мембране.
- Страница β2AR-T4L в базе данных трансмембранных белков OPM.
- Страница β2AR-T4L в базе данных трансмембранных белков PDBTM
- Страница β2AR в базе данных мембранных белков MemProtMD