1. Введение
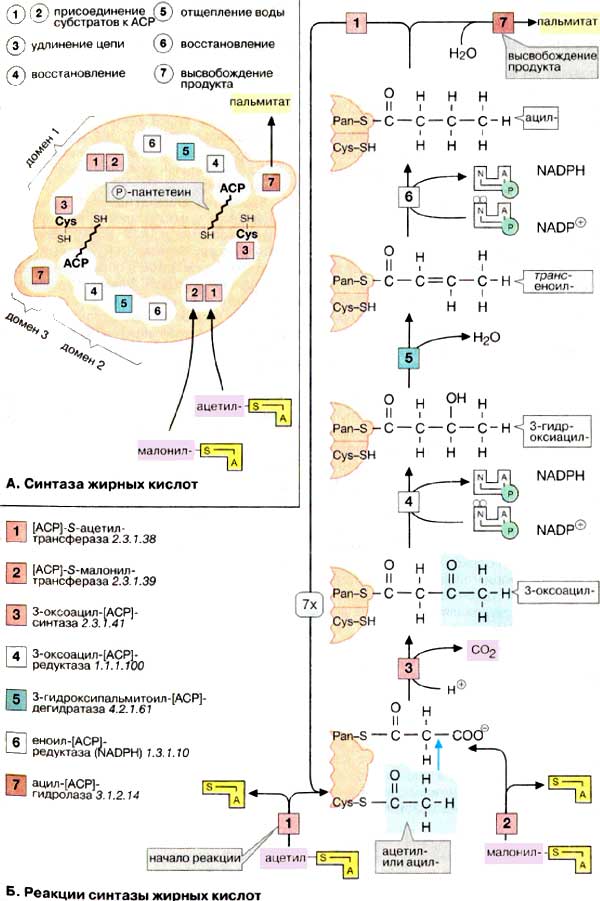
На данной странице представлена информация о белковом комплексе, образованном ацил-переносящим белком (АПБ) и фосфопантетеин-трансферазой [1]. Информация о структуре данного комплекса получена с помощью рентгеноструктурного анализа. Ацил-переносящий белок входит в состав синтазы жирных кислот, представляющей собой мультиферментный комплекс, в состав которого входят 6 доменов (не считая АПБ). На рисунке 1 представлены реакции синтеза жирных кислот.
2. Описание белков, входящих в состав комплекса 2CG5
| L-аминоадипат-семиальдегид дегидрогеназа-фосфопантенол трансфераза | Ацил-переносящий белок (как часть синтазы жирных кислот) | |
| Краткое название белка | AASD-PPT | ACP |
| Название гена | AASDHPPT | Fasn |
| PDB ID | 2BYD | 2PNG |
| UniProtKB AC | Q9NRN7 | P12785 |
| Тип фермента | Трансфераза | Трансфераза |
| Каталитическая активность | CoA-[4'-фосфопантенин] + апб-[ацил-переносящий белок] = аденозин 3',5'-бифосфат + активированный апб | Синтез жирных кислот (см. рис. 1) |
| Лиганды | Ион магния, CoA, Бром | Витамин B5 |
| Локализация в клетке | Цитозоль | Цитозоль |
Фосфопантенол-трансфераза - это фермент, способный переносить 4'-фосфопантениновый остаток кофермента А на консервативный остаток серина-2156 в домен АПБ человеческой цитозольной синтазы жирных кислот. Он способен осуществлять эту реакцию и с прокариотическими пептид- и ацил-переносящими белками. Кроме того, этот фермент вовлечен в катаболизм лизина [3].
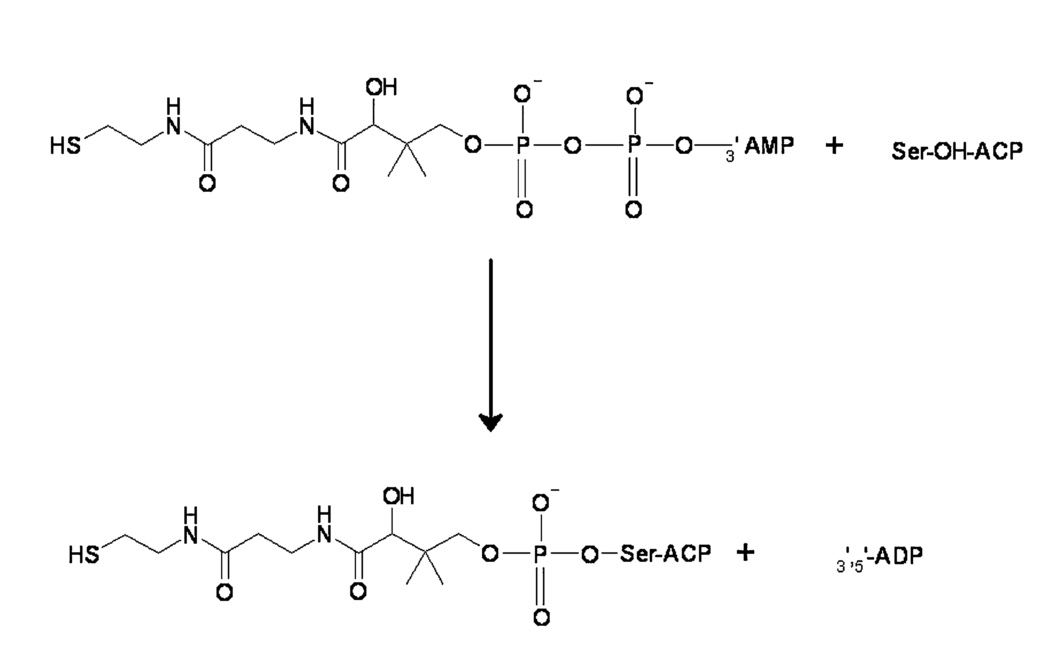
Ацил-переносящий белок является важным компонентом в биосинтезе жирных кислот и поликетидов (вторичные метаболиты [5]). Синтезируется в неактивной apo форме и активируется путем присоединения 4'-фосфопантенинового остатка через фосфодиэфирную связь. Фосфопантенин выполняет две ключевые функции: присоединение синтезируемого интермедиата к синтазе через энергетически-богатую связь и позволяет за счет гибкости своей цепи сблизить интермедиаты и активный центр фермента [6].
3. Белок-белковые взаимодействия
| Generalconfiguration | Текст скрипта |
| Cores | Текст скрипта |
| Polarinteractions | Текст скрипта |
| Hydrogenbond | Текст скрипта |
| Aromatic | Текст скрипта |
| Resume | |
| Сохранить PNG | |
| Для переключения изображений нажмите "Resume" | |
Гидрофобные взаимодействия. Так как в состав обоих белков входит большое количество альфа-спиралей, можно предположить, что гидрофобные контакты играют большую роль в обеспечении взаимодействия между ними.
С помощью сервера CluD [7] мы определили гидрофобные ядра белков. С помощью команды within (расстояние - 4 ангстрема как среднее растояние между ковалентно несвязанными атомами, установлено в предыдущем практикуме [8]) мы установили, что из 10 ядер только 4 принимают участие в белок-белковом контакте. При нажатии кнопки 'Cores' вы увидите общий вид этих ядер (красный-трансфераза, черный-АПБ, оставшимися цветами показаны различные ядра). При нажатии кнопки 'Resume', вы увидите общую схему гидрофобных взаимодействий (cписок аминокислот, участвующих в них АПБ:[ALA]2130 [ILE]2134 [ILE]2137 [LEU]2152 [ALA]2156 [LEU]2157 [VAL]2160 [GLU]2161 [THR]2165 [VAL]2176 Трансфераза: [PHE]61 [VAL]62 [PHE]63 [GLN]122 [PHE]154 [ILE]157 [TYR]184 [TRP]187 [LEU]201). Серым цветом показана трансфераза, зеленым - АПБ, розовым-аминокилоты, участвующих в гидрофобных взаимодействиях, входящие в состав трансферазы, голубым - в состав АПБ. Видно, что гидрофобные контакты собраны в две области, удерживающие АПБ с двух сторон. Одна между промежуточными участками (нажмите кнопку 'Resume'), другая между альфа-спиралями (нижмите кнопку 'Resume'). Скорее всего, гидрофобные взаимодействия помогают правильно позиционировать белки друг относительно друга и удерживать в нужном положении какое-то время, нужное для протекания реакции.
Солевые мостики. Как правило, солевые мостики сложно отличить от водородных связей, поэтому мы подразумеваем под ними связь между положительно и отрицательно заряженными остатками, длиной не более 5 ангстрем. Поиск велся с помощью команды within.
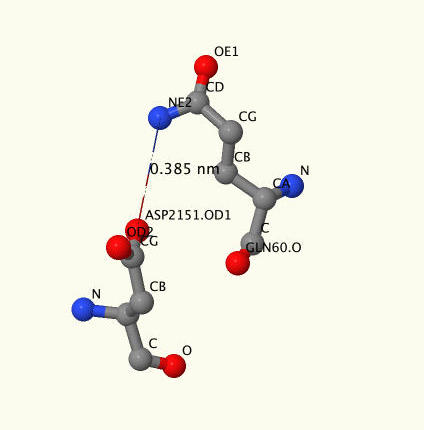
Нам удалось найти только три таких связи ([GLU]2161:B -[Arg]148:A, [Thr]2165:B -[Arg]148:A и [Asp]2151:B-[Gln]60:A). Нажмите кнопку 'Polar interactions', чтобы увидеть общую картину, где зеленым показан АПБ, серым-трансфераза, голубым-отрицательно заряженные остатки, розовым-положительно. Нажмите кнопку 'Resume', чтобы увидеть их поближе. На рисунке 4 показан скриншот связи ASP2151-GLN60 с подписанными тяжелыми атомами остатков.
Водородные связи. Нам удалось найти только 1 водородную связь между кислородом ASP2151 и азотом VAL62. Для визуализации нажмите кнопку 'Hydrogen bond'. Эта связь довольна необычна тем, что расположена не между двумя боковыми радикалами аминокислот, а между радикалом одной и остовом другой.
Стэкинг-взаимодействия. Стэкинг-взаимодействия - это притягивающиеся нековалентные взаимодействия между ароматическими кольцами [9]. С помощью команды within мы нашли ароматические (phe, trp, tyr, his) аминокислоты, находящиеся на границе контакта АПБ и трансферазы (их оказалось 6 штук:trp187, phe154, phe63, phe 61, his2133, tyr184). Для визуализации нажмите кнопку 'Aromatic'. Как видно на jmol-апплете, ароматические кислоты разных белков расположены далеко друг от друга (1,26 нм и 1,09 нм), стэкинга между ними нет.
Однако нам удалось найти информацию о стэкинге между ароматическими аминокислотами и атомами азота глутамина, аргинина и аспарагина [10]. Авторы этой статьи указывают на наличие стэкинг-взаимодействий, длиной не более 4,5 ангстрема. При нажатии кнопки 'Resume' вы увидите найденные нами стэкинг-взаимодействия между PHE63-ARG65 и ARG2138-HIS2133. Мы предполагаем, что эти взаимодействия позволяют стабилизировать 'поворот' альфа спиралей у двух белков, что помогает правильно позиционировтаь их друг относительно друга (нажмите кнопку 'Resume', чтобы увидеть полную картину).
4. Описание лигандов, входящих в состав белков комплекса 2CG5, 2BYD, 2JBZ.
В этой главе мы рассматриваем свзи между белком и лигандом в комплексе 2CG5 и в 2BYD и 2JBZ по-отдельности. Всего рассмотрено 6 лигандов, их основные параметры пердставлены в таблице 2.| 2BYD | Текст скрипта |
| 2JBZ | Текст скрипта |
| 2CG5 | Текст скрипта |
| Resume | |
| Сохранить PNG | |
| Для переключения изображений нажмите "Resume" | |
| Лиганд | CoA | Br- | Ni2+ | K1+ | Mg2+ | PO43- |
| PDBID | 2CG5 и 2JBZ | 2BYD | 2CG5 | 2JBZ | 2CG5 | 2CG5 |
| IUPAC | S-[2-[3-[[(2R)-4-[[[(2R,3S,4R,5R)-5-(6-aminopurin-9-yl)-4-hydroxy-3-phosphonooxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-hydroxyphosphoryl]oxy-2-hydroxy-3,3-dimethylbutanoyl]amino]propanoylamino]ethyl] ethanethioate | Bromide | Nickel(2+) | Potassium(1+) | Magnesium(2+) | Phosphate |
| Химическая формула | 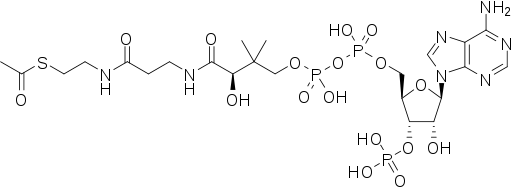 | 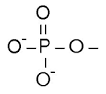 | ||||
| Брутто-формула | C23H38N7O17P3S | Br | Ni | K | Mg | PO4 |
| Молярная масса | 809,57 | 79.90 | 58.69 | 39.10 | 24.30 | 94,97 |
| Ссылка на PubChem | 444493 | 259 | 934 | 813 | 888 | 1061 |
При поиске способов связывания катионов в JMol, искались остатки глутаминовой и аспарагиновой кислот, которые распалагались на расстоянии не более 7 А от катионов никеля и магния. В каждом случае находились две ближайшие кислые аминокислоты, которые, по-видимому, и связывают катионы. Для фосфат-иона был проведен обратный процесс, потому что теперь мы искали ближайшие атомы азота таких аминокислот, как гистидин, аргенин, лизин. Всего обнаружено девять лигандов брома, их связь с белком показана на примере [BR]1319:A.BR #2317 и атомов [ARG]74:A.NH2 #475, [ARG]74:A.NE #472, [GLN]51:A.N #281, [ARG]78:A.NH1 #509. Видимо, связывание брома обусловлено ионным взаимодействием. Ион калия ионно свзяан c [HIS]0:A.O #4 и [SER]2:A.OG #24. Ацетил-КоА, по-видимому, свзяан ионно с [ARG]52:A через фосфат адениловой к-ты и с [GLY]82:A.O #619 через аденин.
5.Выводы
В результате проделанной работы мы можем заключить, что фосфопантенил-трансфераза и ацил-переносящий белок связаны и удерживаются вместе преимущественно за счет гидрофобных взаимодействий, а ионные и водородные связи играют очень незначительную роль в этом процессе. В свободном состоянии фосфопантенил-трансфераза содержит анионы брома в качестве лигандов, связь осуществляется на основе ионных взаимодействий. Катионы металлов, входящие в состав комплексов также связаны с белками с помощью ионных взаимодействий.6. Личный вклад
Азбукина Надежда выявляла и описывала межбелковые контакты,осуществляла перевод на английский язык, Поддъяков Иван и Эрмидис Алксандр характеризовали лиганды, АН и ПИ занимались оформлением работы на HTML-странице.7. Список литературы
[1] http://www.rcsb.org/pdb/explore/explore.do?structureId=2CG5
[2] Наглядная биохимия. Кольман Я., Рём К.-Г. М.: 2000. - 469 с
[3] Joshi A.K. et al. Cloning, Expression, and Characterization of a Human 4’-Phosphopantetheinyl Transferase with Broad Substrate Specificity // J. Biol. Chem. 2003. Vol. 278, № 35. P. 33142–33149.
[4] Bunkoczi G. et al. Mechanism and Substrate Recognition of Human Holo ACP Synthase // Chem. Biol. 2007. Vol. 14, № 11. P. 1243–1253.
[5] https://ru.wikipedia.org/wiki/Поликетиды
[6] https://meshb.nlm.nih.gov/#/record/ui?name=Acyl%20Carrier%20Protein
[7] http://mouse.belozersky.msu.ru/npidb/cgi-bin/hftri.pl
[8] http://kodomo.fbb.msu.ru/~azbukinanadezda/term2/pr2/pr2.html
[9] https://en.wikipedia.org/wiki/Stacking_(chemistry)
[10] Flocco M.M., Mowbray S.L. Planar stacking interactions of arginine and aromatic side-chains in proteins. // Journal of molecular biology. 1994. Vol. 235. P. 709–717.