1.Краткое описание структуры в файле 1DDN_old.pdb
В файле приведены координаты атомов следующих молекул:- Белок, репрессор гена токсина дифтерии, представленного цепями А, В, С, и D;
- ДНК, представленную цепями:
- Е(5'-D(*AP*TP*AP*TP*AP*AP*TP*TP*AP*GP*GP*AP*TP*AP*GP*CP*TP*TP*TP*AP*CP*CP*TP*AP*TP*AP*TP*TP*TP*TP*A)-3')
- F(5'-D(*TP*TP*AP*AP*AP*AP*TP*AP*AP*TP*TP*AP*GP*GP*TP*AP*AP*AP*GP*CP*TP*AP*TP*CP*CP*TP*AP*AP*TP*TP*AP*TP*A)-3').
Белок и ДНК из бактерии Corynebacterium Diphtheriae .
Для исследования были выбраны
D цепь белка и цепи E, F, представляющие ДНК со следующей последовательностью:
цепь E [2] 5'- TATAATTAGGATAGCTTTACCTAATTATTTTA - 3' [33]
||||||||||||||||||||||||||||||||
цепь F [33] 3' - ATATTAATCCTATCGAAATGGATTAATAAAAT - 5' [2],
2.Функции белка, структура которого представлена в файле 1DDN_old.pdb
По данным документа UniProt, белок, представленный в структре, является репрессором генa дифтерийного токсина и может служить глобальным регулятором экспрессии генов. Белок кодируется геном dtxR и соединяется с ДНК как гомодимер.3.Исследование структуры ДНК
С помощью программ find_pair и analyze было определено,что данная ДНК представлена в В-форме.
Classification of each dinucleotide step in a right-handed nucleic acid
structure: A-like; B-like; TA-like; intermediate of A and B, or other cases
step Xp Yp Zp XpH YpH ZpH Form
1 AT/AT -3.45 8.72 0.64 -5.74 8.68 1.09
2 TA/TA -3.40 8.86 0.59 -6.68 8.41 2.85
3 AG/CT -3.09 8.74 0.35 -5.54 8.49 2.14 B
4 GT/AC -3.34 9.30 0.31 -7.43 9.07 2.11 B
5 TA/TA -2.14 8.80 0.57 -0.84 8.74 -1.16
6 AG/CT -3.18 8.89 -0.14 -4.91 8.43 2.76 B
7 GA/TC -3.07 8.97 0.05 -4.23 8.88 1.30 B
8 AG/CT -2.96 8.94 -0.21 -2.85 8.91 0.74 B
9 GT/AC -3.65 9.08 -1.25 -4.97 9.16 -0.40 B
10 TG/CA -2.96 8.92 -0.10 -1.65 8.89 -0.74 B
11 GC/GC -2.93 8.90 0.03 -1.28 8.75 -1.60 B
12 CT/AG -3.29 9.19 -0.86 -5.06 9.22 0.54 B
13 TT/AA -2.31 9.08 -0.07 -1.59 9.07 -0.55 B
14 TC/GA -2.76 9.12 0.09 -4.66 8.71 2.70 B
15 CT/AG -3.12 8.93 -0.11 -2.96 8.92 0.25 B
16 TA/TA -2.77 8.65 0.42 -2.08 8.65 -0.34 B
17 AT/AT -3.81 9.06 0.24 -8.03 8.66 2.67 B
18 TC/GA -3.16 8.86 0.51 -5.27 8.57 2.29
19 CA/TG -3.33 8.74 0.85 -7.57 8.30 2.85
20 AT/AT -3.66 8.59 0.34 -5.15 8.59 0.48
Были определены средние значения торсионных углов для внутренних нуклеотидов.
Наиболее отклоняющиеся от средних значения торсионных углов имеют Тимин26 из цепи Е и Аденин23 из цепи F.
Различные взаимодействия с белками могут значительно менять структуру ДНК, но не настолько, чтобы она могла потерять
В-форму.4.Исследование природы ДНК-белковых контактов
1) скрипт my_dna.def , в котором определены множества атомов, необходимые для заполнения следующей таблицы.2)
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 7 | 31 | 38 |
| остатками фосфорной кислоты | 46 | 26 | 72 |
| остатками азотистых оснований со стороны большой бороздки | 9 | 55 | 64 |
| остатками азотистых оснований со стороны малой бороздки | 12 | 55 | 67 |
3) Наблюдения:
Заметно, что число неполярных взаимодействий сильно превышает число полярных. Возможно это из-за того, что число неполярных больше как в белке, так и в ДНК.
5.Получение популярной схемы ДНК-белковых контактов с помощью nucplot
Команда nucplot 1DDN_old.pdb . В результате были получены картинки: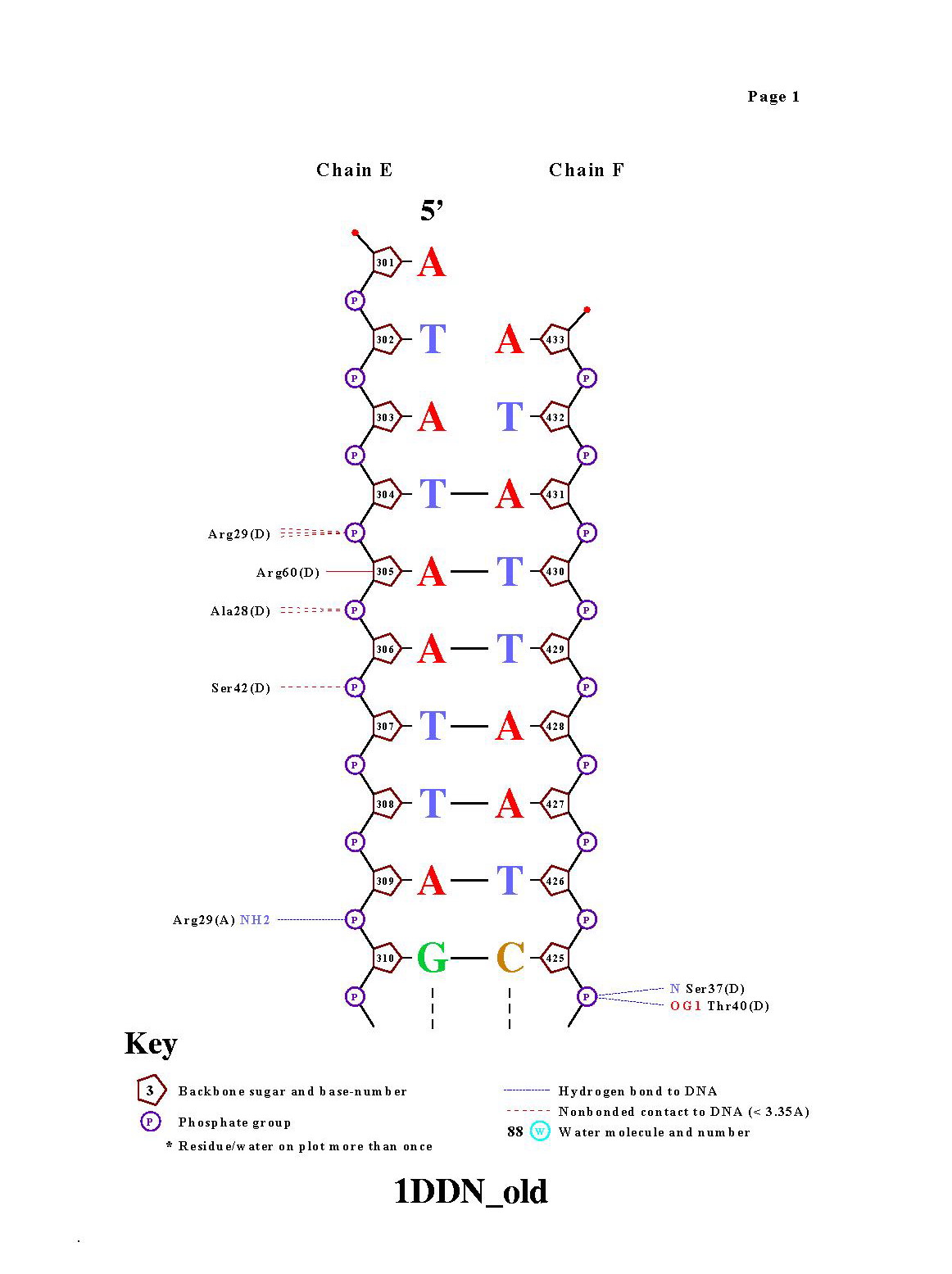 |
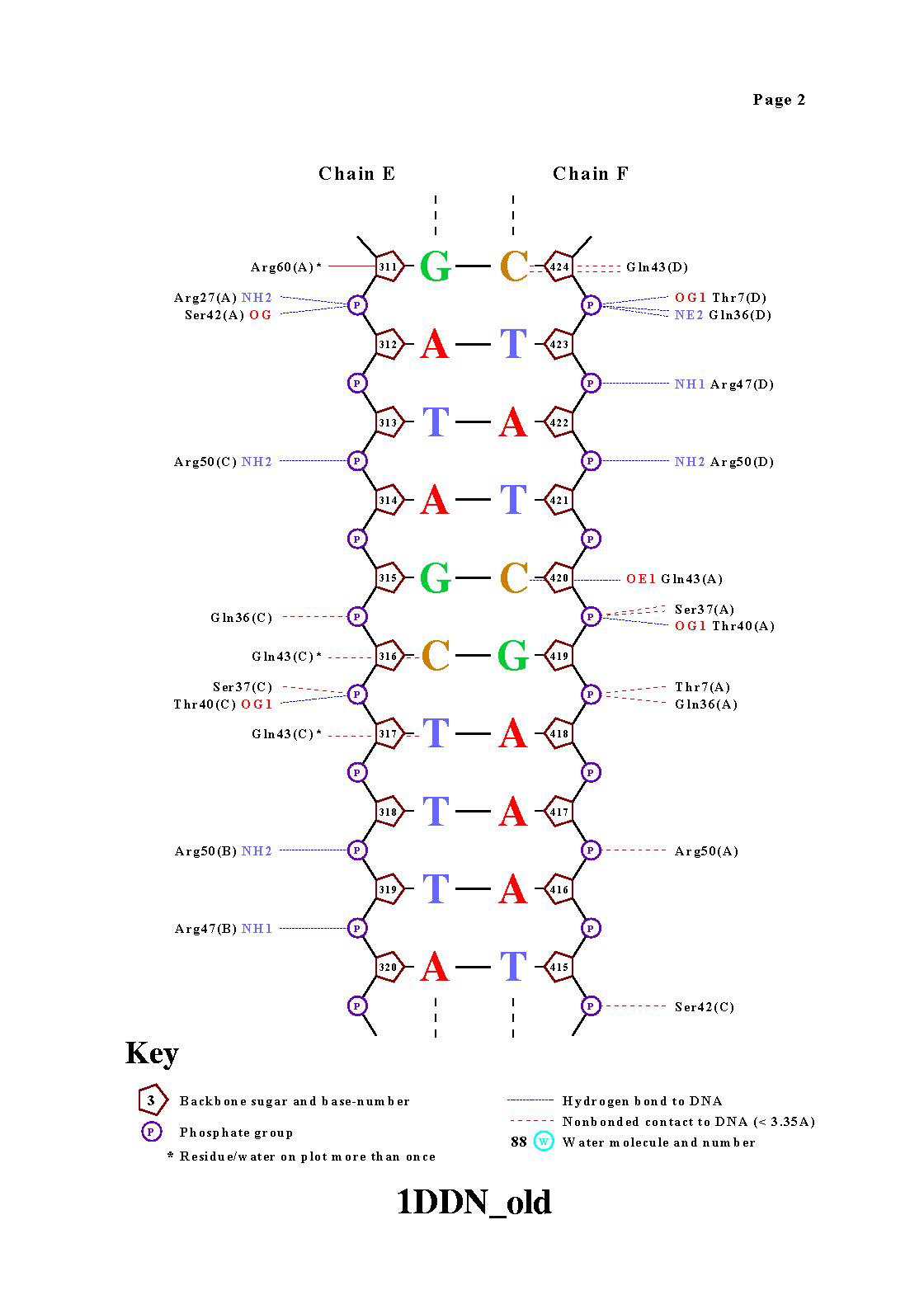 |
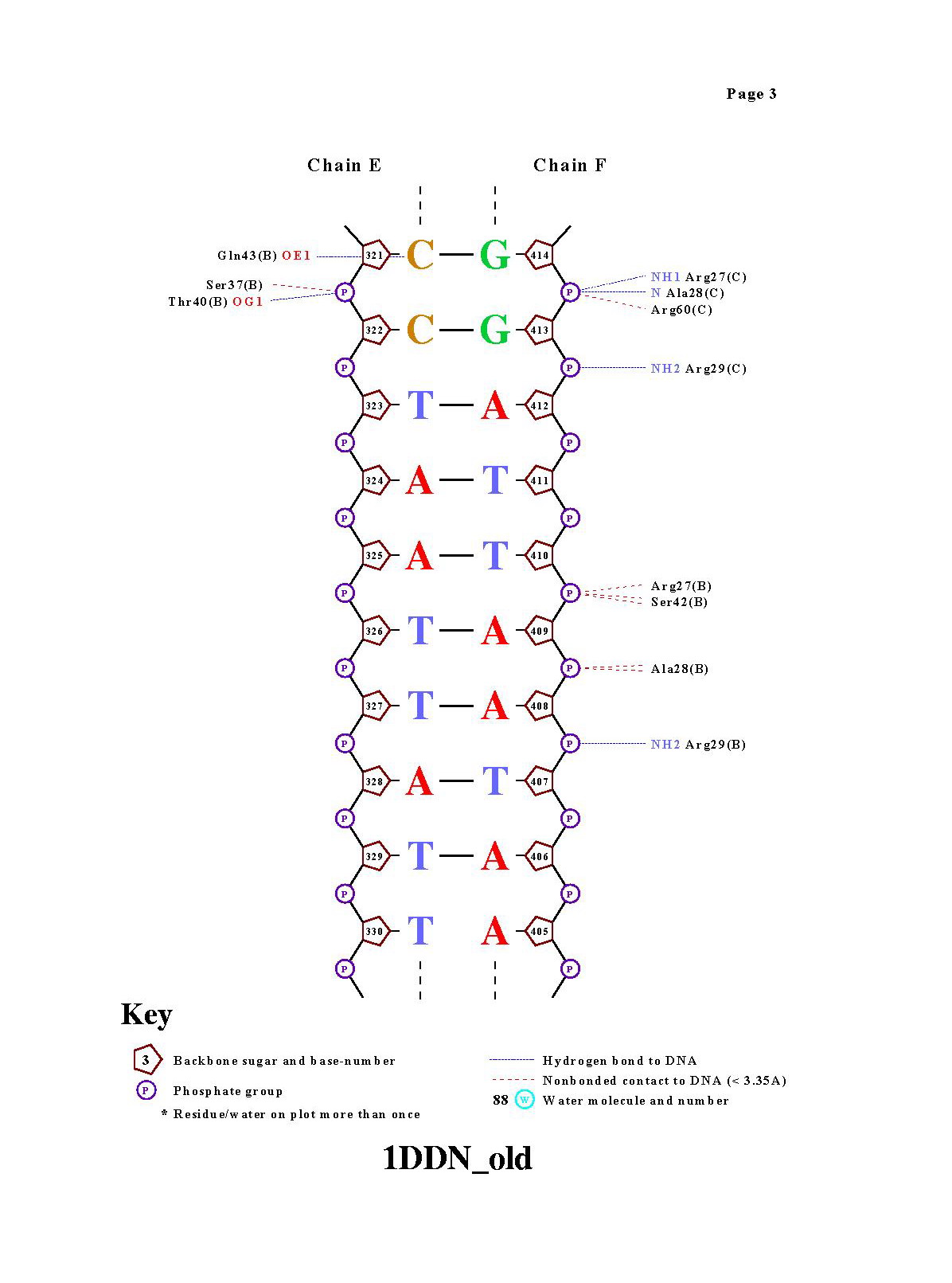 |
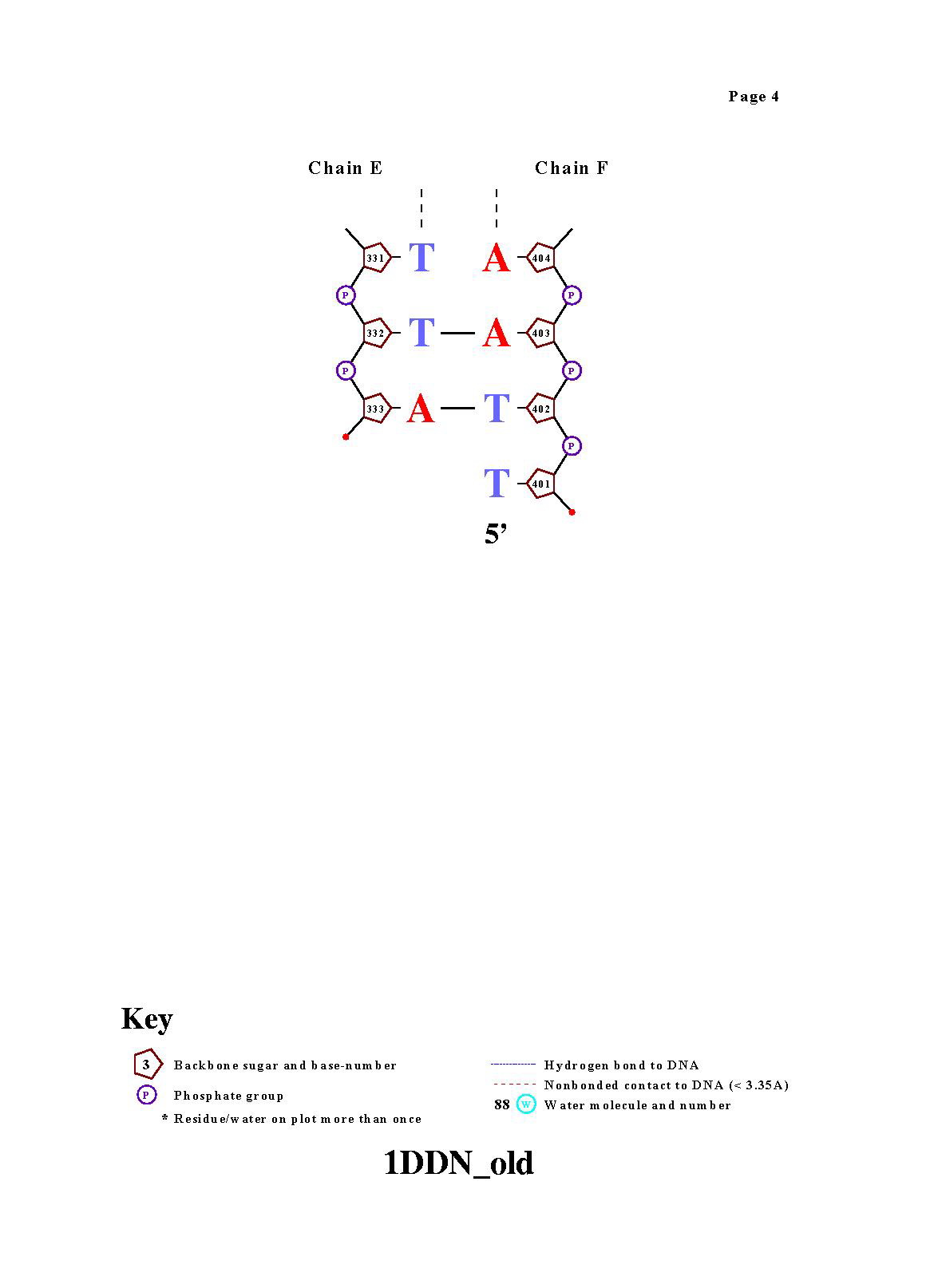 |
|
Контактов белка с остовом молекулы ДНК намного больше, чем с
азотистыми основаниями. За счет взаимодействия белка с азотистыми основаниями обеспечивается избирательность белка.Интересно,
что совсем не представлены контакты между водой и азотистыми основаниями.
Arg29 - аминокислотный остаток с наибольшим числом указанных на схеме контактов с ДНК(6). На мой взгляд, наиболее важный аминокислотный остаток для распознавания последовательности ДНК это Gln43, он образует контакты с ДНК, причем все с азотистыми основаниями. |
6.Возможный(е) распознающий(е) контакт(ы)
На рисунке представлен Gln43:C, образующий контакты с цитозином 316 и тимином 317.
7. Характеристика ДНК-связывающего домена DTXR_CORDI
С помощью инструментов Pfam была определена доменная структура белка из исследуемого комплекса.
Железозависимые репрессоры на своем N-конце содержат спираль-поворот-спираль (wHTH). В С-концевой части происходит димеризация с двумя металлосвязывающимися участками.
FeoA говорит о том, что эта область может быть металлосвязывающей.