| Главная страница | Обучение | Обо мне | Ссылки |
Восстановление кристалла из PDB-файла | |||
|
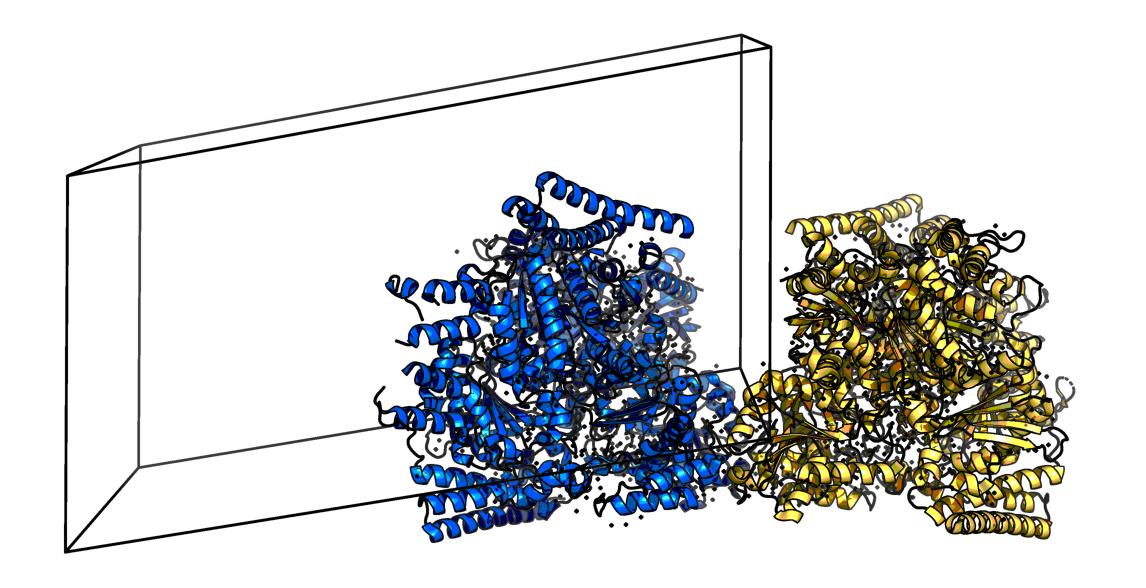
В данном практикуме рассматривается структура домена SucA белка KGD из организма Mycobacterium smegmatis, доступная по PDB-коду 2YIC, частично охарактеризованная в предыдущем практикуме. Параметры кристаллической ячейки указаны в файле PDB в строке CRYST1 79.539 83.244 158.610 99.48 99.06 101.25 P 1 4. Их них мы получаем параметры кристаллографической ячейки: a: 79.539 Å b: 83.244 Å c: 158.61 Å - длины направляющих векторов; α: 99.48° β: 99.06° γ: 101.25° - углы между направляющими векторами. По ним можно видеть, что ячейка не является прямоугольным параллелепипедом. Далее обозначен тип симметрии (кристаллографическая группа) - Р 1, и наконец, количество белковых единиц в элементарной ячейке - в нашем случае это 4 цепи. Кристаллографическая ячейка отражена на Рис. 1. Рассматриваемый белок является гомодимером (биологическая единица), и в элементарной ячейке присутствуют 2 таких биологически активных димера. Далее для изучения межбелковых контактов был рассмотрен только один димер из двух - цепи A+B.
Контакты с соседними ячейками Для ячейки файла 2YIC были достроены соседние молекулы кристалла (Рис. 2).
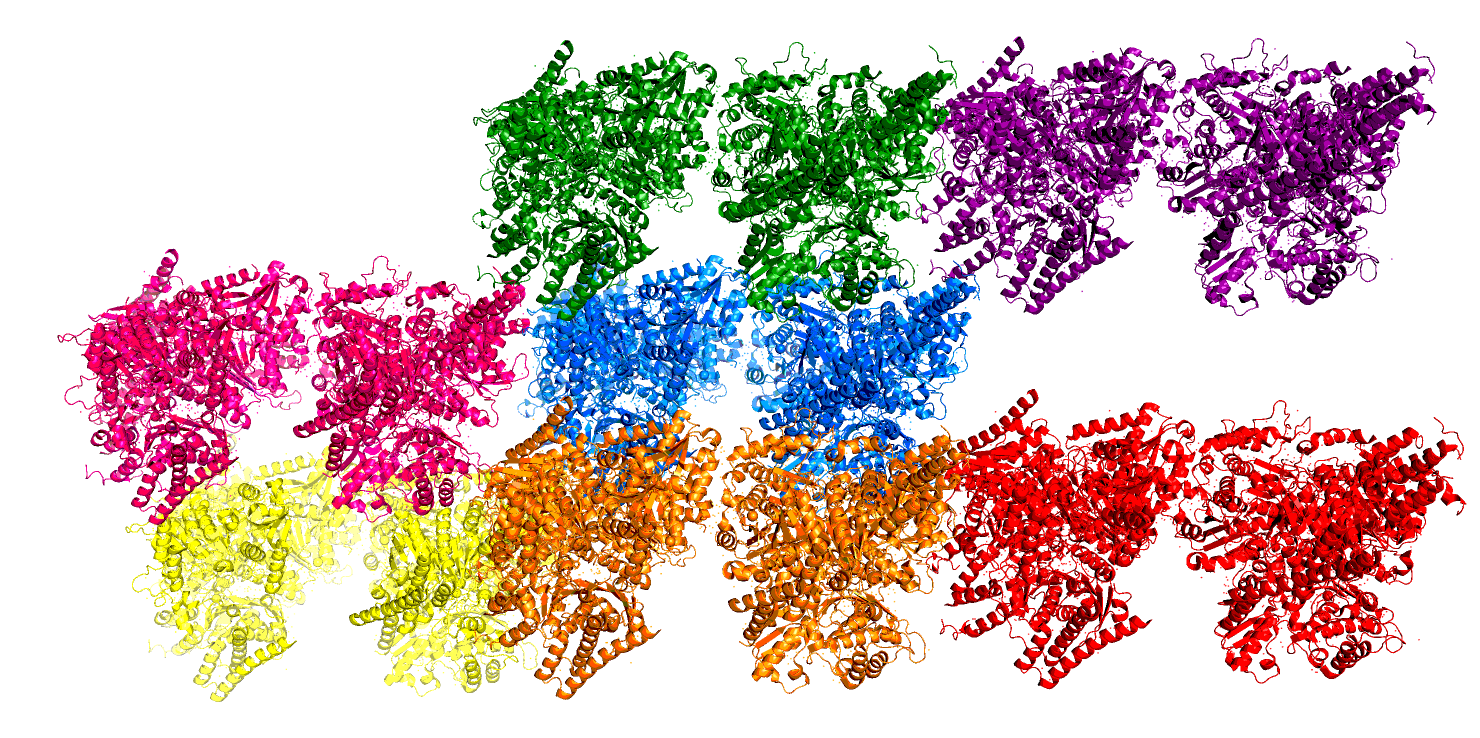
Из Рис. 2 очевидно, что взаимодействия между двумя димерами внутри ассиметрической единицы отличаются от взаимодействий с глобулами-соседями. Они будут рассмотрены далее. Из соображений симметричности были удалены некоторые соседние комплексы, и далее рассматривались взаимодействия для белковых молекул, изображенных на Рис. 3.
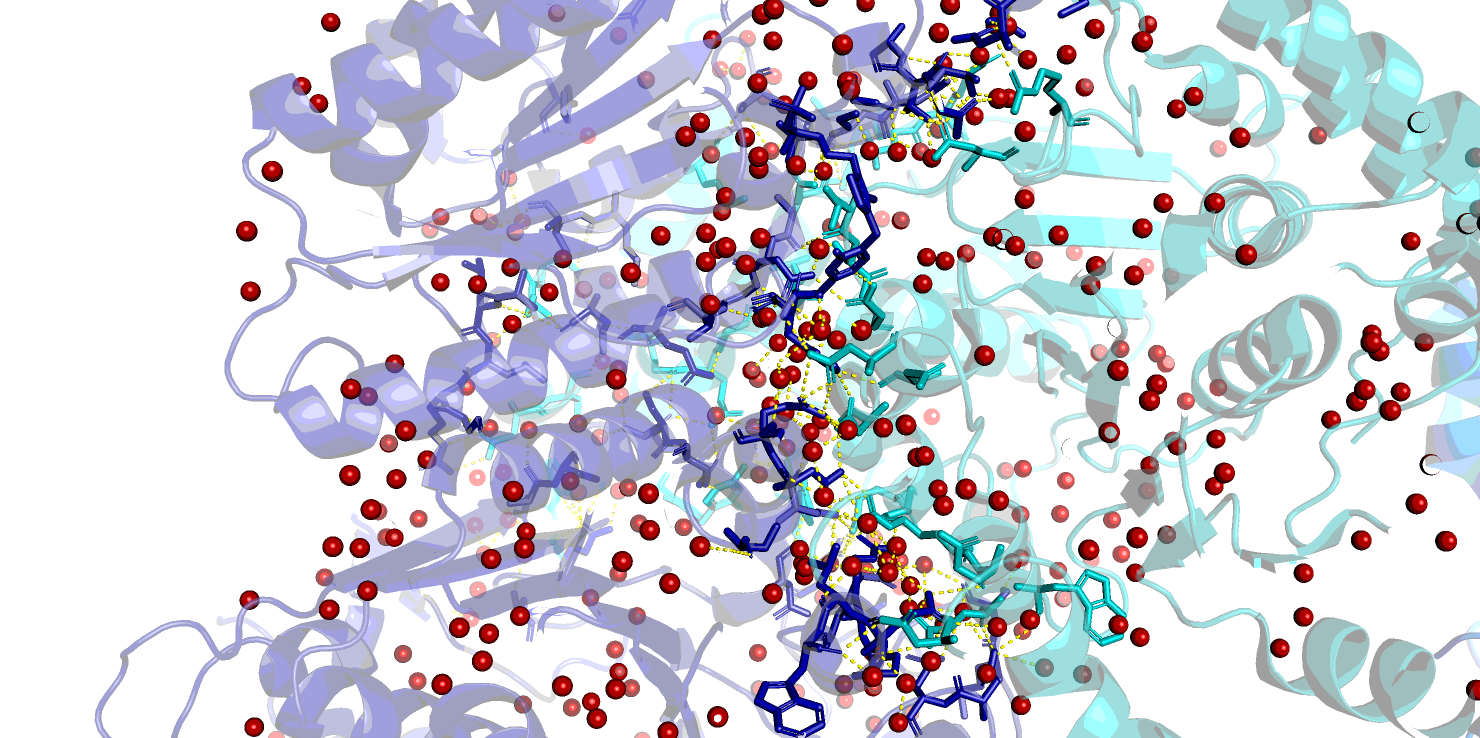
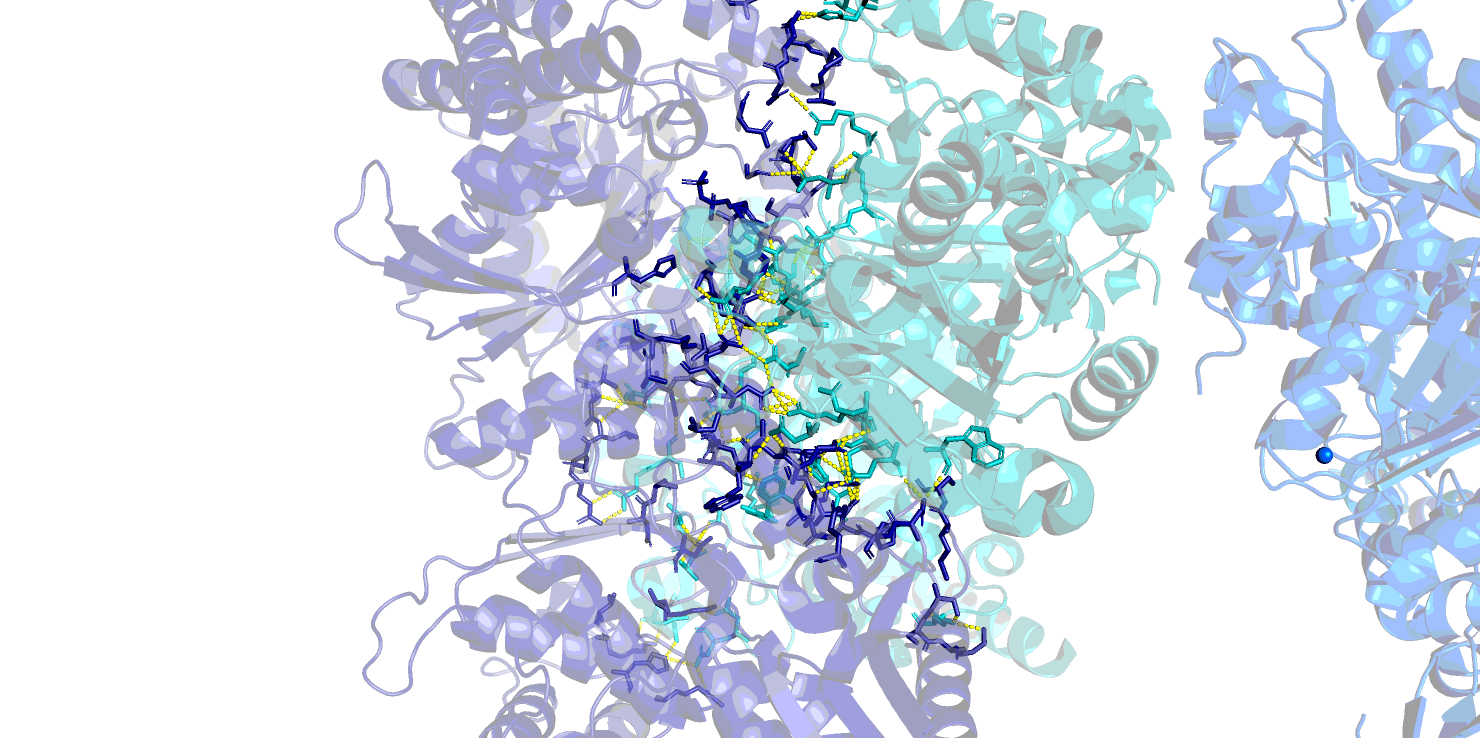
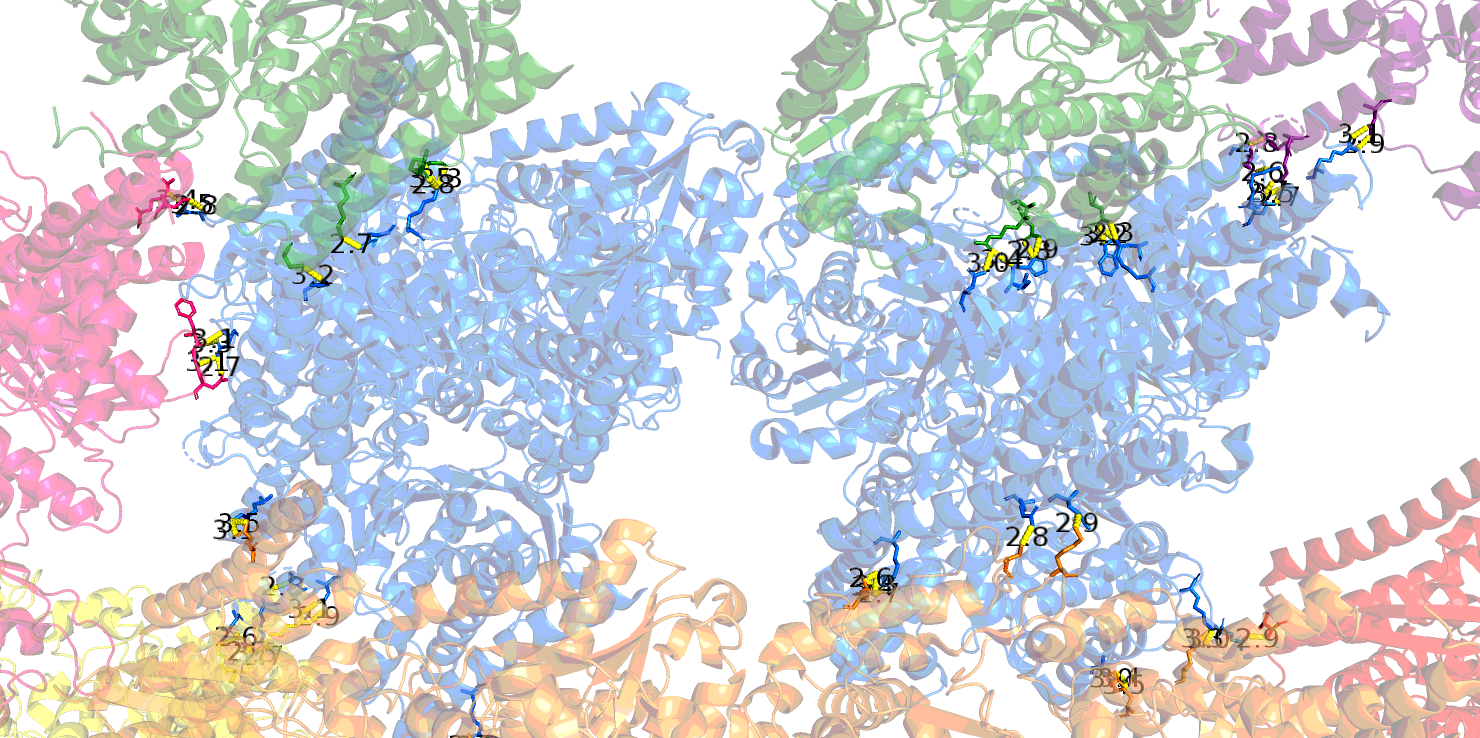
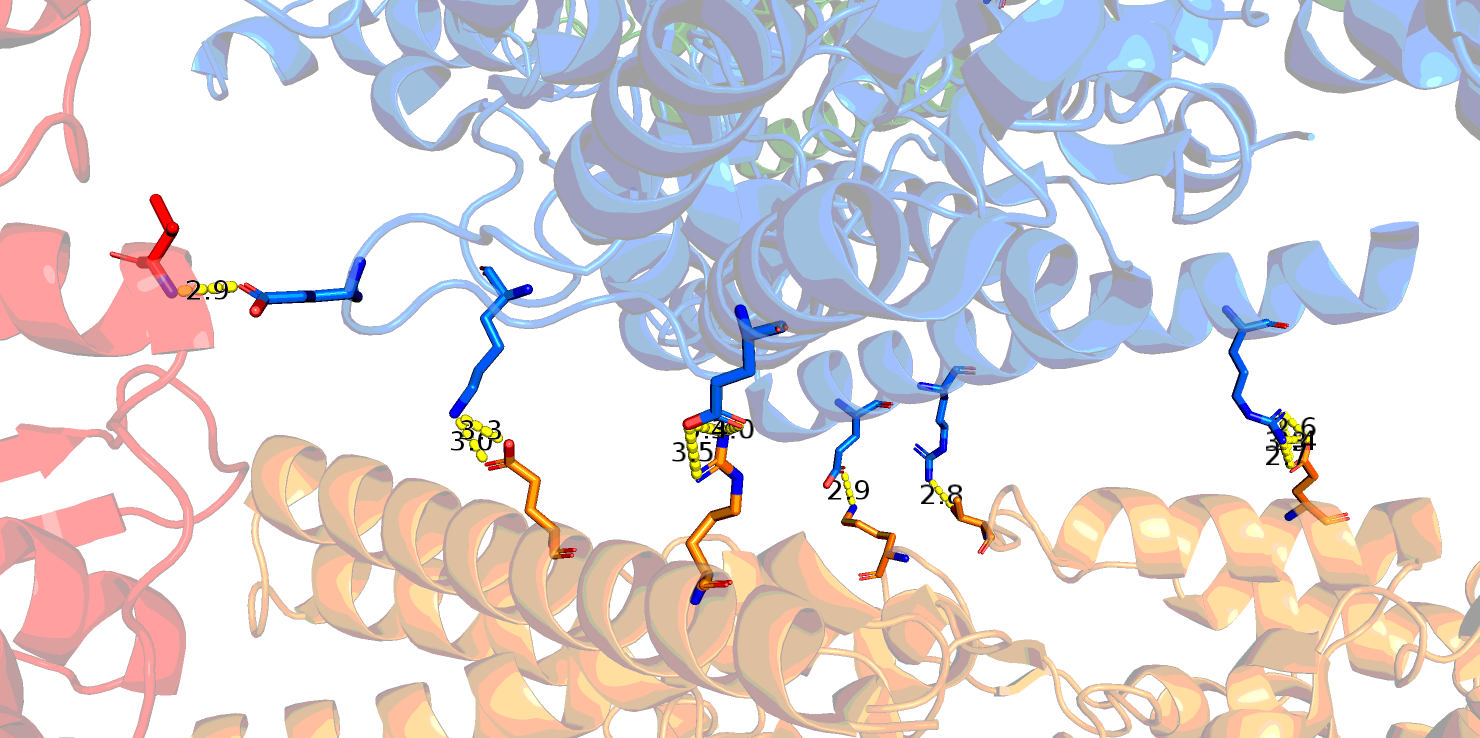
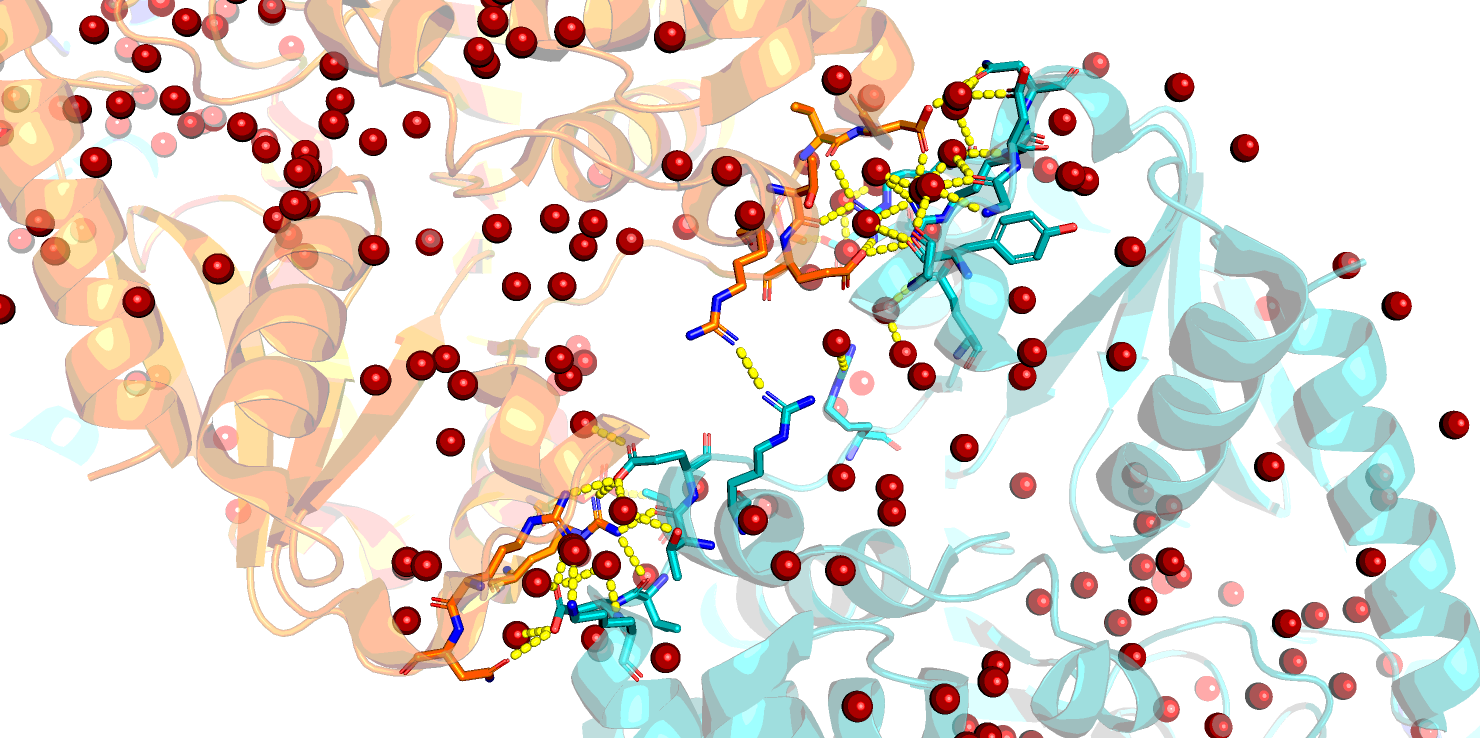
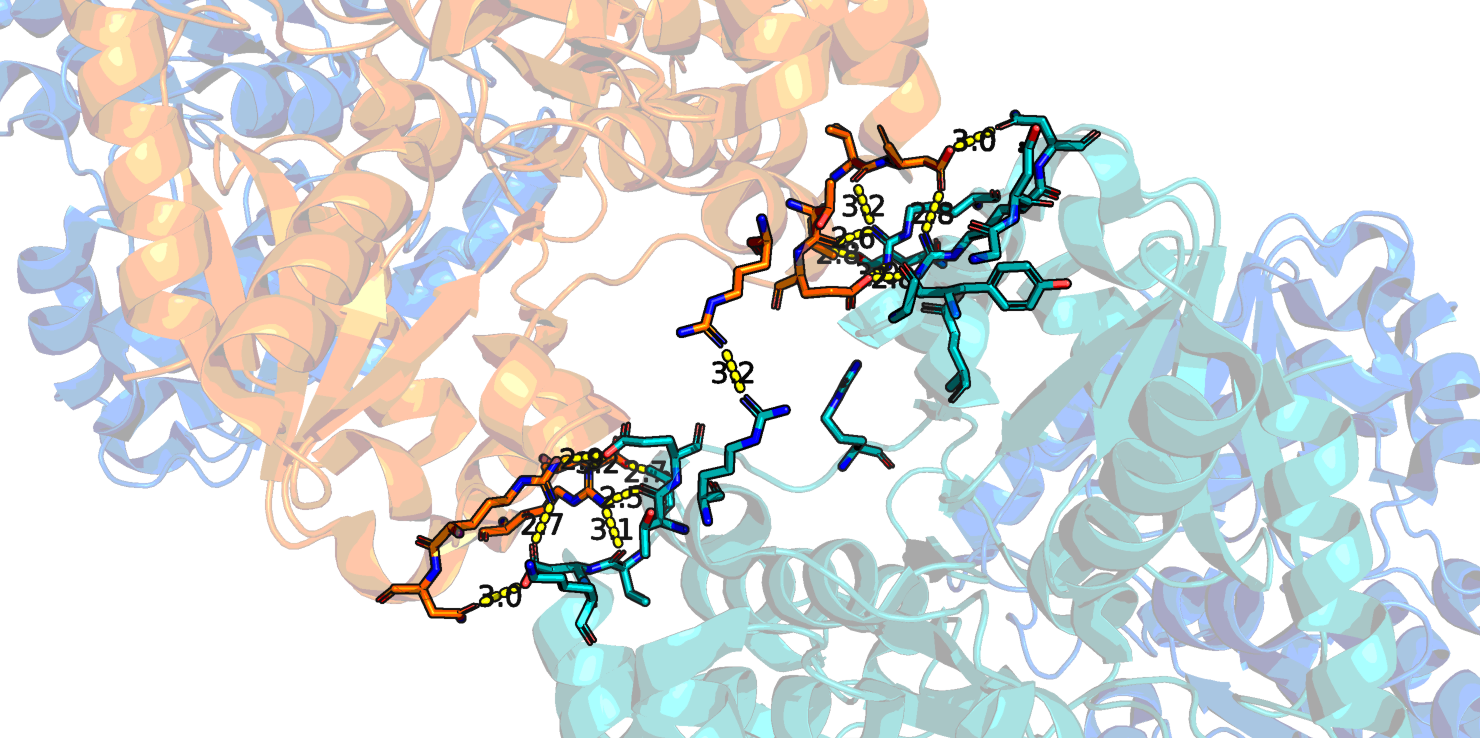
Контакты при образовании биологически активного гомодимера изображены на Рис. 4. Это контакты для множества атомов, относящихся к цепям A и В (аналогично - для C и D) исходной молекулы. Субъединицы могут контактировать как напрямую за счет водородных связей между аминокислотными остатками, так и через мостики воды, и это может существенно отразиться на количестве контактов. На Рис. 4 приведены изображения контактов с учетом связанной воды и без нее.
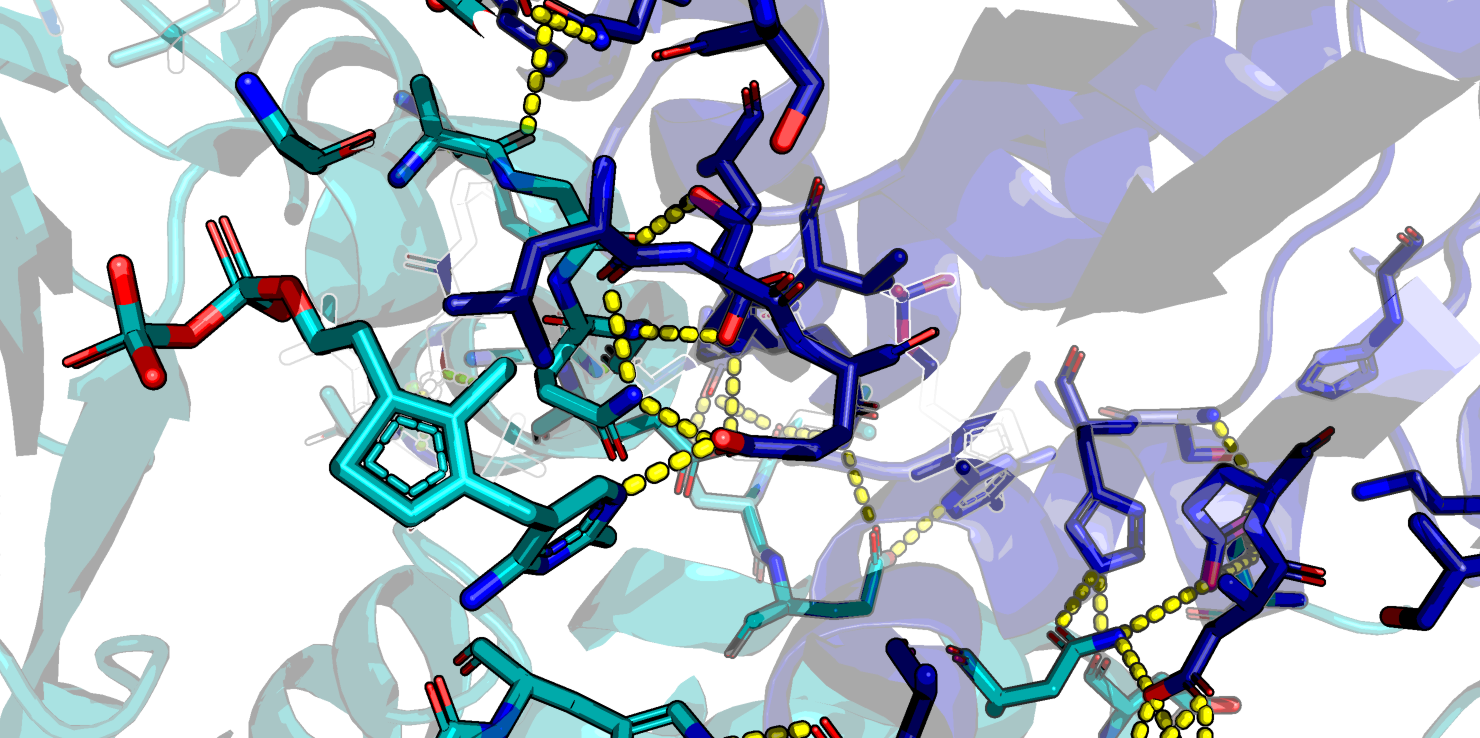
Видно, что без воды контактов существенно меньше, однако они гораздо ближе (как правило, расстояние меньше 3.0 Å и образованы истинными водородными связями между атомами азота и кислорода (Рис. 5).
Контакты между соседними белковыми глобулами для данной структуры встречаются нескольких типов: внутри одной ячейки и между глобулами соседних ячеек. Оба типа контактов приведены на Рис. 6.
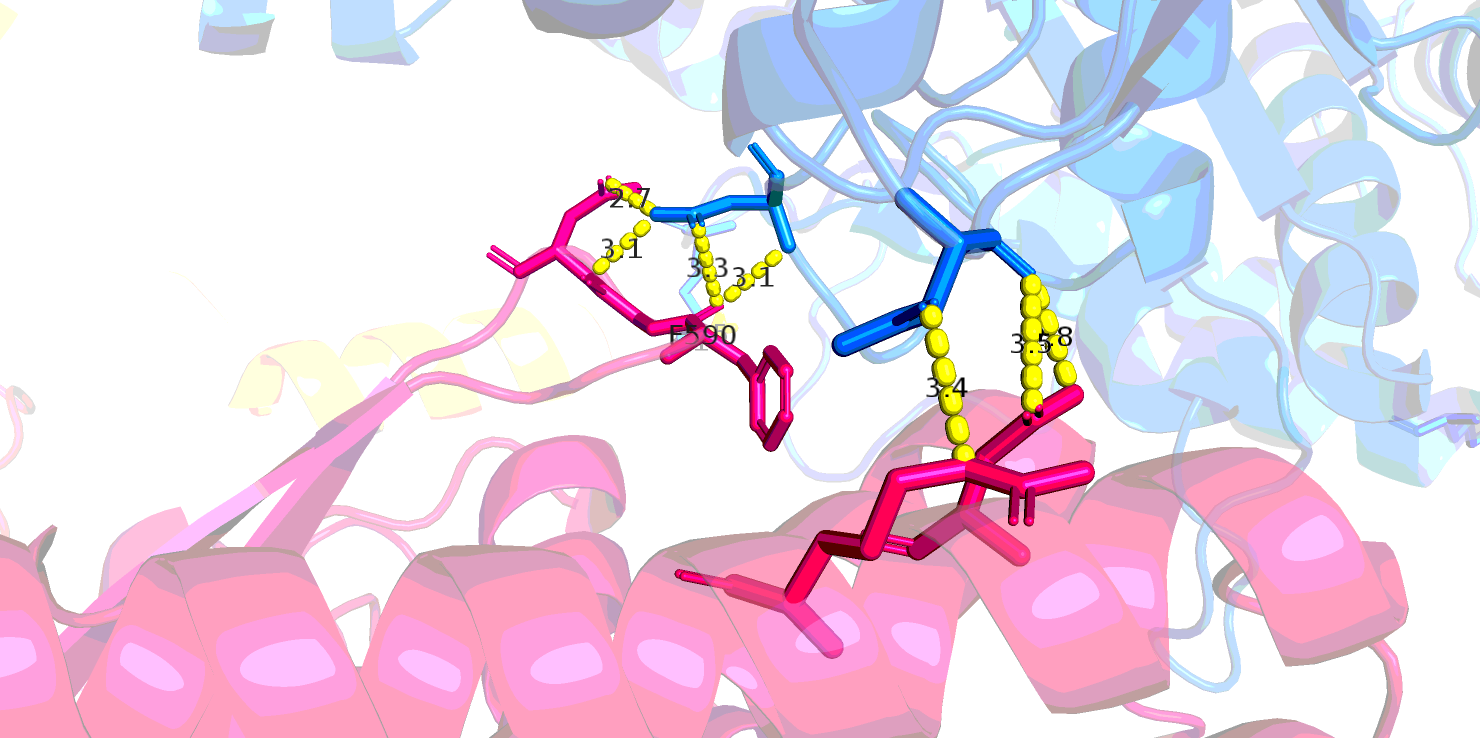
Контактов между соседними молекулами (искусственными гетеротетрамерами) довольно мало и они возникают в основном между остатками, экспонированными в растворитель (логичным образом), причем довольно несистемно - то есть во взаимодействиях участвуют каждый раз разные остатки. Скорее всего, такие контакты являются артефактом кристаллизации и не несут в себе биологического смысла или вообще связаны с плохим определением положения остатков на поверхности белковой глобулы.Взаимодействия внутри одной ячейки возникают между цепями А и С. Они показаны на Рис. 7.
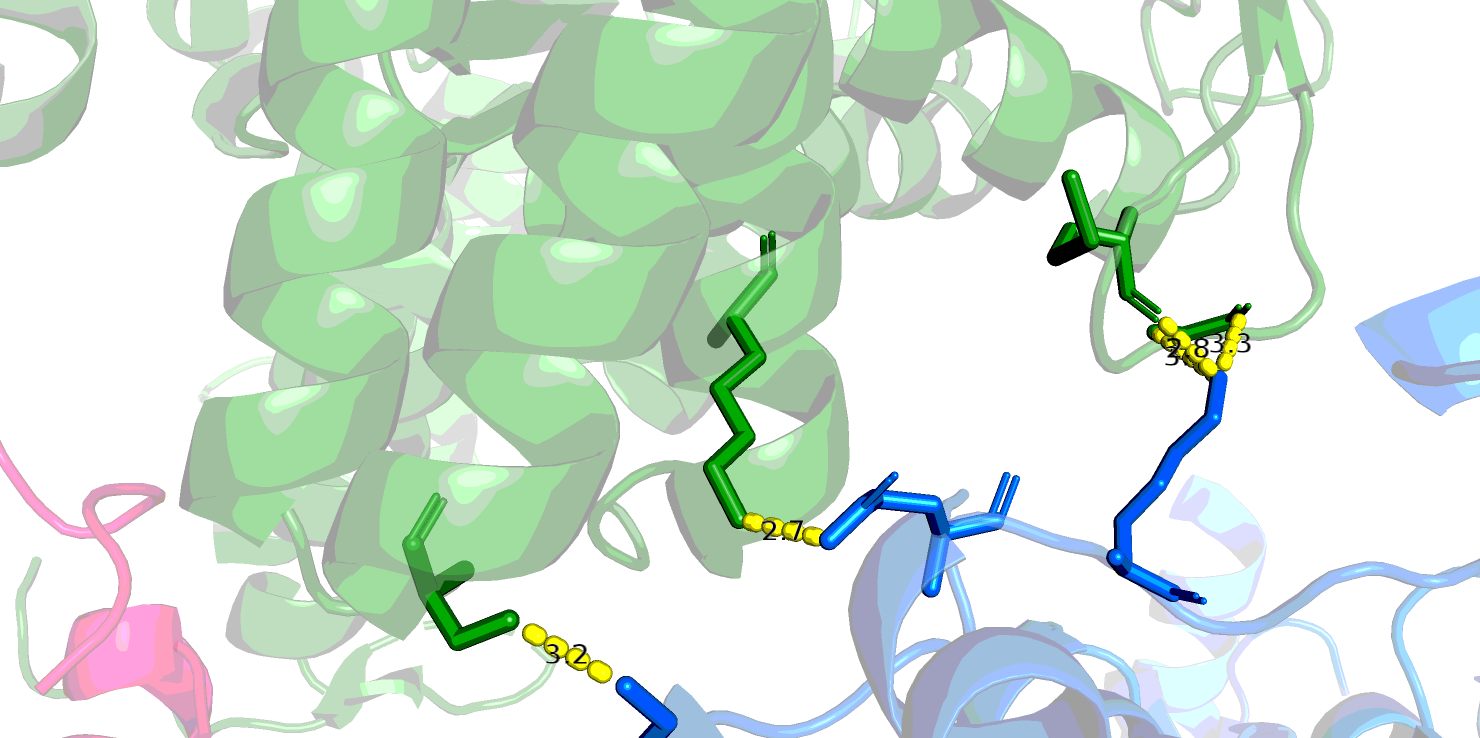
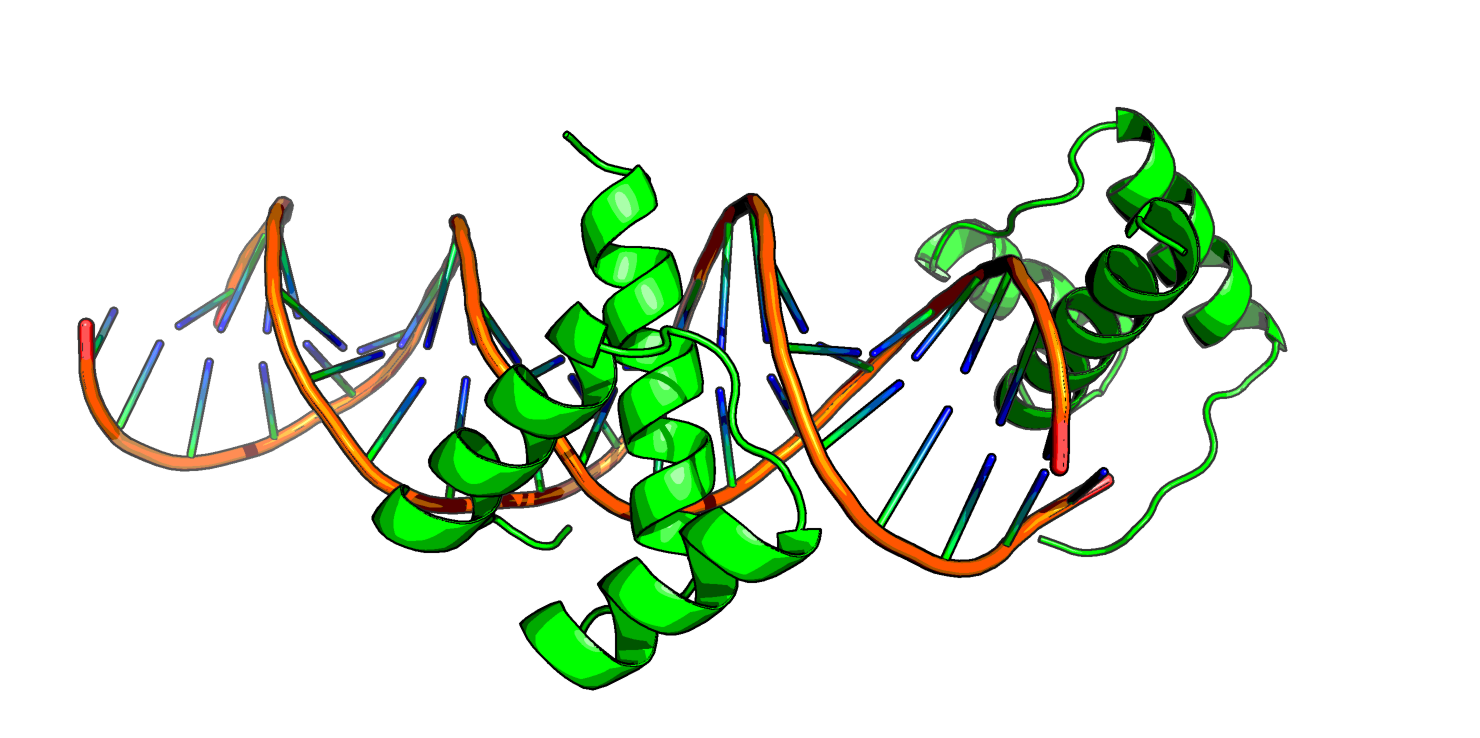
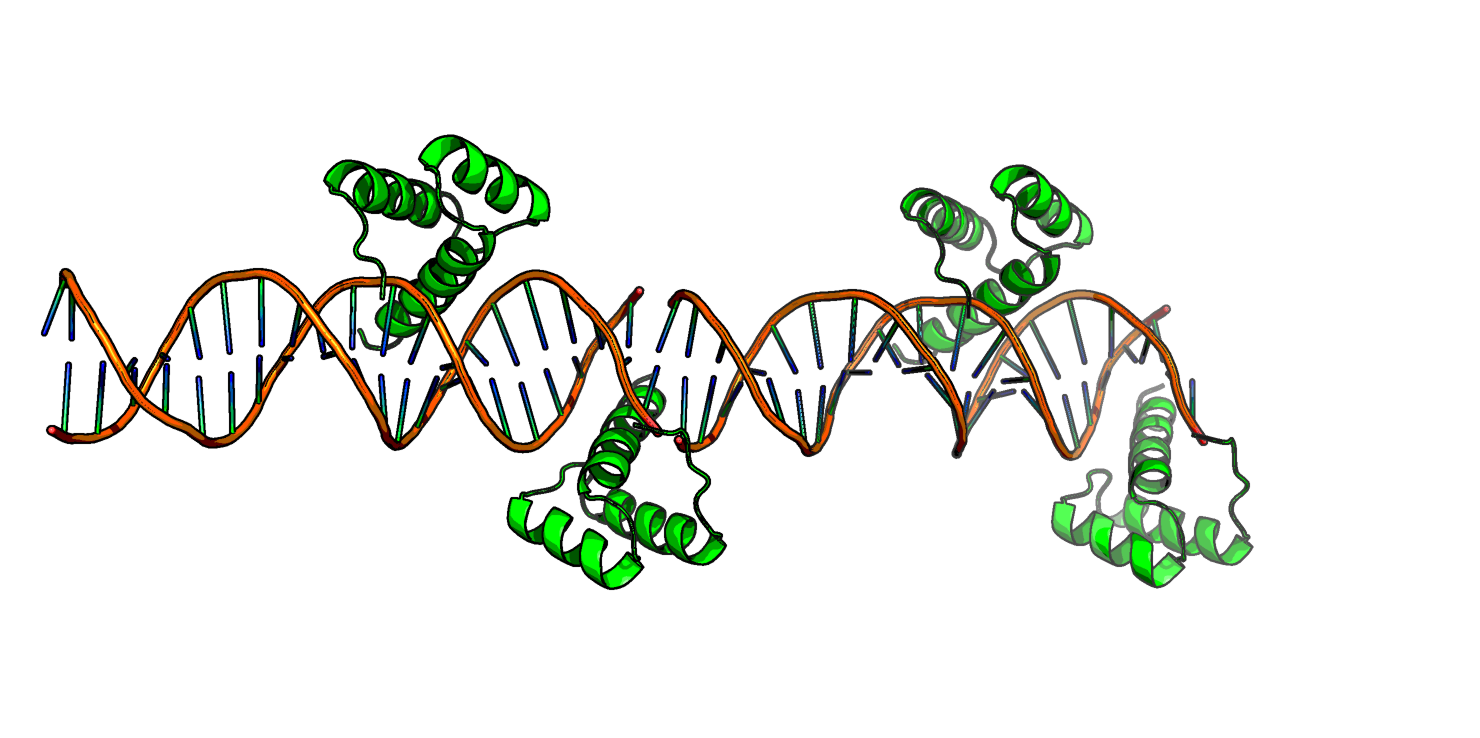
Аналогично первому случаю, здесь большое количество контактов образовано через водные мостики. Видно, что при удалении воды остается не очень много водородных связей, однако все они, по-видимому, отражают биологическую способность данного белка к олигомеризации более высокого уровня, чем димеризация. Странности белковых цепей в ДНК-белковом комплексеДля рассмотрения была взята структура 3HDD комплекса гомеодомена с ДНК. В ней фрагмент белковой цепи как будто висит в воздухе (Рис.8).
Eсли достроить ДНК-белковый комплекс в соседних ячейках (Рис. 8, снизу), становится очевидно, что эта "подвисшая" часть белка связывается с ДНК, которая почему-то не попала в ячейку.
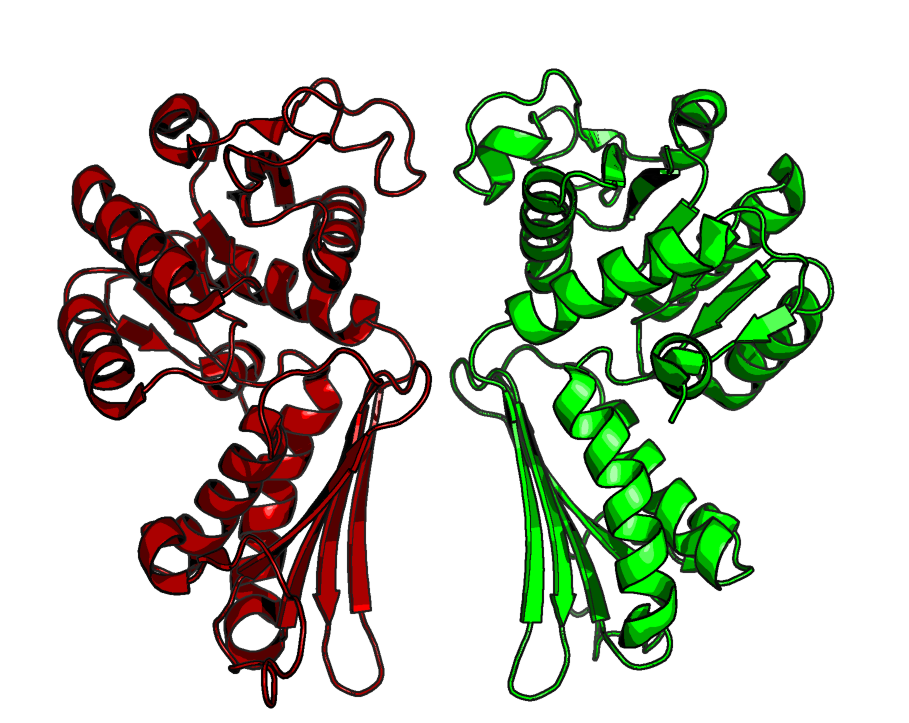
Примеры несовпадения ассиметрической и биологической единицВ качестве примера файла с несовпадающими ассиметрической и биологической единицами можно рассмотреть 5TEM - структуру 4-гидрокси-тетрагидродипиколинат редуктазы из организма Vibrio vulnificus. Данный белок в природе образует гомотетрамер, однако в ассиметрическую единицу попали только 2 белковые цепи А и С (Рис. 9). Полная структура тетрамера представлена на Рис. 9 справа.
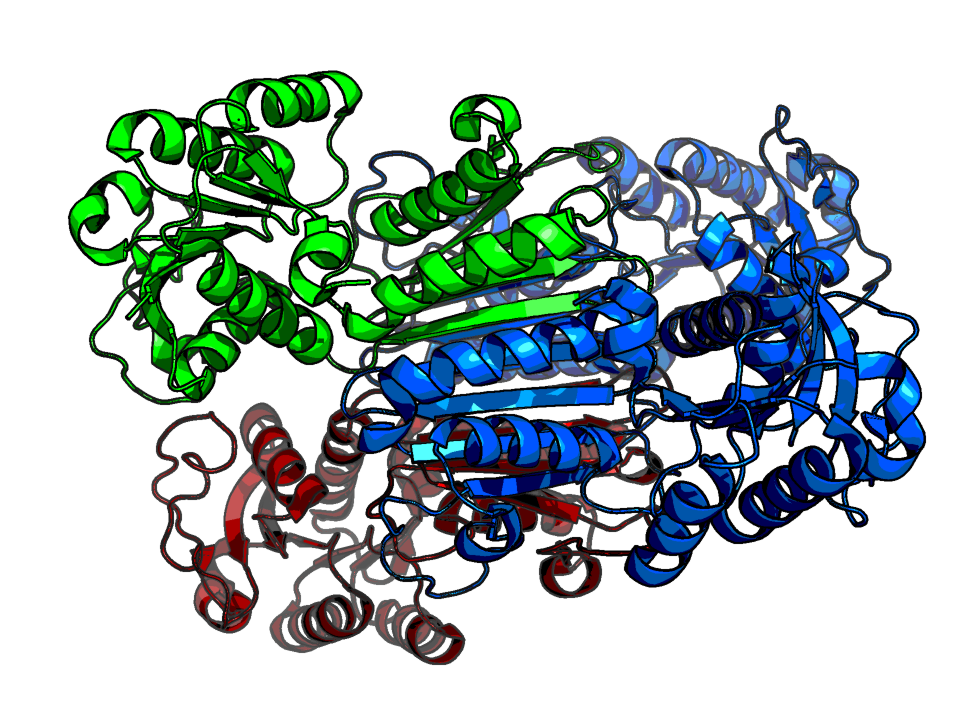
Другим примером несоответствия ассиметрической и биологических единиц служит структура 5XEX. Это полинуклеотидфосфорилаза Staphylococcus aureus, активная в виде тримера. Тем не менее, в ассиметрической единице представлены 2 идентичных тримера (Рис. 10). Достраивая соседей, видим, что они выглядят аналогично, и, фактически, ассиметрическую единицу можно было бы разделить на две. Биологически активный тример показан на Рис 10, внизу.
| |||
| © Alexandra Boyko, 2014. Faculty of Bioengineering and Bioinformatics, MSU. | |||