| Главная страница | Обучение | Обо мне | Ссылки | |||||||||||||||||||||||||
Определение вторичной структуры | ||||||||||||||||||||||||||||
|
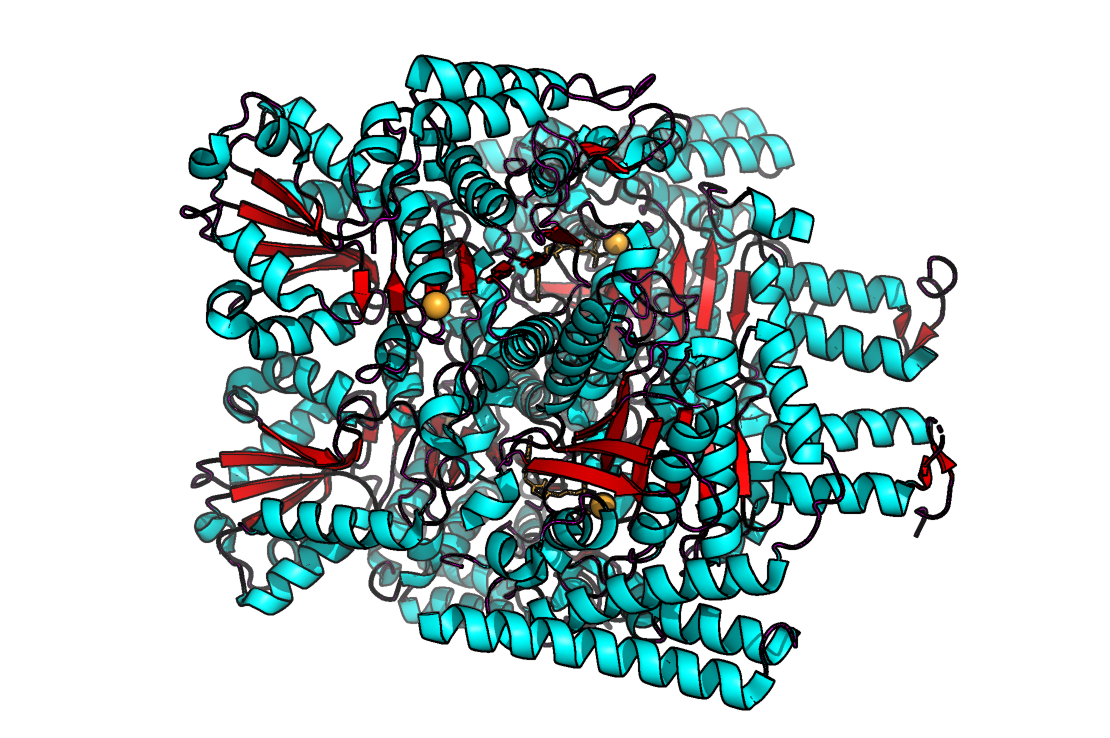
Для предсказания вторичной структуры был выбран белок, рассматривавшийся ранее в блоке о рентгено-структурном анализе, SucA из Mycobacterium smegmatis (см. Практикум 1, PDB-файл 2yic.pdb). Его 3D-структура (PDB-код 2YIC) показана на Рис. 1 (были оставлены только две цепи белка, которые образуют биологически активный гомодимер).
Вторичная структура выбранного белка была определена с помощью серверов DSSP и Stride. Расшифровка символов, обозначающих вторичную структуру:
Полученные результаты для DSSP: в файлe DSSP_2yic.txt и на веб-странице.
Результаты алгоритма Stride визуализированы на Рис. 2 и приведены в файле Stride_2yic.txt.
Сравнение результатов DSSP и Stride по некоторым элементам вторичной структуры изучаемого белка приведено в Таблице 1. Таблица №1. Результаты определения вторичной структуры белка SucA (2YIC) с помощью DSSP и Stride, соотнесенные с истинной моделью PDB. (Нумерация остатков совпадала и начиналась с 366 остатка.)
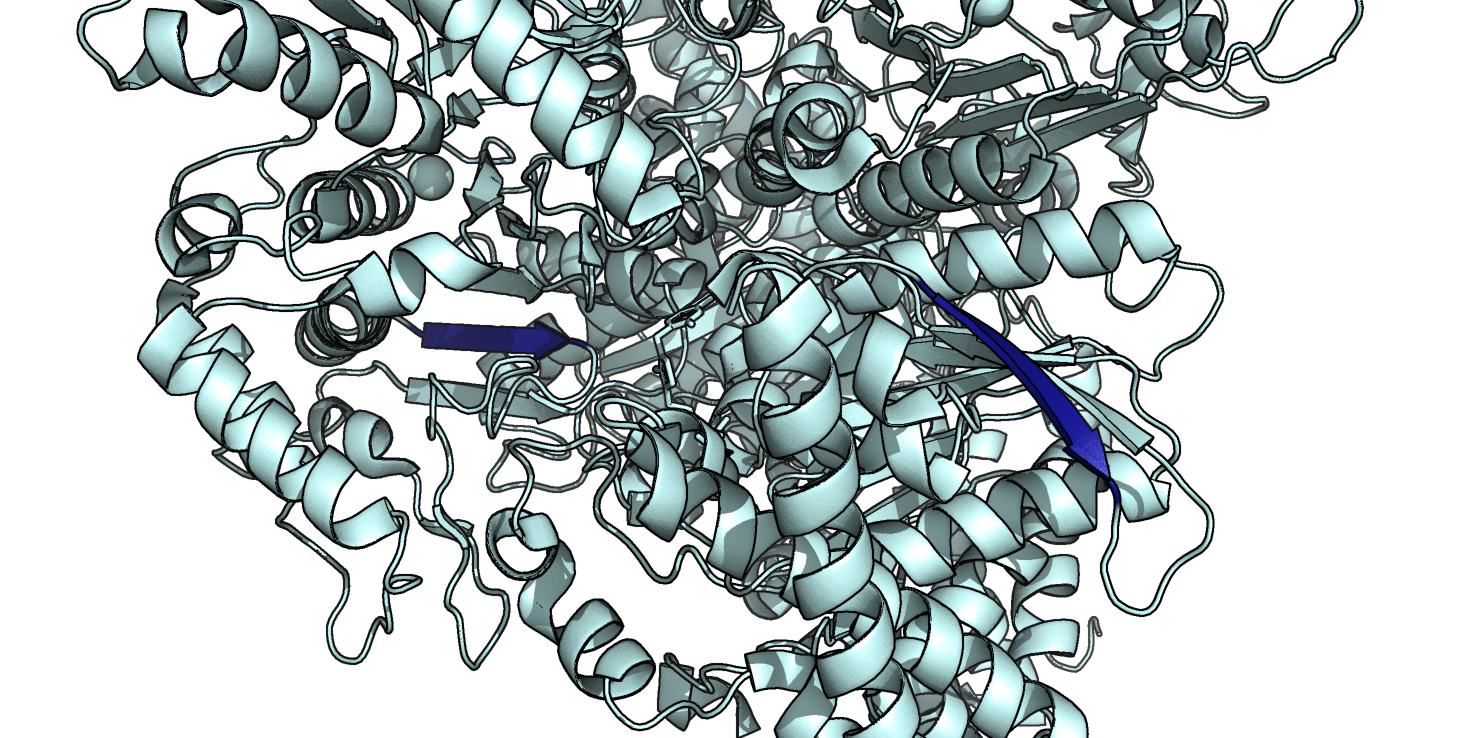
Исходя из данных, приведенных в Таблице 1, можно сказать, что в случае β-тяжей придраться не к чему: программы DSSP и Stride одинаково определяют начало и конец вторичной структуры, и их результаты идеально сходятся с данными, представленными в PDB-файле (Рис.3).
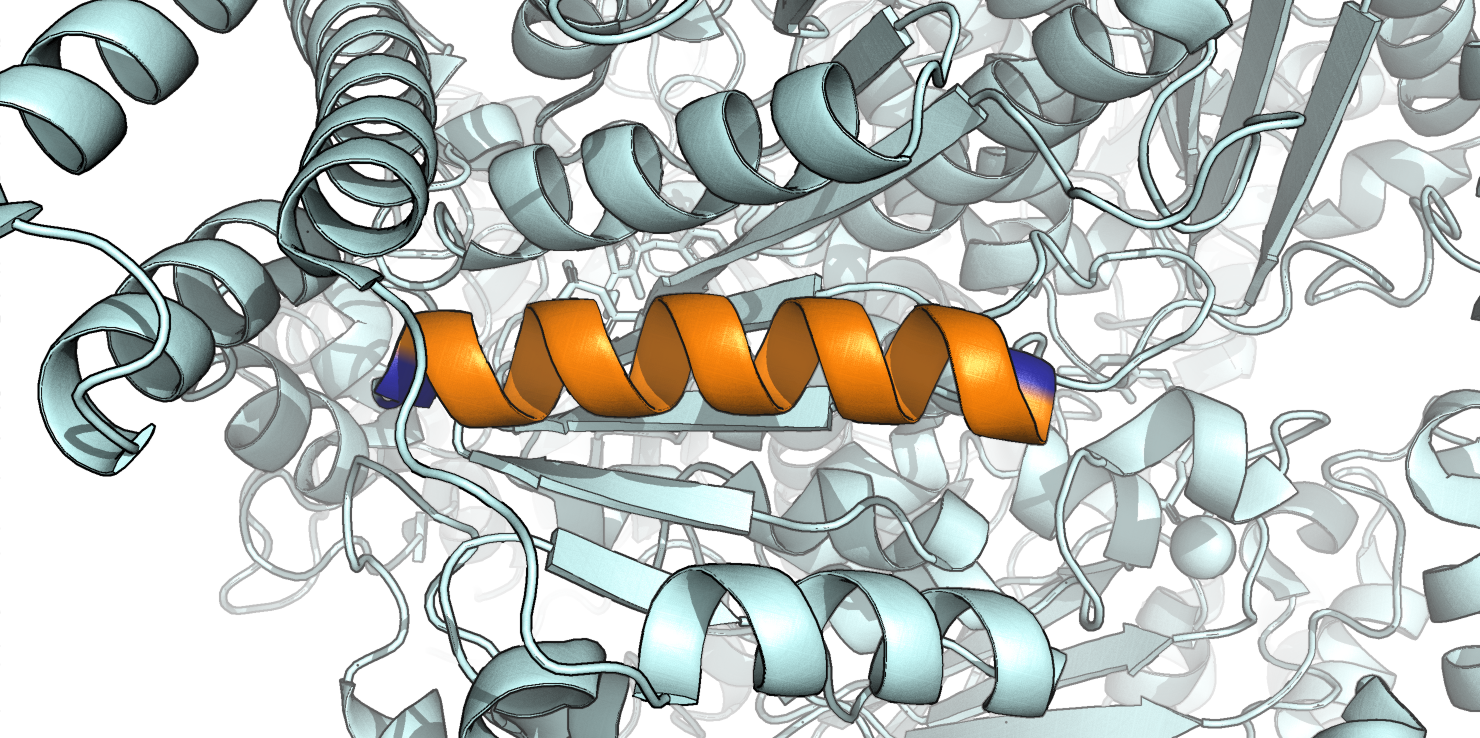
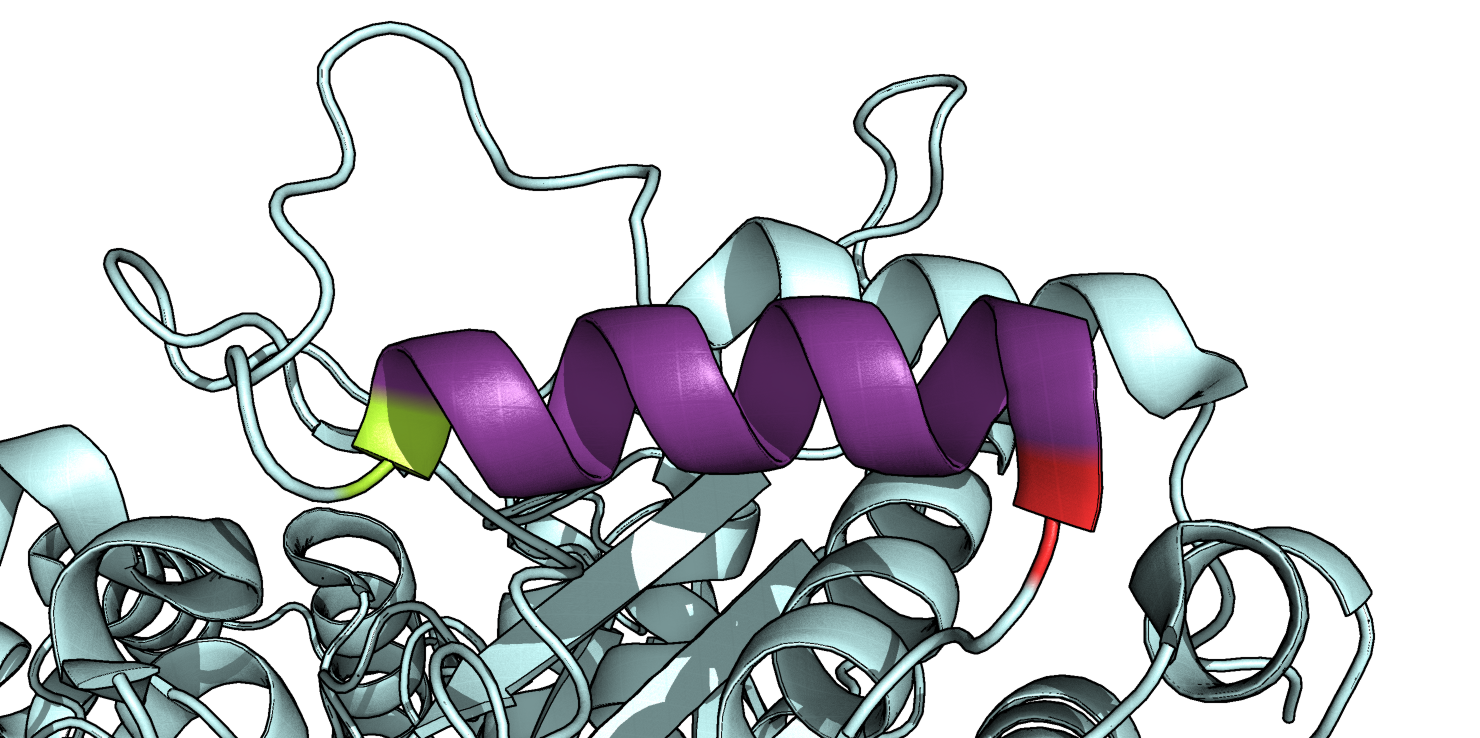
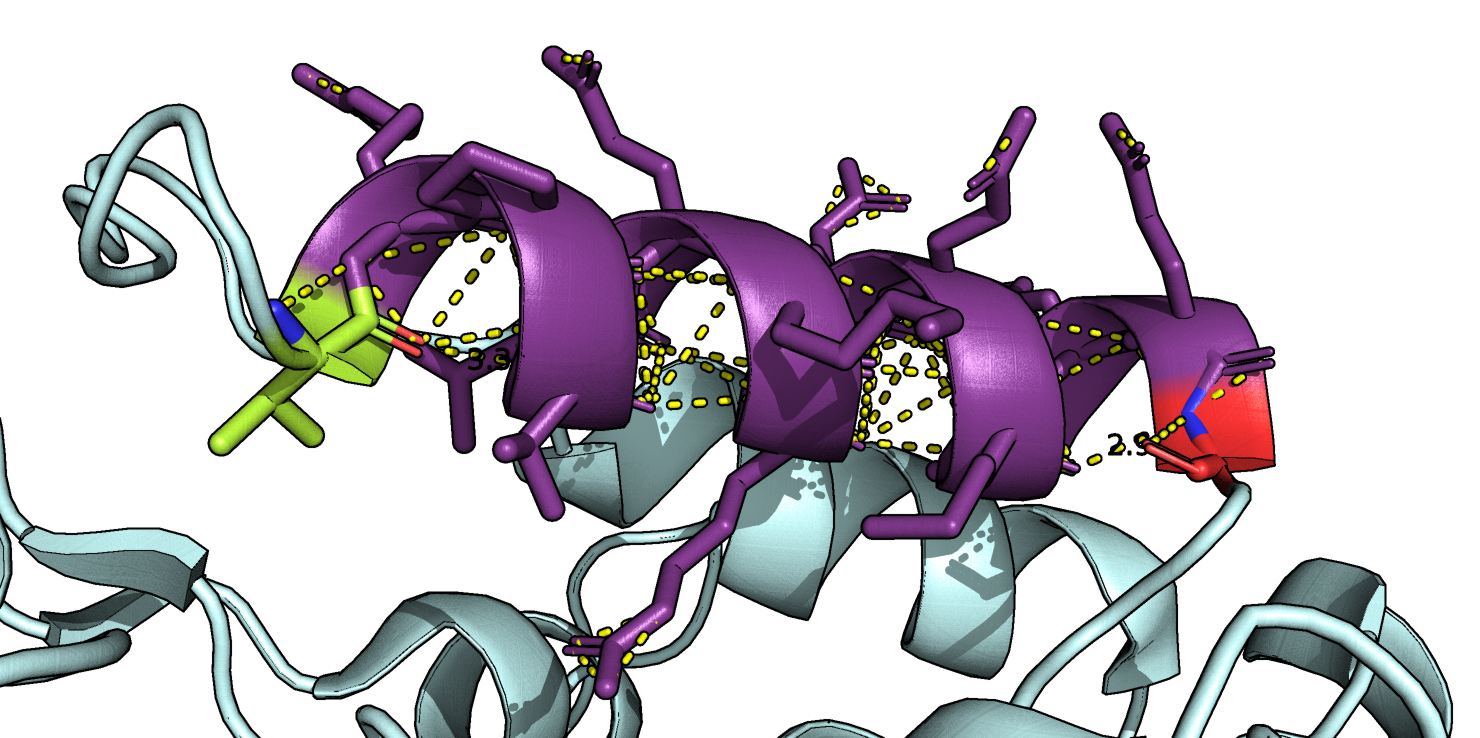
Что касается определения начала и конца α-спирали, в PDB-файле в обоих случаях указан наиболее широкий интервал остатков, тогда как DSSP и Stride для первой спирали обрезают с N и C-конца по одному остатку (Рис. 4). Для второй спирали (№4 по Таблице 1) DSSP не определил N- и C-концевые остатки как входящие в спираль (Val 860 и Gly 874 по PDB-файлу, соответственно), а Stride включил в спираль Val 860, но не Gly 874 (Рис. 5).
Крайние остатки, обозначенные на Рис. 5 желтно-зеленым и красным действительно могут входить в состав α-спирали: кислород Val 860 образует водородную связь с азотом Leu 864, а азот Gly 874 - с кислородом Met 870 (Рис. 6), что соответствует правилам построения α-спиралей. Т. е. основываясь на этих рассуждениях, можно заключить, что в файле PDB эта спираль (23) наиболее полно охарактеризована.
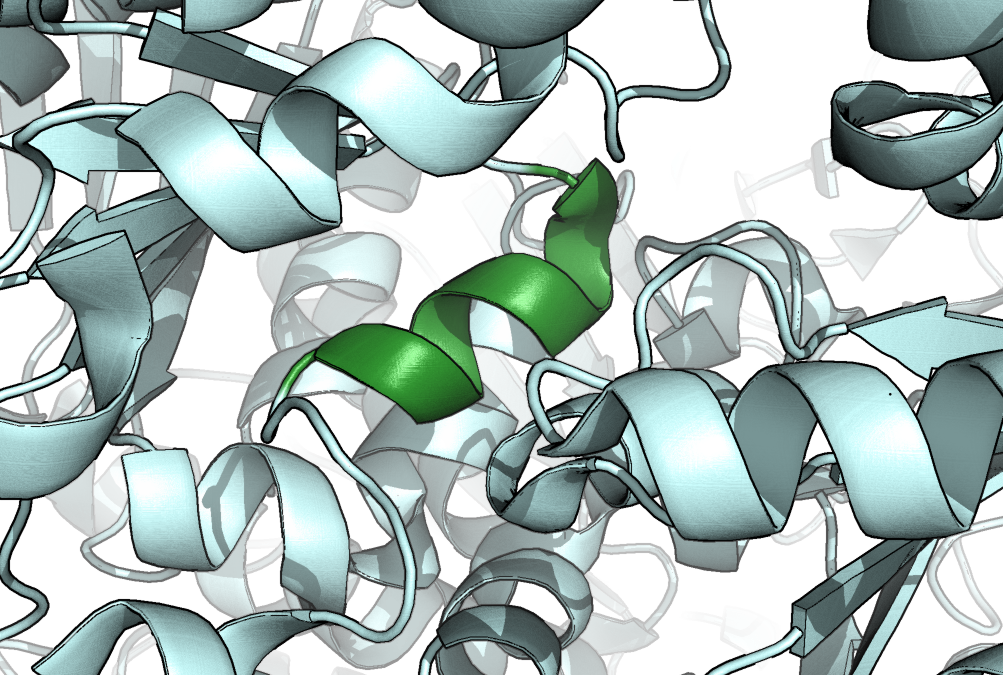
Помимо наиболее распространенных типов вторичной структуры белков (α-спиралей и β-тяжей), в данном белке встречаются и более редкие варианты. Ниже представлены пара примеров: 310 спираль и мостик. На Рис. 7 изображена 310-спираль, в которую (по DSSP) входят остатки B: Asp 697 - Ile 702. В PDB-файле в эту спираль входят также соседние остатки с двух концов: Thr 696 - Gly 703. Даже по cartoons видно, что строение этой спирали несколько отличается от типичной α-спирали - в частности, она выглядит более вытянутой.
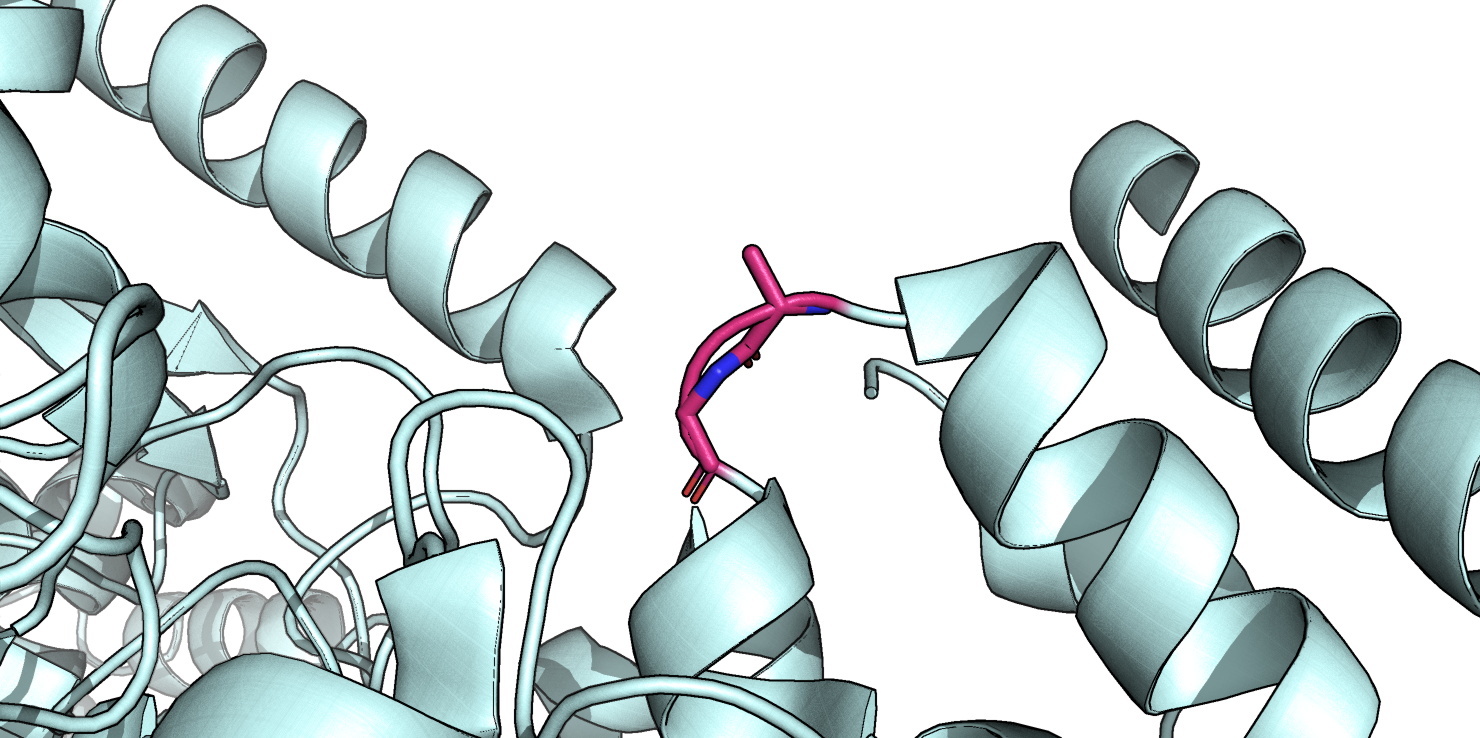
На Рис. 8 показан мостик из остатков Val 501 - Gly 502 (по DSSP) между двумя α-спиралями. Интересно, что по аннотации Stride эти остатки обозначены как поворот (turn), что по смыслу, пожалуй, больше отражает действительность, так как в этом месте пептидная цепочка поворачивает после одной спирали и перед другой (и как раз присутствует глицин - как типичный остаток, участвующий в повороте).
| ||||||||||||||||||||||||||||
| © Alexandra Boyko, 2014. Faculty of Bioengineering and Bioinformatics, MSU. | ||||||||||||||||||||||||||||