 |
 |
|
|
Особенности мембранных белков Задание 0 На сайте OPM был произведен поиск среди белков трансмембранного типа. Результаты представлены в таблице 1 Таблица 1. Описание трансмембранных белков с известной 3D структурой
Поиск гомологов Для изучения был выбран белок EcfT. blastp базы данных refseq с отключением из выборки филума (Firmicutes), к которому принадлежит организм (Lactobacillus brevis), в котором был найден изучаемый белок, дал слишком большое количество результатов. Было решено разделить поиск на несколько частей. Сначала искать гомологи только в прокариотах, а потом - в эукариотах и археях. Поиск в прокариотах с исключением Firmicutes, e-value 1e-05 и максимальным количеством результатов равным 5000 дал 1442 результата. Из них было выбрано девять белков. Поиск по эукариотам дал результаты с выравниванием только по той части белка, которая находится вне мембраны. Было решено их не включать. Поиск по археям дал 323 результата, из которых было выбрано три белка. Анализ структуры белка Таблица 2. Анализ структуры трансмембранного белка EcfT (PDB: 4HUQ, цепь T)
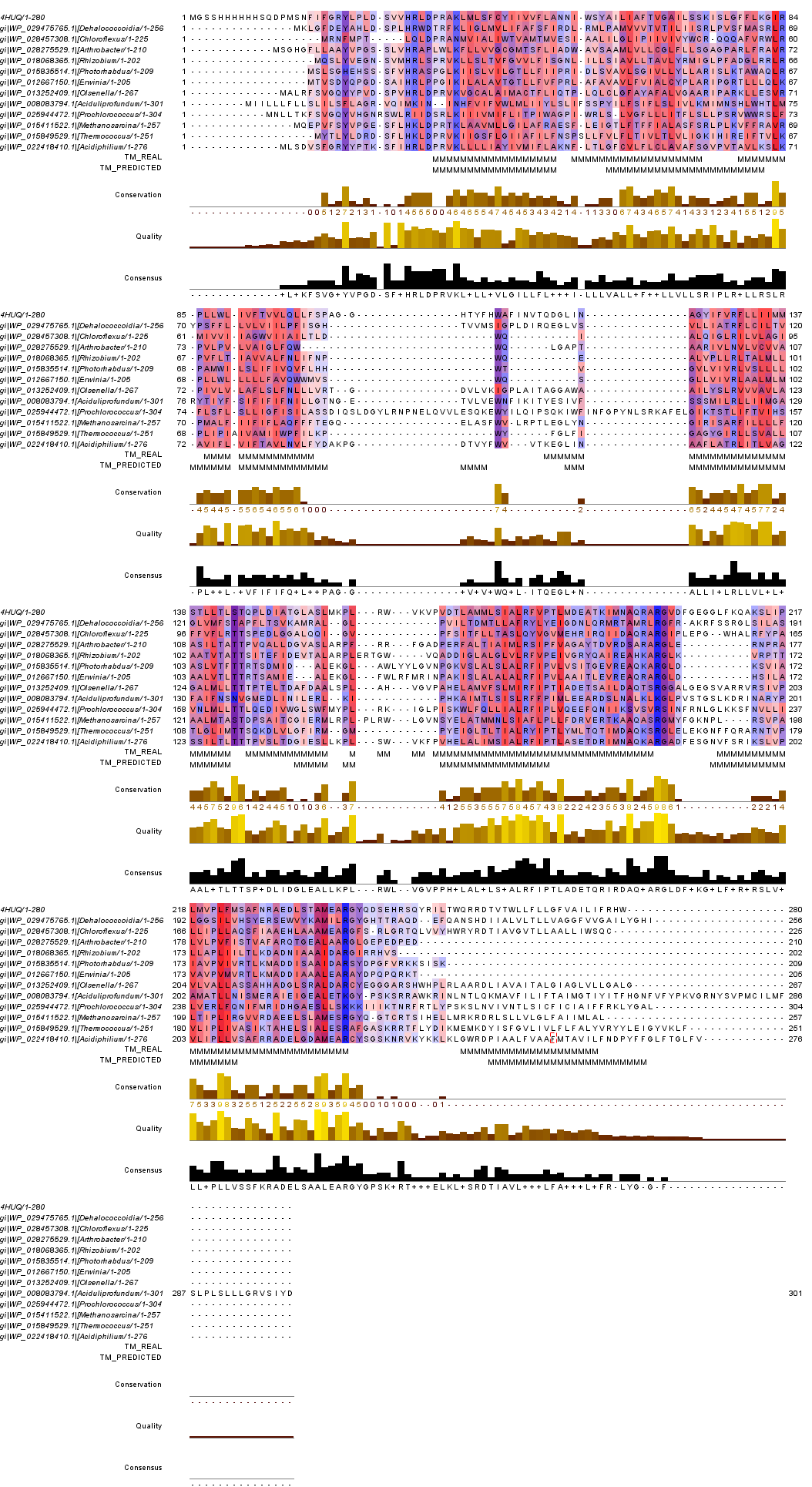
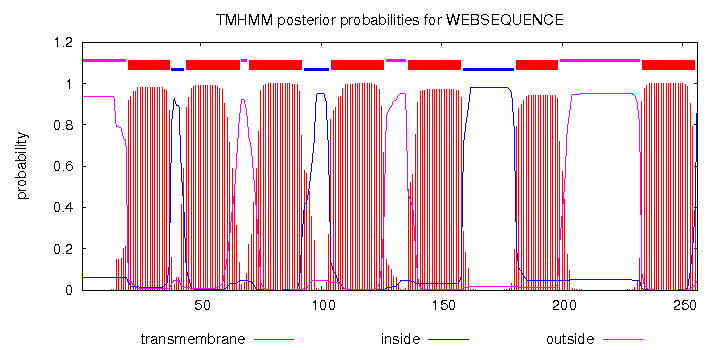
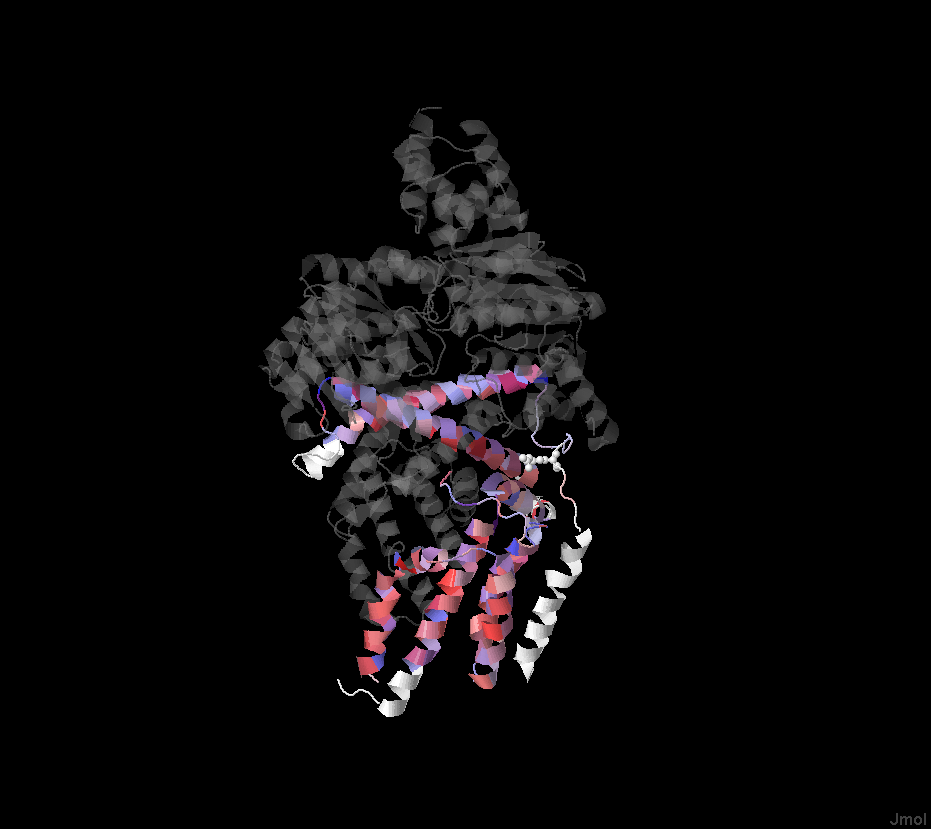
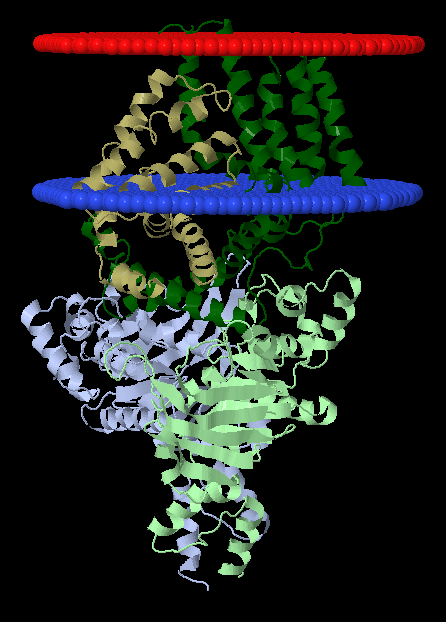
Расшифровка TC-кода. 3 - первичные активные транспортеры 3.A - транспортеры, использующие энергию гидролиза P-P-связей 3.A.1 - ATP-связующее Cassette суперсемейство 3.A.1.28 - Queuosine семейство 3.A.1.28.2 - Фолатный транспортер (The folate transporter), FolT/EcfAA''T Анализ множественного выравнивания трансмембранных белков Было постороено множественное выравнивание гомологов белка EcfT с помощью программы Muscle. Затем в jalview к выравниванию были добавлены строки аннотации для записи трансмембранных спиралей TM_REAL (в которую вводились данные с 3D-структуры) и TM_PREDICTED (которая использовала данные с предсказания программой TMHMM по последовательности WP_029475765). В jalview была прикреплена 3D-структура к EcfT. Проведена окраска по схеме "Hydrophobicity" с режимом "By Conservation". Порогом консервативности равен 15%. Результаты можно увидеть на рисунках 1-4. Рисунок 1. Выравнивание гомологов белка EcfT. Окраска проведена по схеме "Hydrophobicity" с 15% порогом консервативности. Рисунок 2. Предсказание трансмембранных спиралей по последовательности WP_029475765. Рисунок 3. 3D структура 4HUQ с окраской по консервативности цепи EcfT. n-сторона сверху, а p-сторона - снизу. Рисунок 4. Альтернативная 3D структура 4HUQ с добавлением "мембраны". n-сторона снизу, а p-сторона - сверху. Из полученных данных получаем: a) Большая часть участков, отвечающих за трансмембранные спирали, консервативны. Есть цепь, которую по рисунку 3 можно назвать неконсервативной. Но получилась она такой только из-за того, что у четырех гомологов нет данных по последовательности в этой части цепи (концевой участок). В спиралях чаще всего встречаются лейцин, валин и изолейцин. b) Существуют консервативные участки перед первой спиралью, между первой и второй, второй и третьей, третьей и четвертой, а также несколько консервативных участков между четвертой и пятой спиралями. Консервативны также участки между шестой и седьмой спиралями, кусочки между седьмой и восьмой, девятой и десятой, а также довольно большой участок между десятой и одиннадцатой спиралями. Стоит учесть, что некоторые из спиралей не проходят через мембрану, хоть и принадлежат к изучаемой цепи (и тоже находятся программой, ищущей трансмембранные участки). Девятая и десятая - из их числа. c) В трансмембранных спиралях присутствуют консервативные и заряженные, и полярные участки. Впрочем, их количество невелико. Возможно, они играют роль в стабилизации структуры. Если еще посмотреть на рисунок 4, взятый с opm.phar.umich.edu, то можно заметить, что из мембраны выглядывает совсем уж маленький кусочек нашего белка. В этом кусочке нет положительно заряженных аминокислот. Так что правило "positive-inside" не нарушается. Программа TMHMM показала примерно те же трансмембранные спирали, что и на реальной структуре, но с несколькими отличиями. Некоторые цепи были показаны намного меньше по размеру (программа не отмечала, как возможную цепь, участки с пониженным содержанием неполярных аминокислот. Впрочем, эти ошибки в основном находятся как раз среди спиралей, что находятся в цитоплазме (девятая и десятая спирали). Также программа предсказала на одну спираль больше (если смотреть на исходную цепь, то это место находится между четвертой и пятой спиралями. При этом, для этого участка нет 3D структуры у исходной модели. |
 |
 |
|