 |
 |
|
|
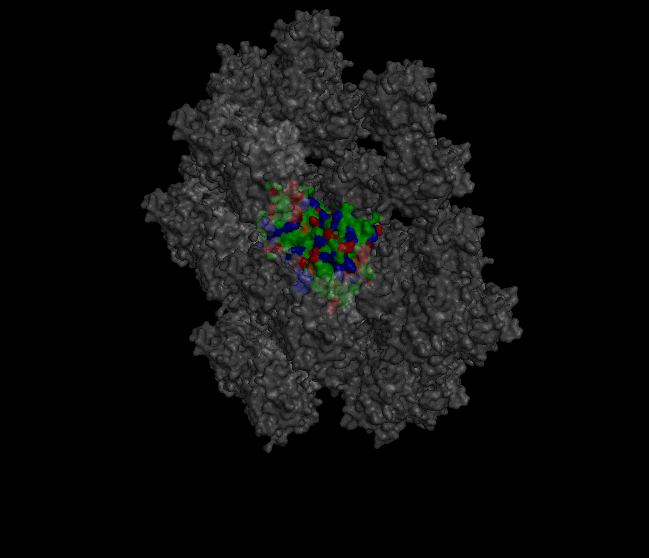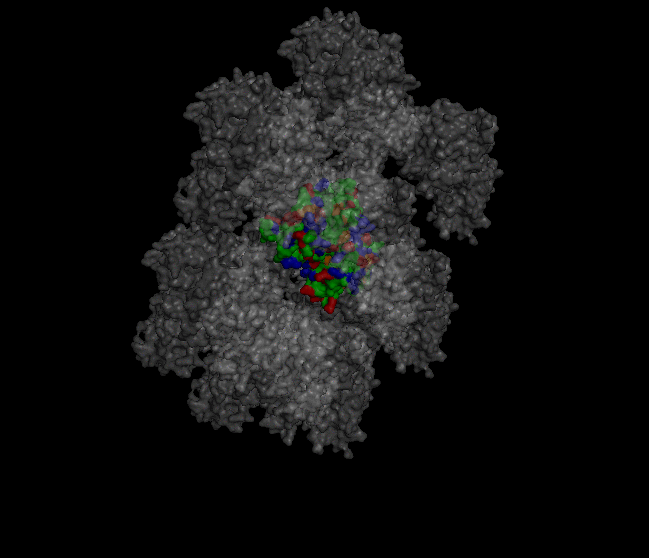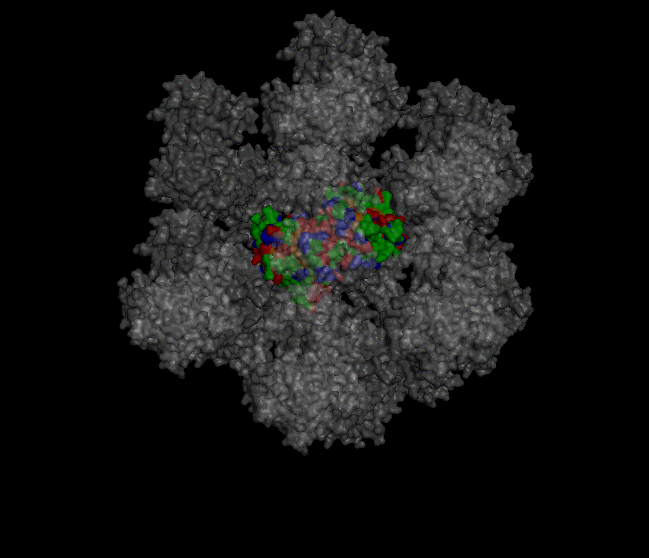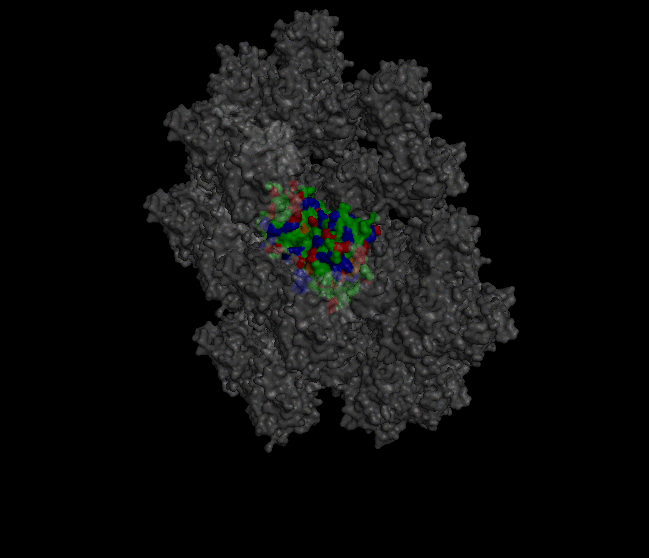
Восстановление кристалла из PDB-файла Кристаллографические характеристики В pdb-файле белка 1XZO была найдена следующая строка: CRYST1 68.033 68.033 191.733 90.00 90.00 120.00 P 32 2 1 12 Из строки получаем, что направляющие векторы a, b и c равны, соответственно, 68.033, 68.033 и 191.733. Углы между направляющими векторами: α = 90.00, β = 90.00, а γ = 120.00. Кристаллографическая группа: P 32 2 1. Число молекул в ячейке равно 12. Построение соседних ячеек кристалла Для создания изображения кристалла была использована команда "symexp sym, 1xzo, 1xzo, 30" (рисунок 1).
Рисунок 1. Визуализация части кристалла. В центре находится "главная" структура, с которой предстоит работать. Командами "select protein, byres (1xzo within 4 of sym*)", "select neighbours, byres (sym* within 4 of 1xzo)" были выявлены области взаимодействия белка с соседями в кристалле. Командой "distance hydrogen_bonds, protein, neighbours, 4" были выявлены водородные связи в местах контактов
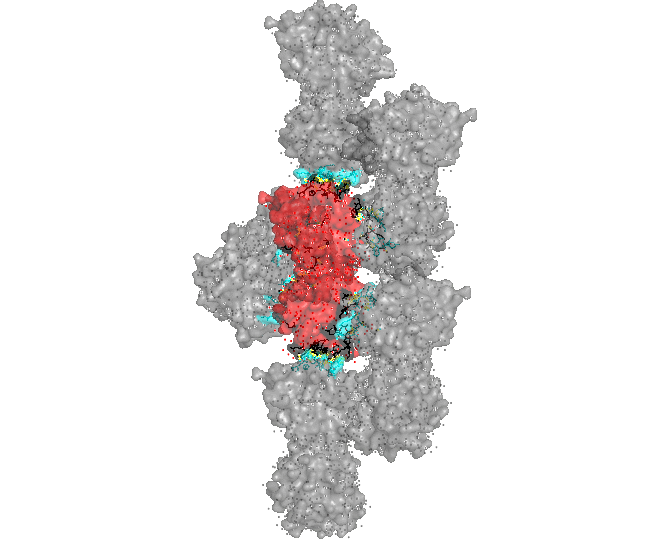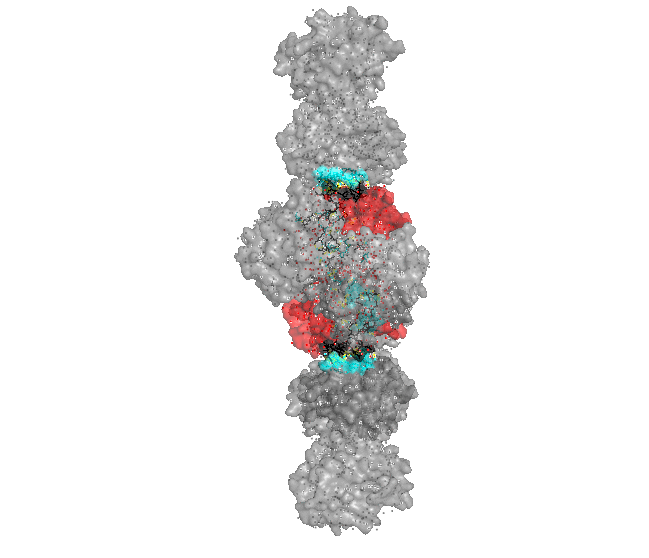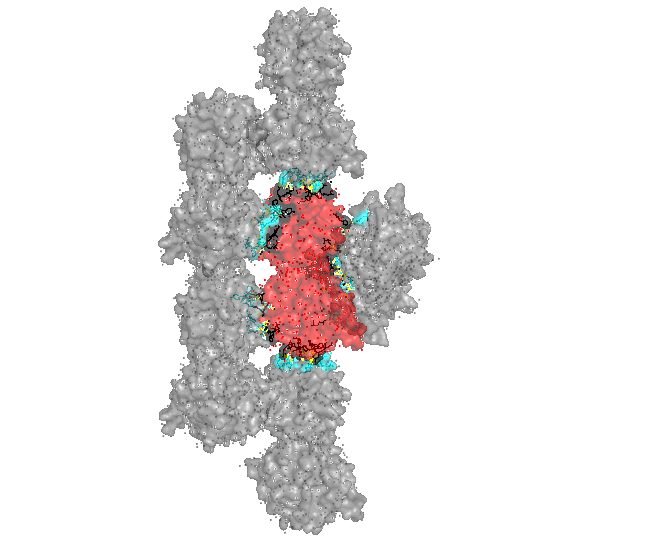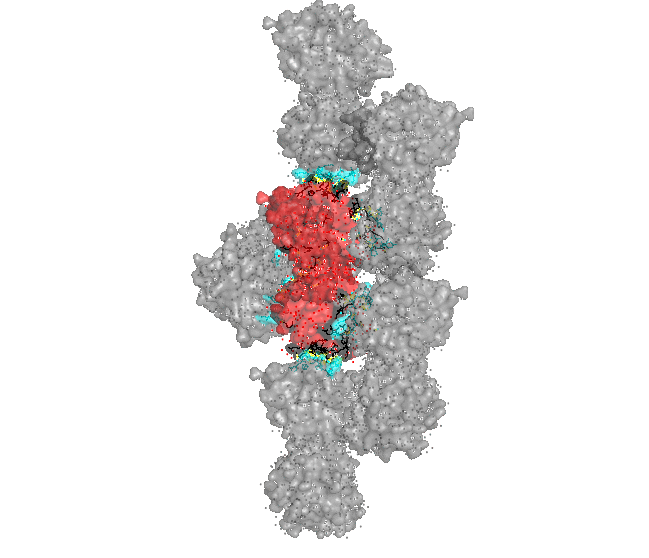
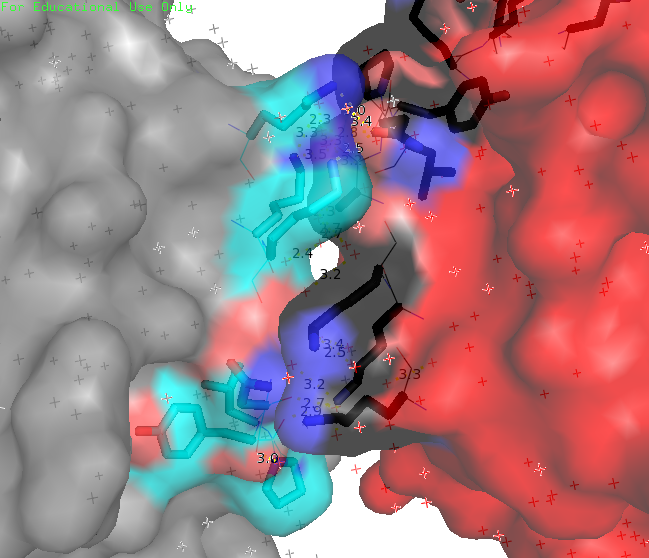
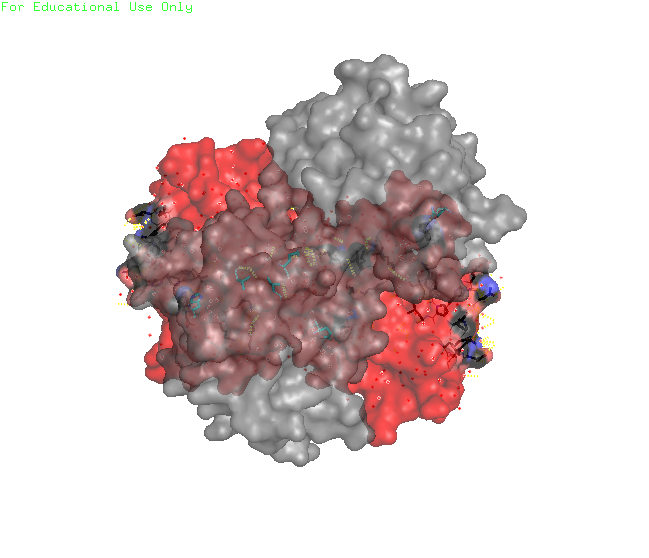
Рисунок 2. Визуализация контактов белка с соседями в кристалле. Красным выделен изучаемый белок, а серым – соседи. Места контактов со стороны изучаемого белка выделены черным, а со стороны соседей – голубым.
Рисунок 3. Область контакта изучаемого белка с "двойкой" соседей. Область контакта только одна.
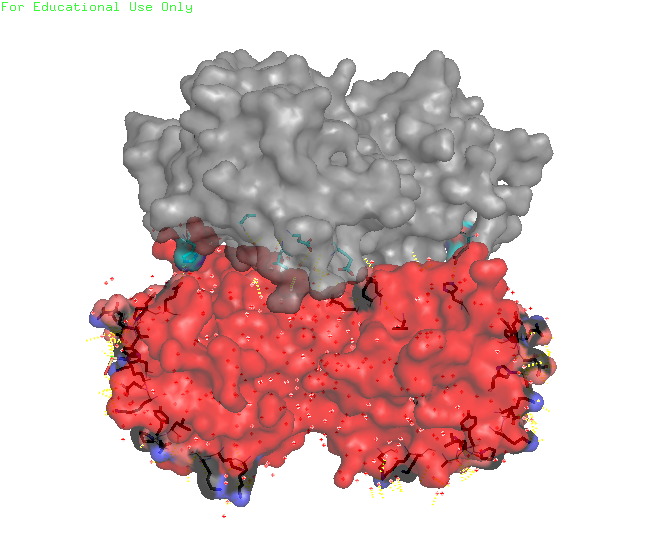
Рисунки 4, 5. Контакт изучаемого белка с одиночным белком сбоку (крест-накрест).
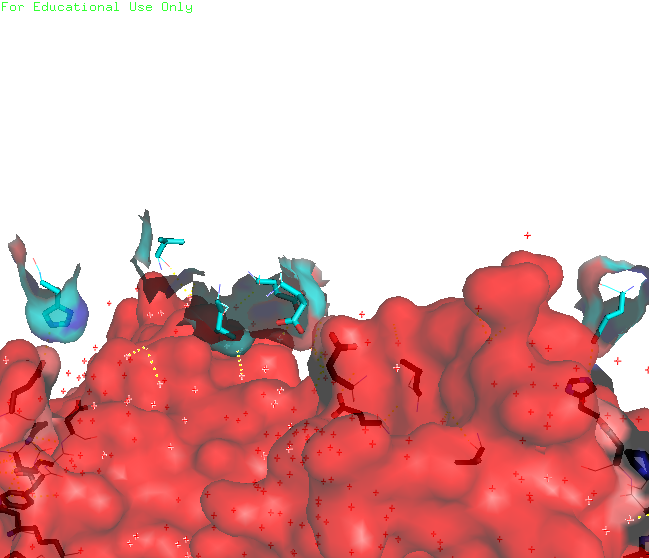
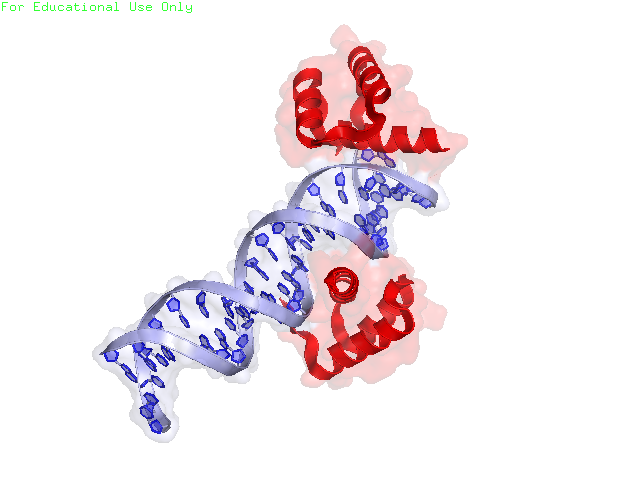
Рисунок 6. Малая поверхность контакта изучаемого белка с одиночным белком сбоку (крест-накрест). В контакте участвует только 6 аминокислот от каждого белка (двух его цепей), причем все они удалены друг от друга. С каждым соседом, кроме одного, изучаемый белок имеет по одной зоне контакта. С белком, с которым изучаемый белок связывается крест-накрест, зон контакта столько же, сколько и аминокислот участвующих со стороны одного белка: 6. Интересно, что в природе белок представлен в виде мономера. Контакты белков в кристалле тоже не представляют природные взаимодействия (заметна протяженная структура из множества белков, упакованных стопкой, что не особо встречается в природе). Странное расположение белковых цепей в структуре ДНК-белкового комплекса Для работы была выбрана структура 3hdd, в которой белковая цепь находится на "краю" ДНК (Рисунок 7).
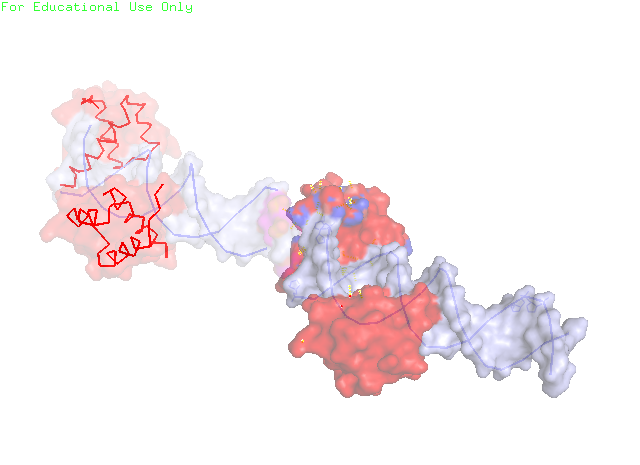
Рисунок 7. Странное расположение белковой цепи в ДНК-белковом комплексе. Однако, если расширить кристалл, то можно заметить, что на самом деле "край" ДНК находится рядом с новой цепью ДНК (из соседней ячейки) (рисунки 8 и 9). Более того – изучаемая белковая цепь имеет несколько водородных связей с этой новой цепью ДНК (рисунок 10).
Рисунок 8. Две ячейки ДНК-белкового комплекса.
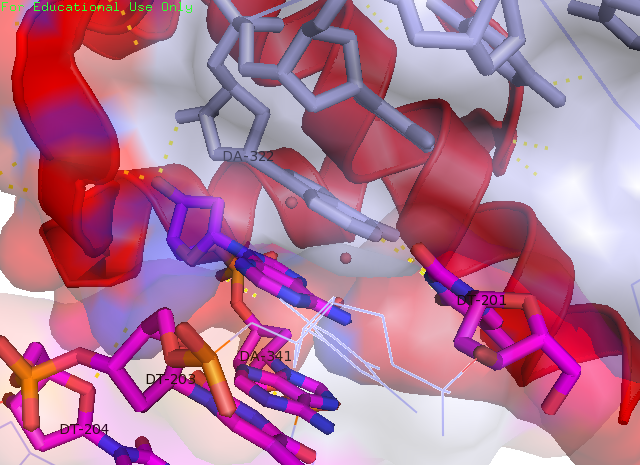
Рисунок 9. ДНК из двух ячеек находятся так близко друг к другу, что образуют водородные связи между тимином (DT-201)одной цепи и аденином другой (DA-322). Розовым отмечена ДНК из другой ячейки.
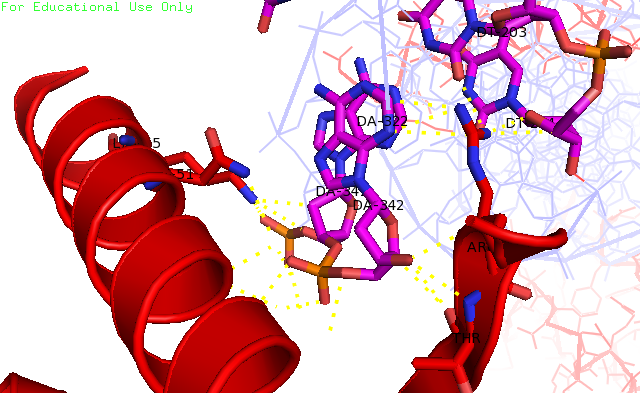
Рисунок 10. Водородные связи между белком из одной ячейки и ДНК из другой. Напрямую контактируют Lys55, Arg5, Thr6. Красным отмечен белок из одной ячейки, а розовым – ДНК из другой ячейки. Выводы Таким образом, пример с ДНК показывает, что одной из причин, вызывающей "странности" в структуре, может являться взаимодействие с соседями из другой ячейки. |
 |
 |
|