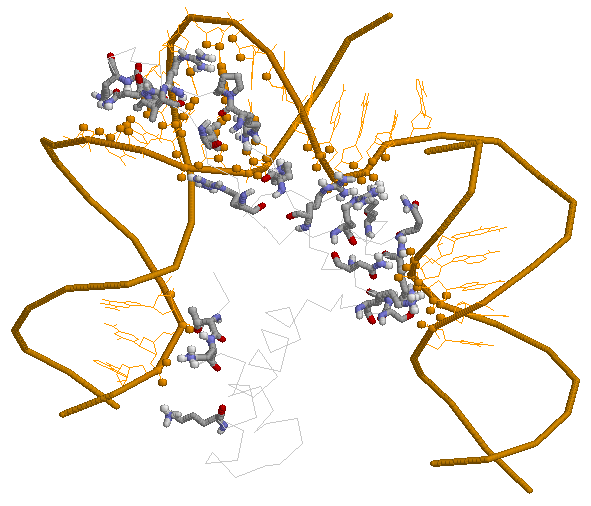
Контактирующие атомы выделены более крупными сферами по сравнению с остальным
белком.
Золотым окрашена ДНК, серым — protein.
Для создания изображения был использован RasMol.
 Cписок аминокислотных остатков цепи А, контактирующих с ДНК:
Cписок аминокислотных остатков цепи А, контактирующих с ДНК:
С ДНК в белке (цепь А) контактируют следующие аминокислоты:
THR4, LYS5, LYS24, LYS45, SER47,GLY48, ASN51, ARG55, LYS57, ARG60, PRO61, ARG63, PRO65, LYS66, ILE71, ILE73, ARG76, ARG82, GLY84, GLN85, LYS86, LYS88.
Предположить взаимодействие между молекулами можно, если расстояние между ними не больше 4.5 Å, но так как взаимодействие между ДНК и цепью А белка осуществляется только за счет водородных связей, то расстояние снижается до 3.5 Å.
Замена аминокислотного остатка белка, которая может привести к потере способности связывания цепи А с ДНК:
В задании требуется заменить 1 остаток, но так как зона контакта очень обширная, то, скорее всего, такая замена не приведет к потере способности связывания белка с ДНК. Поэтому я предложу замену нескольких аминокислотных остатков.
Молекула ДНК заряжена отрицательно, т.к. в ней содержится большое количество остатков фосфорной кислоты.
Поэтому, чтобы нарушить механизм связывания белка с ДНК, нужно заменить положительно заряженные остатки аминокислот на отрицательно заряженные.
В этом случае взаимодействующие молекулы будут отталкиваться друг от друга.
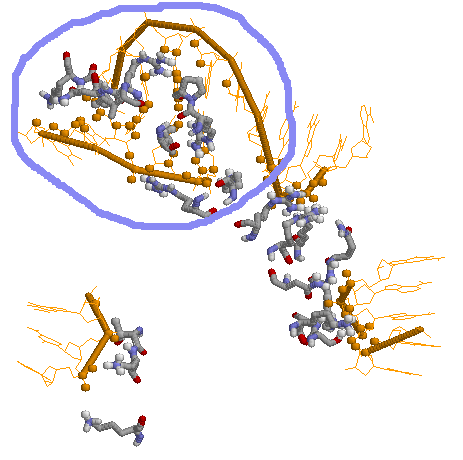
По рисунку видно, что наиболее сильное взаимодействие там, где обведено фиолетовым кругом (точнее, замкнутой кривой. Так как я обводила от руки, то "что выросло, то выросло":))..).
Поэтому, если заменить все остатки в этой области (LYS57, LYS66, ARG60, ARG63, ARG76, PRO61, PRO65, ILE71, ILE73) и все положительно заряженные остатки вне ее (LYS5, LYS24, LYS45, LYS86, LYS88, ARG55, ARG82) на, допустим, аспарагиновую кислоту, то с большой вероятностью возможность взаимодействия будет потеряна.
Замена аминокислотного остатка белка, контактирующего с ДНК, но тем не менее, предположительно, мало влияющая на способность связывания с ней:
Замена любого из остатков THR4, GLN85, SER47, GLY48, GLY84, ASN51, например GLY48 на ALA48 не приведет к существенному изменению способности к связыванию, так как оба остатка нейтральны и несильно отличаются по размеру.