Определение вторичной структуры
Для выполнени данного задания я выбрал структуру небольшого белка E. coli 5w39. Разрешение структуры 2.48 Å, длина цепи - 171 аминокислотный остаток. Внешний вид структуры в визуализации cartoon представлен на рисунке 1; структура покрашена в соотвествии с записанной в pdb-файле информацией о вторичной структуре белка (color -> by ss):
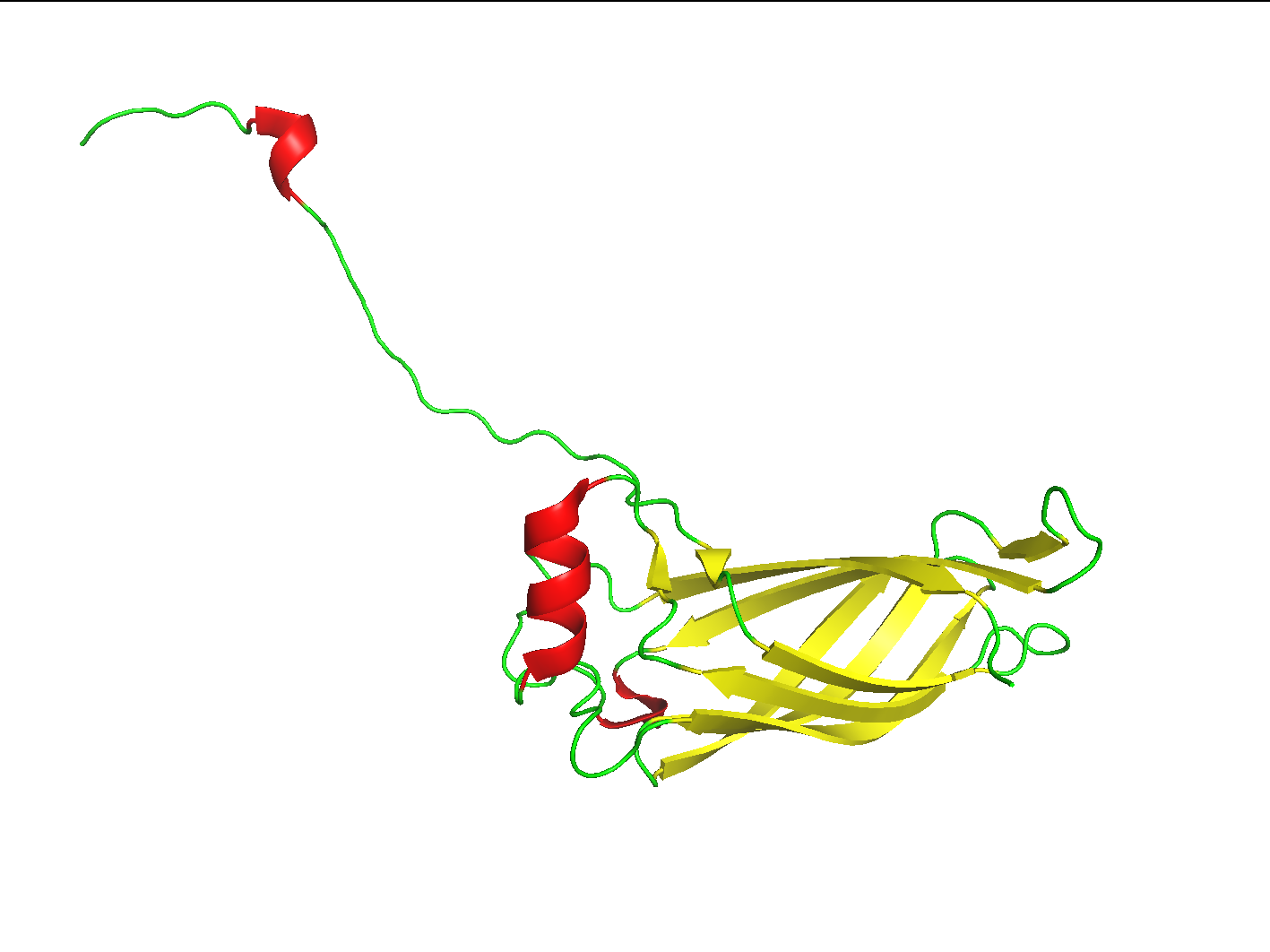
Вторичная структура белка была посчитана при момощи онлайн-сервисов двух программ - DSSP и Stride. Текстовая выдача программ доступна для скачивания: dssp.txt, stride.txt. Выдача Stride также доступна в графическом формате (см. рис. 2). Стоит отметить, что в программе DSSP для описания классов вторичной структуры используется классификацая, называемая Q8 accuracy, предполагающая 8 различных классов вторичной структуры:
- G - 310-спираль;
- H - α-спираль;
- I - π-спираль;
- E - β-тяж;
- B - β-мост;
- T - β-поворот;
- S - изгиб;
- L - петля или иррегулярная структура (сюда относится всё, что не попало в предыдущие 7 классов).

Далее я сравнил посчитанные программами коорднаты двух спиралей и двух β-тяжей с записанными в PDB-файле координатами. Результаты сравнения - в таблице 1.
Таблица 1. Сравнение границ элементов вторичной структуры белка 5w39 с посчитанными программами DSSP и Stride.
| # | Элемент (согласно PDB) | PDB | DSSP | Stride |
|---|---|---|---|---|
| 1 | 310-спираль | Asp27-Thr31 | Lys28-His30 (G) | Asp27-Thr31 (T, Turn) |
| 2 | β-тяж | Phe65-Lys73 | Glu64-Lys73 (E) | Glu64-Lys73 (E, Strand) |
| 3 | α-спираль | Asn81-Gln90 | Gln82-Gln89 (H) | Gln82-Gln89 (H, AlphaHelix) |
| 4 | β-тяж | Glu149-Lys160 | Glu149-Lys160 (E) | Glu149-Lys160 (E, Strand) |
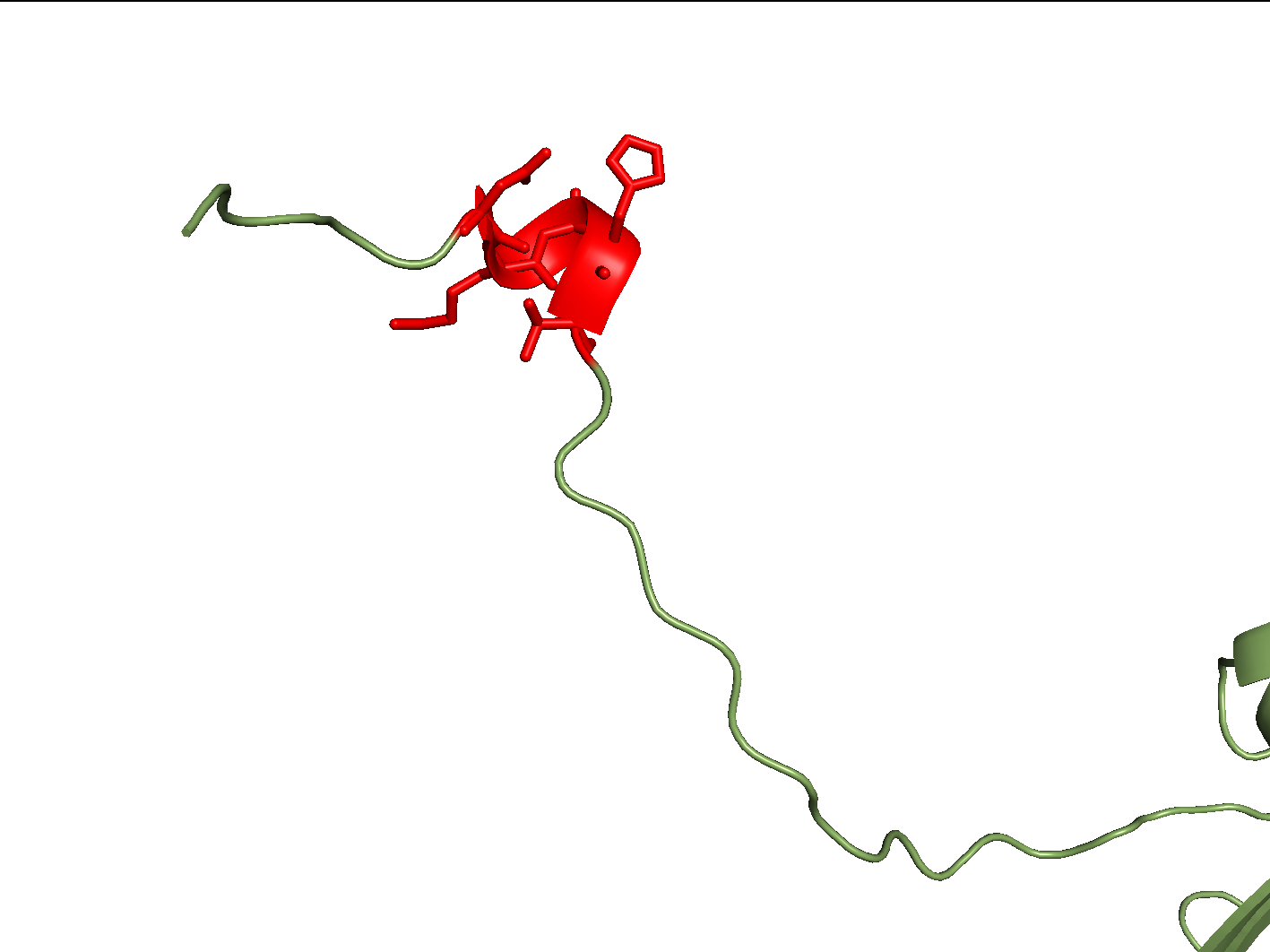
В случае β-тяжей обе программы определяют границы одинаково хорошо (пропустив всего один остаток в случае 2), однако со спиралями дело обстоит немного хуже: α-спираль обе программы определили на 2 остатка короче, чем авторы структуры, а 310-спираль алгоритм Stride определил в β-поворот (алгоритм DSSP при этом соглашается с авторами структуры, но оба алгоритма выделили данному элементу на 2 остатка меньше). Примечательно, что данный элемент находитя в длинном слабоупорядоченном N-конце белка (см. рис. 3), на котором DSSP вообще почти ничего не предсказал (кроме собственно участка 27-31), а Stride выдал смесь из "поворотов" и "катушек" (C, Coil). Также стоит отметить, что для остатков внутри исследуемого участка не соблюдается выгодное для существования 310-спирали соотношение (φ + ψ ~ -75°) [1]. Учитывая этот факт, а также то, что Stride использует в своей работе не только PDB-файл, но и статистические данные, можно предположить, что авторы структуры и алгоритм DSSP в данном случае ошибаются, и элемент 27-31 является β-поворотом.
Мануал по формату записей в PDB-файле. Информация о вторичной структуре начиная со страницы 166.
Назад к странице семестров