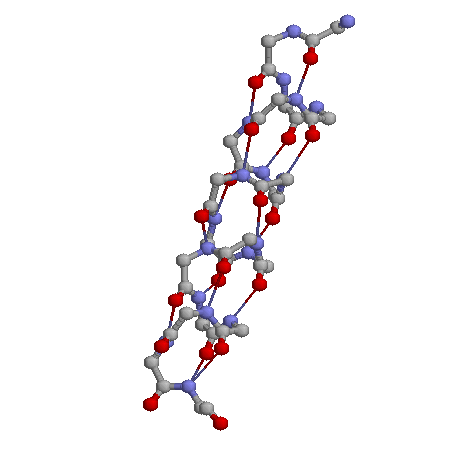
Значения торсионных углов для альфа-спирали можно найти на странице
Торсионные углы.
Значения торсионных углов
фи:среднее -61.9, максимальное -46.9, минимальное -75.2;
пси: среднее -38.6, максимальное 10.5, минимальное -52.2
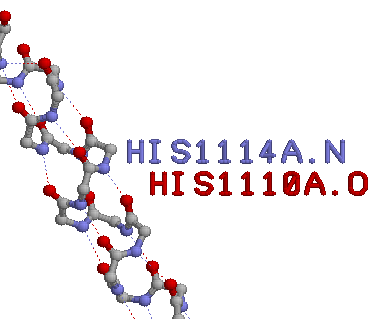
Структура спирали удерживается 15 водородными связями
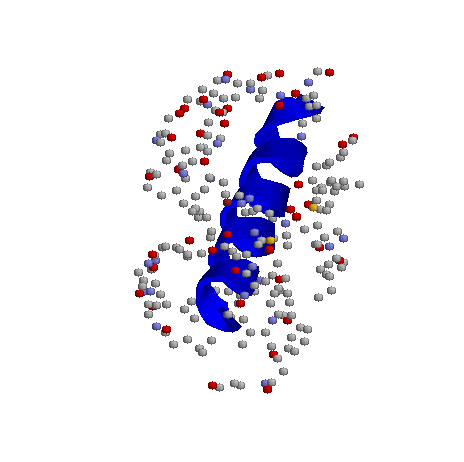
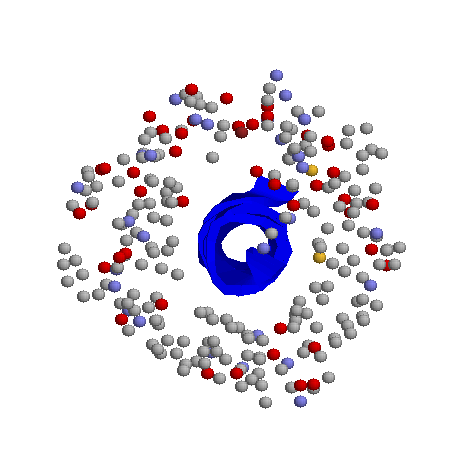
В моем случае водородные связи были только между атомами азота и кислорода, а связей типа кислород-кислород или азот-азот не нашлось. На первый взгляд кажется, что контакты между альфа-спиралью и другими частями белка разбросаны достаточно равномерно, но на самом деле можно, приглядевшись, выделить "сгустки" контачащих атомов, и более S"пустые" места. В целом, можно сказать, что спираль как-бы обернута в неравномерный слой атомов других частей белка, причем часть её выступает из этой "обертки".
| Имя атома остатка спирали | Имя контактирующего атома | Расстояние (Ангстрем) | Предположительная природа контакта |
| LEU1119A.CA | PRO1071A.CB | 4.259 | гидрофобная |
| LEU1117A.O | TYR1122A.N | 3.095 | водородная |
| HIS1118A.O | GLY1121A.N | 3.147 | водородная |
| HIS1110A.ND | MET1141A.SD | 4.552 | гидрофобная |
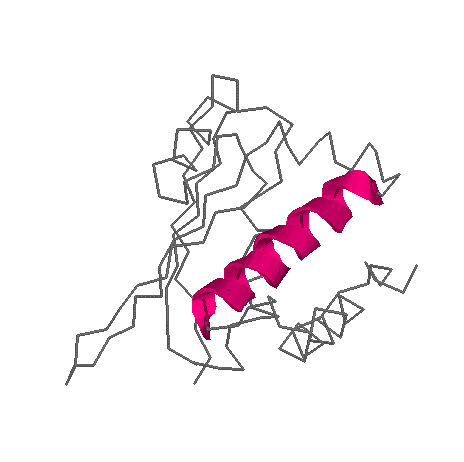
с наложенным изображением спирали и слоя