| Главная страница | Семестры | О себе | Ссылки |
Вторичные структуры белков - это стандартные конформации, принимаемые последовательно связанными аминокислотных остатками и стабилизированные множеством водородных связей. Водородная связь, в свою очередь, - это притяжение отрицательно заряженного атома к положительно заряженному водороду, связанному с другим сильно электроотрицательным атомом. 2 основных и наиболее распространенных элемента вторичной структуры встречаются и в белке LigA.
α-спираль
α-спираль - винтообразно изгибающаяся пептидная цепь, стабилизированная остовными водородными связями между NH- и CO-группами. В белке LigA множество α-спиралей, на рисунках 1 и 2 вы можете рассмотреть одну из них.
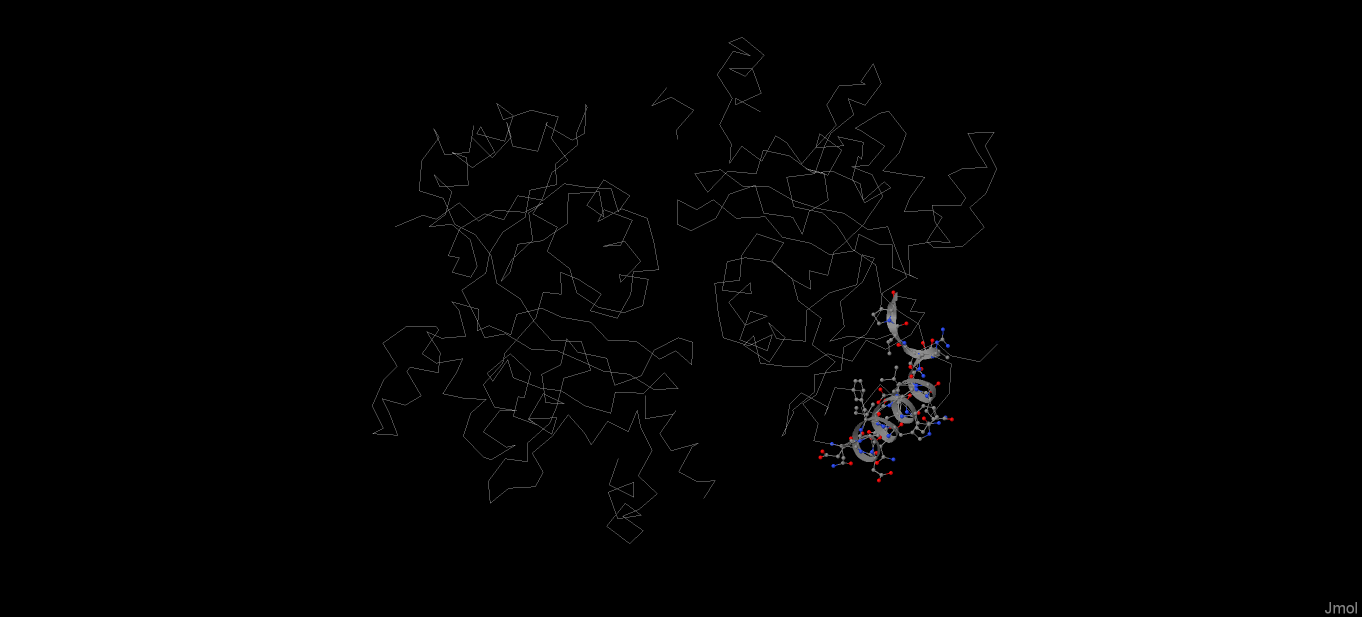
Рис. 1. Положение выбранной α-спирали в белке LigA
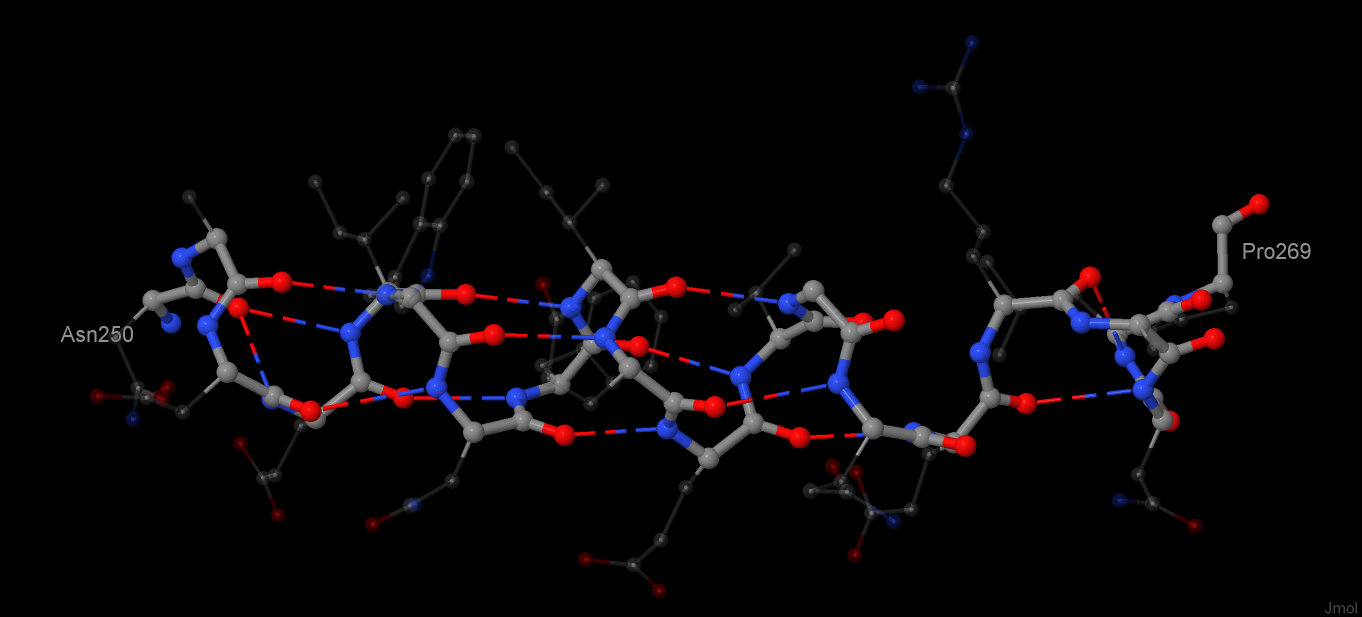
Рис. 2. α-спираль с изображением водородных связей (пунктир). Непрозрачным показан остов спирали, остальное - боковые цепи
Данная спираль состоит из 20 аминокислотных остатков, включающих в себя 165 атомов. Как видно из рисунка 2, спираль является правой, так как от N-конца к C завивается против часовой стрелки. Правые α-спирали наиболее распространены. Необычным является поворот спирали на остатке глутаминовой кислоты, что отражается в нарушении закономерности расположения водородных связей (см. таблица 1).
Таблица 1. Связь между парами номеров аминокислотных остатков атомов остова спирали, образующих водородные связи
Донор (О) |
Акцептор (N) |
250 |
252 |
250 |
254 |
251 |
255 |
252 |
256 |
253 |
257 |
254 |
258 |
255 |
259 |
256 |
260 |
257 |
261 |
258 |
262 |
259 |
263 |
260 |
264 |
264 |
267 |
265 |
268 |
Как видно из таблицы 1, в норме кажый кислород CO-группы связан с через водород с азотом NH-группы четвертого после него остатка.
β-лист
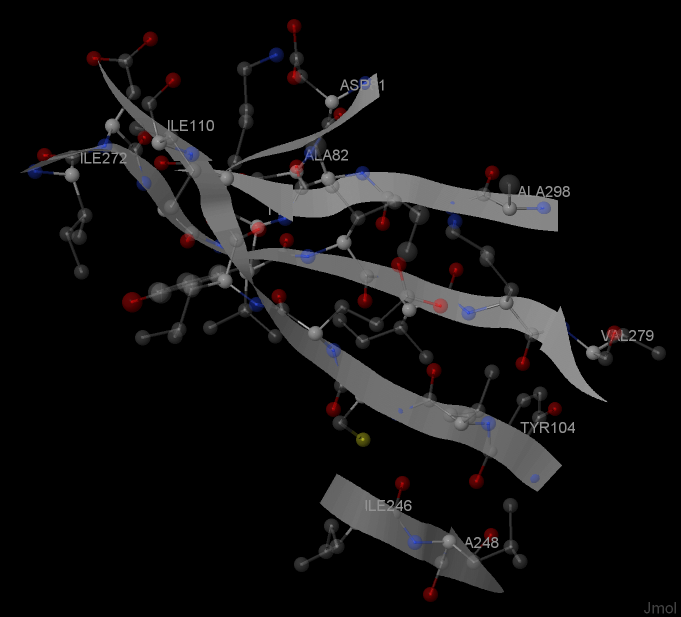
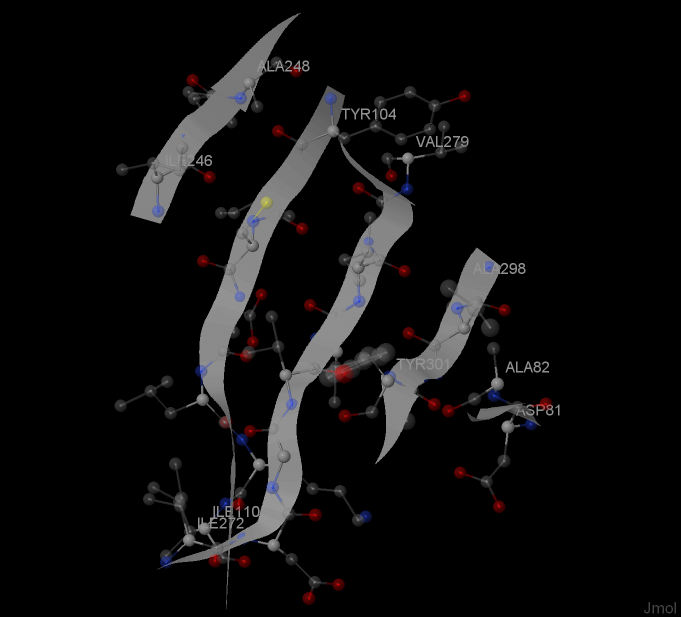
β-лист - несколько участков полипептидной цепи, связанных с боков остовными H-связями. Один из 4 β-листов LigA представлен на рисунках 3-5.
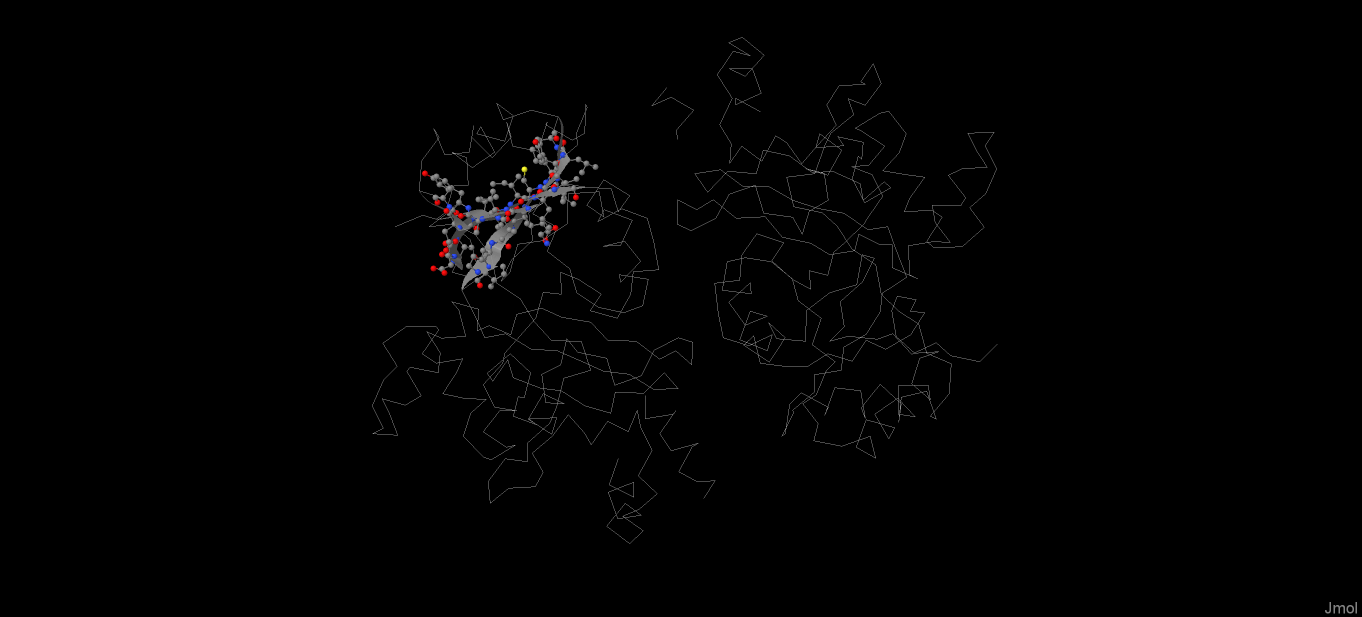
Рис. 3. Положение выбранного β-листа в белке LigA
|
|
Рис. 4. Цепи β-листа (с разных ракурсов)
Как видно из рисунка 4, все 5 цепей листа, за исключением одной крайней, состоящей из 2-х остатков, антипараллельны друг другу. Как и любой другой β-лист, этот имеет левое скручивание.
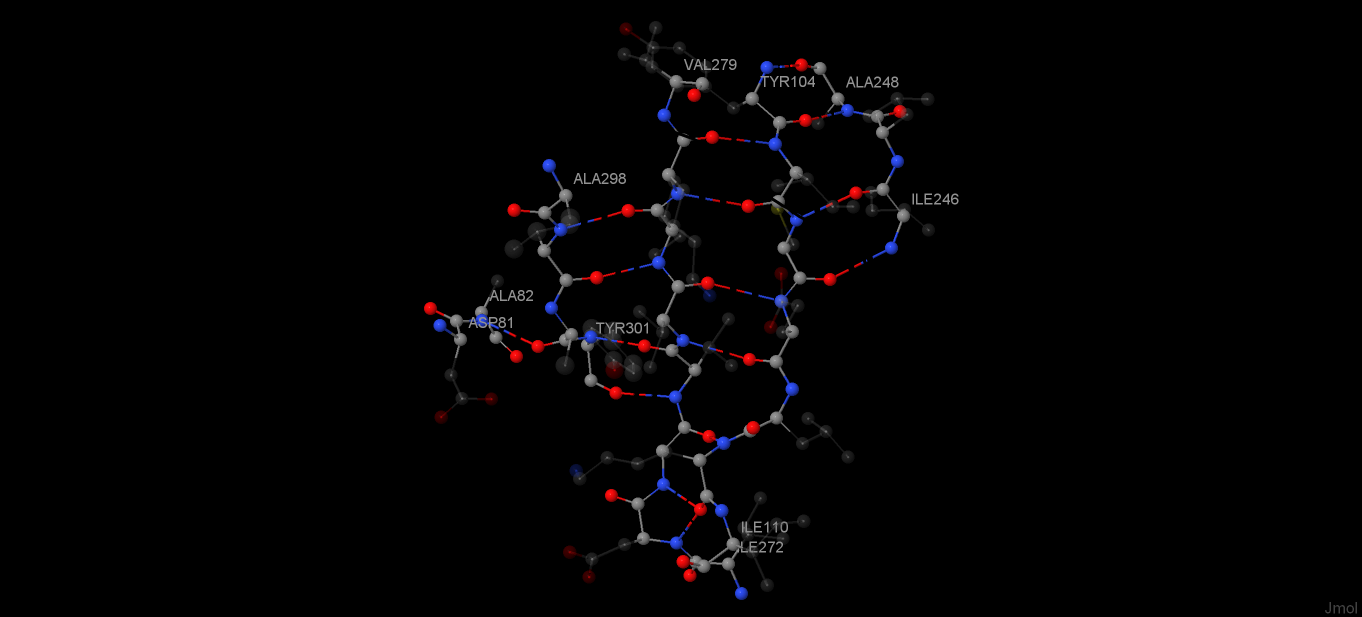
Рис. 5. Водородные связи в β-листе
Из рисунков 5 и 6 можно заключить, что, когда цепи β-листа антипараллельны, водородные связи перпендекулярны к осям цепей, а когда цепи параллельны - находятся к осям цепей под углом. Также ясно, что все CO- и NH-группы четных остатков в составе цепи β-листа образуют водородные связи с другой цепью по одну сторону от данной, а нечетные - по другую сторону (разумеется, при наличии рядом с данной цепью другой).
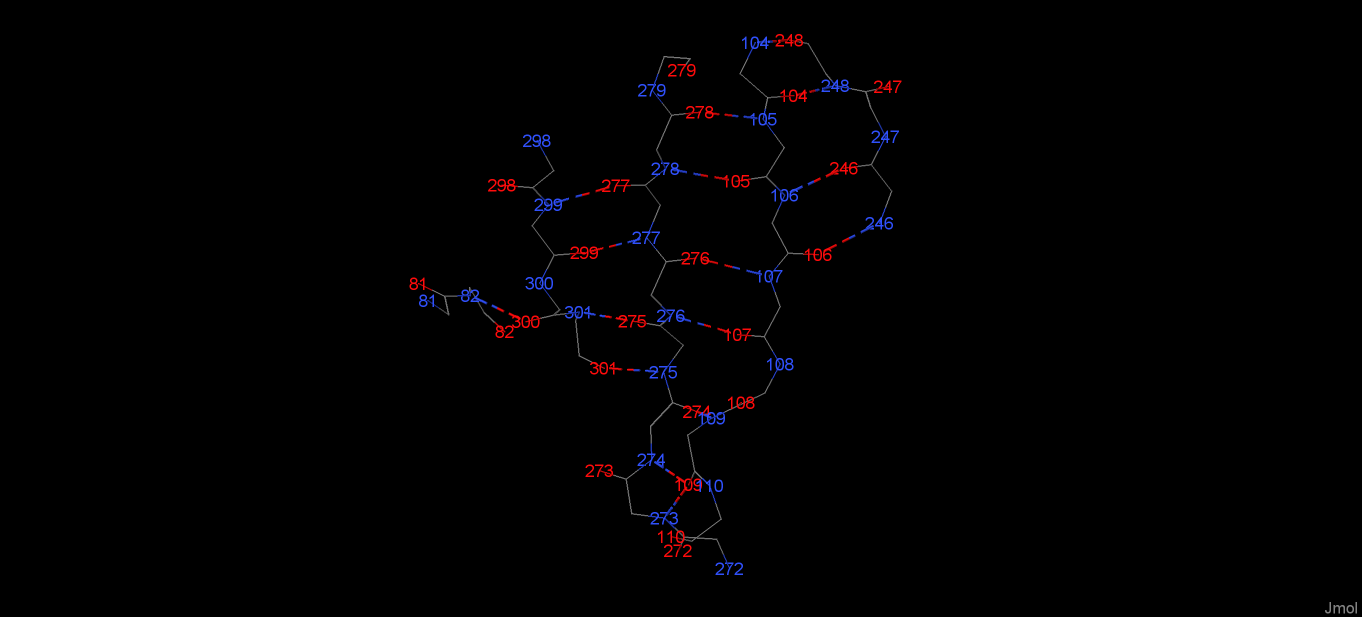
Рис. 6. Номера аминокислотнх остатков, атомы которых участвуют в образовании остовных водородных связей
© Дарья Горбачева | изменено 8.08.2014 |