| Главная страница | Семестры | О себе | Ссылки |
Структуры белка
Ряд структур в PDB (в основном, малые белки) решены как с использованием РСА, так и с использованием ЯМР. При этом структуры могут различаться, так кccus celer (он был в предложенной таблице из статьи),ак объектом для РСА является закристаллизованный белок, а для ЯМР - белок в растворе. Здесь схожесть структур оцкеивается по отдельным водородным связям.
В качестве исследуемого белка был выбран рибосомальный L30 из Thermococcus celer, для него в PDB есть структуры на основе РСА (1H7M, разрешение 1.96 Å) и на основе ЯМР (1GO0, 10 моделей).
Для того, чтобы убедиться, что модели в целом похожи, я построила пространственное выравнивание, используя команды ниже. Действительно, две структуры соответствуют одной и той же структуре (на рисунке 1). Также видно, что разные модели из ЯМР-эксперимента немного отличаются, особенно по неструктурированным концам.
|
load 1h7m.pdb, xray load 1go0.pdb, nmr set cartoon_transparency, 0.6, nmr split_states NMR align xray, nmr |
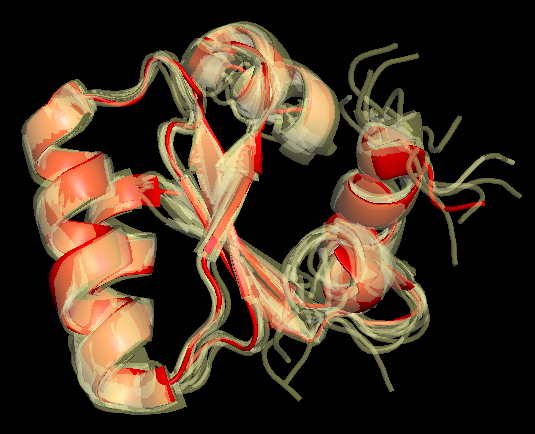
Рис. 1. Совмещение структур 1H7M (РСА, красный) 1GO0 (ЯМР, прозрачно-желтый)
Анализ водородных связей
Водородные связи искались как расположенные на не далее 3.5 Å атомы доноров и акцепторов водорода, исключая кислород воды. Использовались команды:
|
remove resn HOH dist hbonds, donors, acceptors, 3.5, mode=2 |
К сожалению, все водородные связи между боковыми цепями оказались только на поверхности (поиск при помощи задания ограничений: donors and not backbone, acceptors and not backbone), пришлось выбирать из них.
Из найденных для РСА-структуры связей я выбрала три:
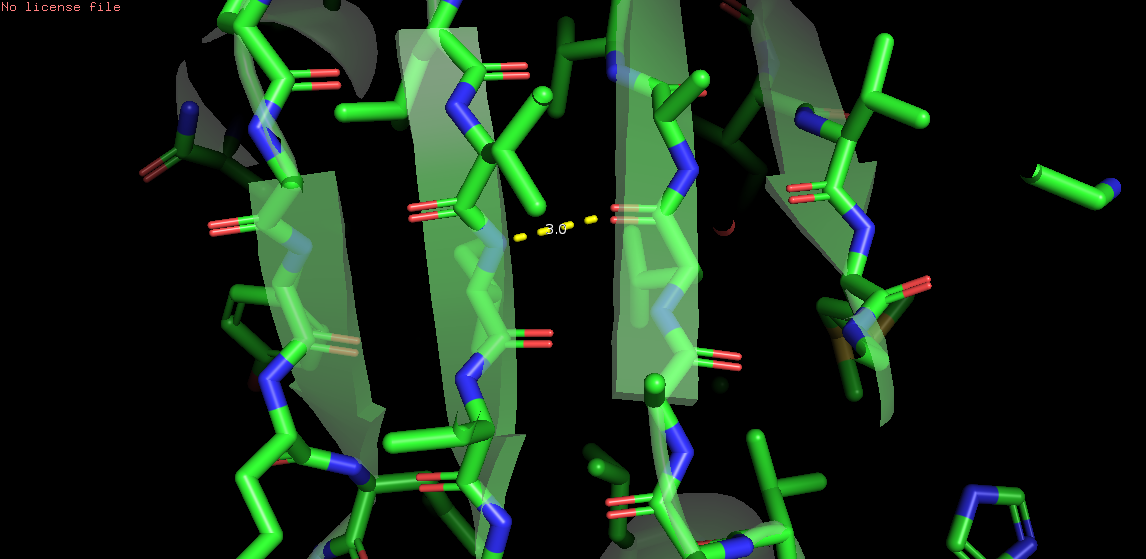
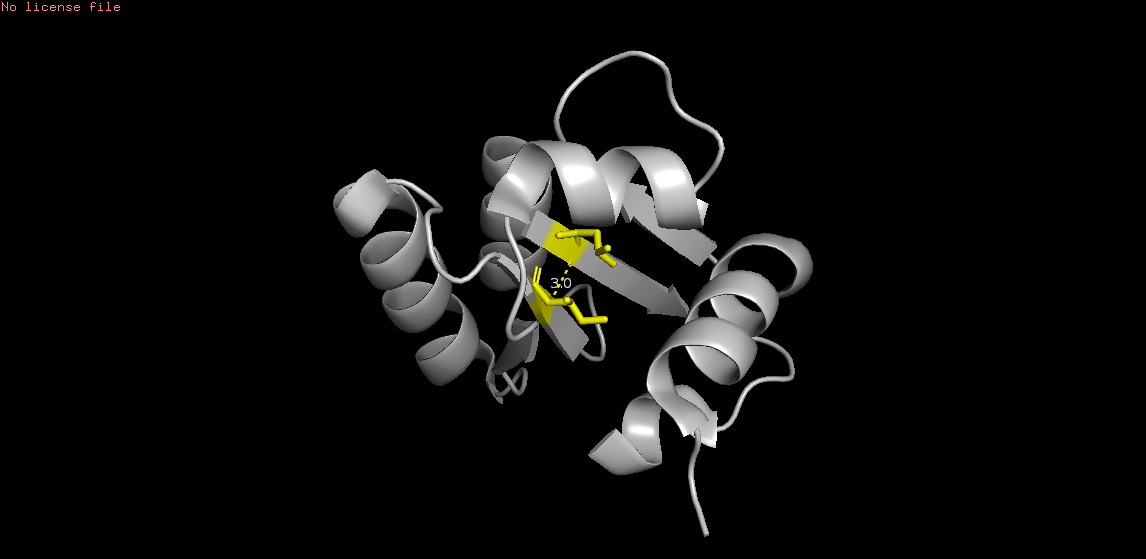
Остовная связь в ядре (в β-листе): O Leu83 и N Ile36 (на рисунке 2)
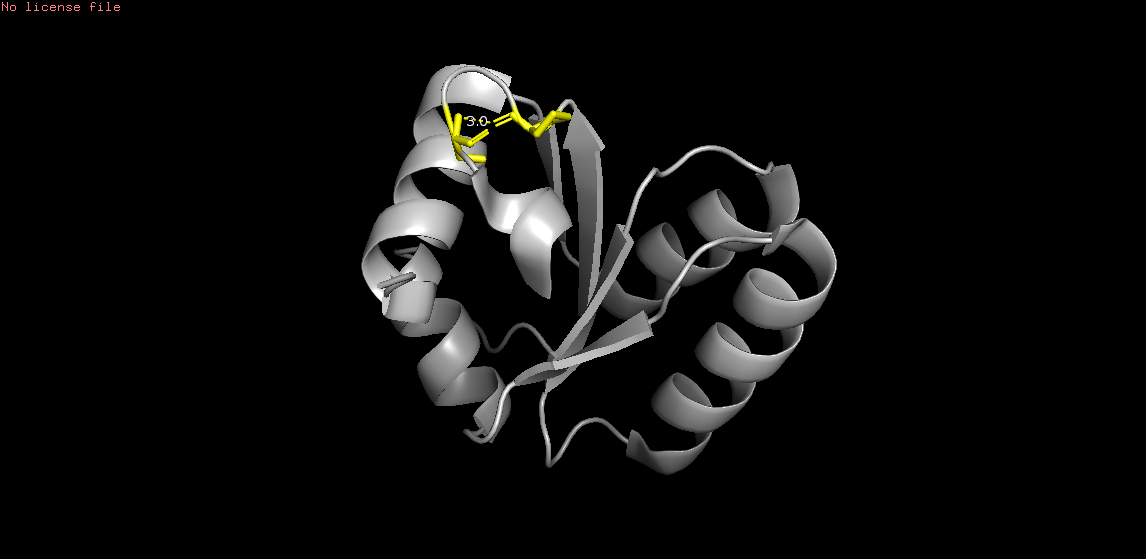
Остовная связь в петле: O Pro88 и N Ser91 (на рисунке 3)
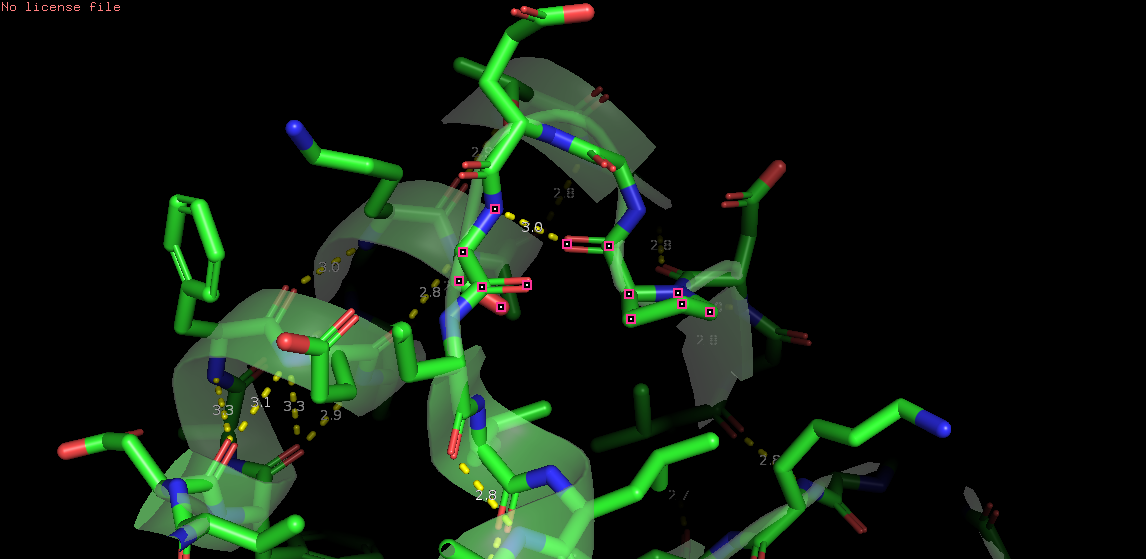
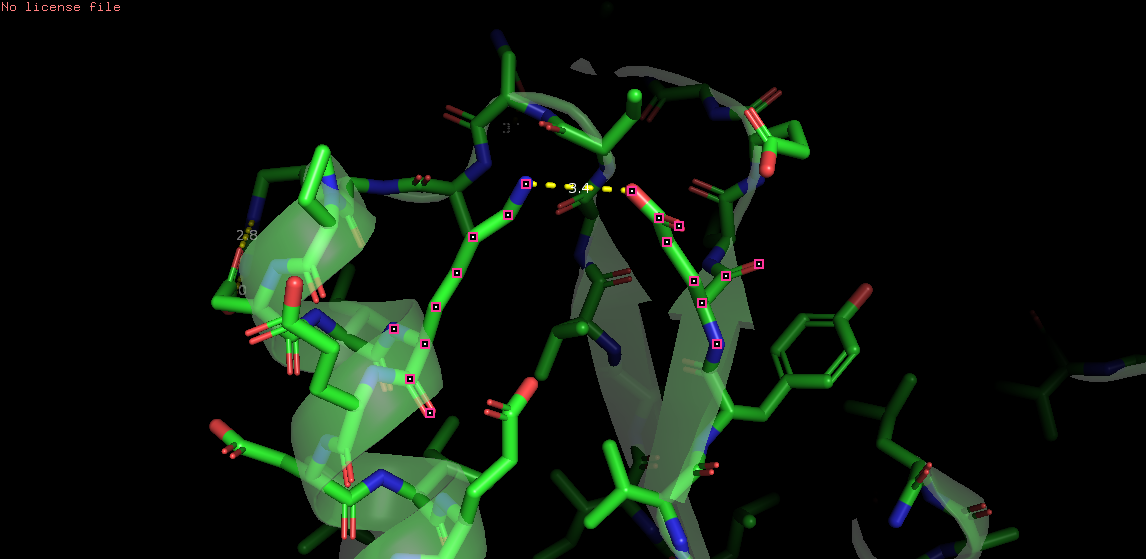
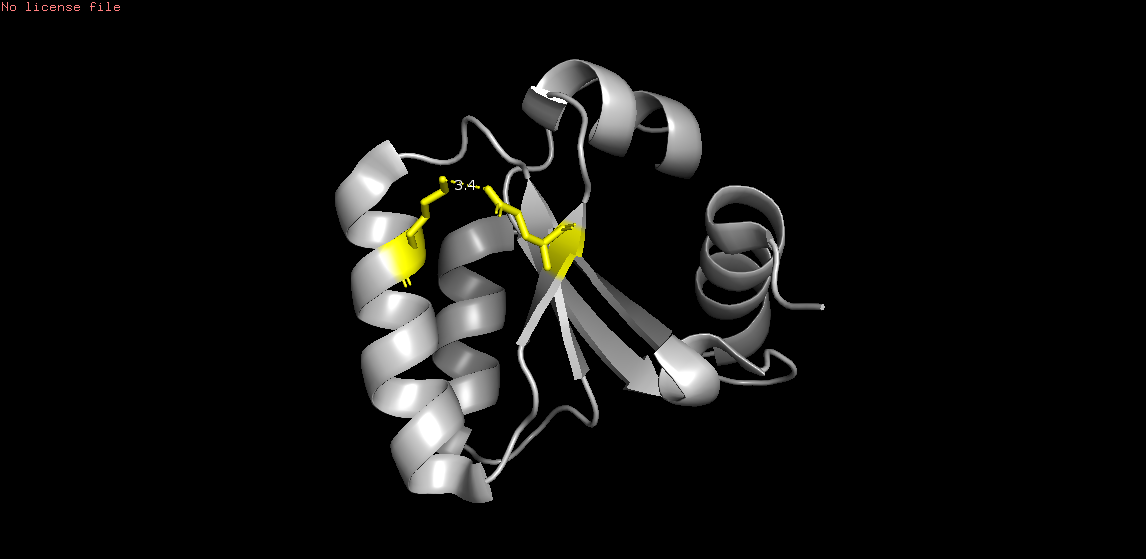
Cвязь между боковыми цепями: OE2 Glu62 и NZ Lys46 (на рисунке 4)
|
|
|
Рис. 2. Связь O Leu83 и N Ile36. Остатки помечены точками слева, желтым цветом справа
|
|
|
Рис. 3. Связь O Pro88 и N Ser91. Остатки помечены точками слева, желтым цветом справа
|
|
|
Рис. 4. Связь OE2 Glu62 и NZ Lys46. Остатки помечены точками слева, желтым цветом справа
Были посчитаны расстояния между связанными водородной связью атомами в РСА-структуре и всех ЯМР-моделях, информация в таблице 1.
Таблица 1. Сравнение водородных связей
Водородная связь |
РСА |
ЯМР |
|||
d (Å) |
dmin (Å) |
dmedian (Å) |
dmax (Å) |
% |
|
O Leu83 и N Ile36 |
3.0 |
1.8 |
1.8 |
2.0 |
100 |
O Pro88 и N Ser91 |
3.0 |
2.3 |
2.55 |
2.9 |
60 |
OE2 Glu62 и NZ Lys46 |
3.4 |
1.6 |
1.7 |
2.4 |
50 |
Стабильной оказалась только остовная связь в β-листе. Это понятно, поскольку элементы вторичной структуры белка стабильны, сохраняются при кристаллизации. Две другие связи есть не во всех ЯМР-моделях, но интересно, что они не принимают пограничные значения длины (около 3.0-3.5, когда неясно, есть ли связь на самом деле): связь либо точно есть, либо ее точно нет. Это может указывать на динамическое равновесие наличия водородной связи, то есть что связь иногда разрывается, иногда образуется.
© Дарья Горбачева | изменено 11.12.2017 |