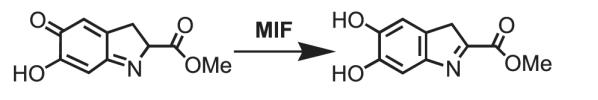
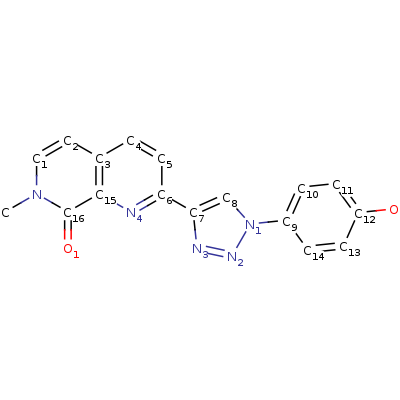
1. Таутомерия метил-дофахромного эфира [4]
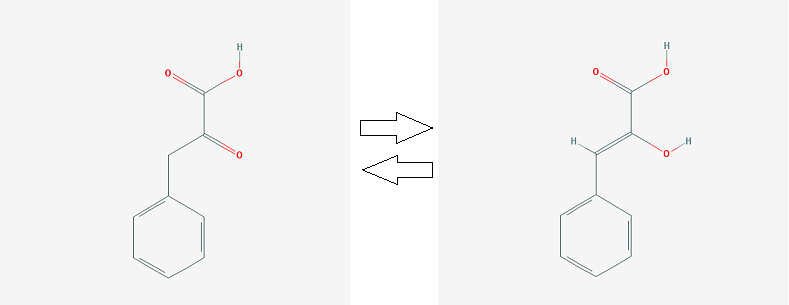
2. кето-фенилпируват <=> енол-фенилпируват (реакцию катализирует MIF)
Изучение контактов в комплексе ингибиторного фактора миграции макрофагов с нафтиридиноновым ингибитором (pdb id = 6B1K)
Введение
Ингибиторный фактор миграции макрофагов (Macrophage migration inhibitory factor, MIF) относится к провоспалительным цитокинам, играет важную роль во врождённом иммунитете к бактериальным патогенам и в воспалительных процессах (связывается с рецептором CD74, вызывая иммунный ответ), противодействует противовоспалительной активности глюкокортикоидов, катализирует некоторые реакции изомеризации (известен как фенилпируват таутомераза и L-дофахром таутомераза) [1].

1. Таутомерия метил-дофахромного эфира [4]

2. кето-фенилпируват <=> енол-фенилпируват (реакцию катализирует MIF)
MIF экспрессируется в клетках эндотелия, макрофагах, а также в Т-лимфоцитах. Повышенный уровень данного белка наблюдается при некоторых неврологических заболеваниях (ревматоидный артрит, атеросклероз, болезнь Альцгеймера), есть работы о его роли в развитии раковых опухолей [2]. Идентификатор белка в базе данных UniProt: P14174. Белок состоит из трёх одинаковых субъединиц общей массой примерно 38,5 кДа. Каждая субъединица состоит из 114 аминокислотных остатков и включает в себя 2 антипараллельные альфа-спирали и четырёхтяжевой бета-лист.
Лиганды
Данный белок связан с восемью лигандами. Основными из них являются три молекулы C9G, выступающие в роли ингибиторов. Сульфат-ионы и глицерин, по-видимому, присутствовали в растворе в качестве дополнительных ингридиентов (2,1 М сульфат аммония описан в качестве одного из компонентов) и не несут функциональной роли.
 |
 |
 |
Информация о лиганд-биомолекулярных контактах
C9G
Лиганд 2-[1-(4-гидроксифенил)-1,2,3-триазол-4-ил]-7-метил-1,7-нафтиридин-8-он (C9G) выполняет роль ингибитора за счёт образования связей в активном центре молекулы [2] и исключает тем самым таутомеразную активность белка. C9G образует с белком 6 водородных связей (основной остаток белка, участвующий в этом взаимодействии - Lys32, помимо него - ещё Ile64 той же белковой цепи и Asn97 другой). В статье, посвящённой взаимодействию белка с рассматриваемым ингибитором [2], описан также стэкинг с остатками Tyr95, Tyr36 и Phe113, а также гидрофобные взаимодействия.
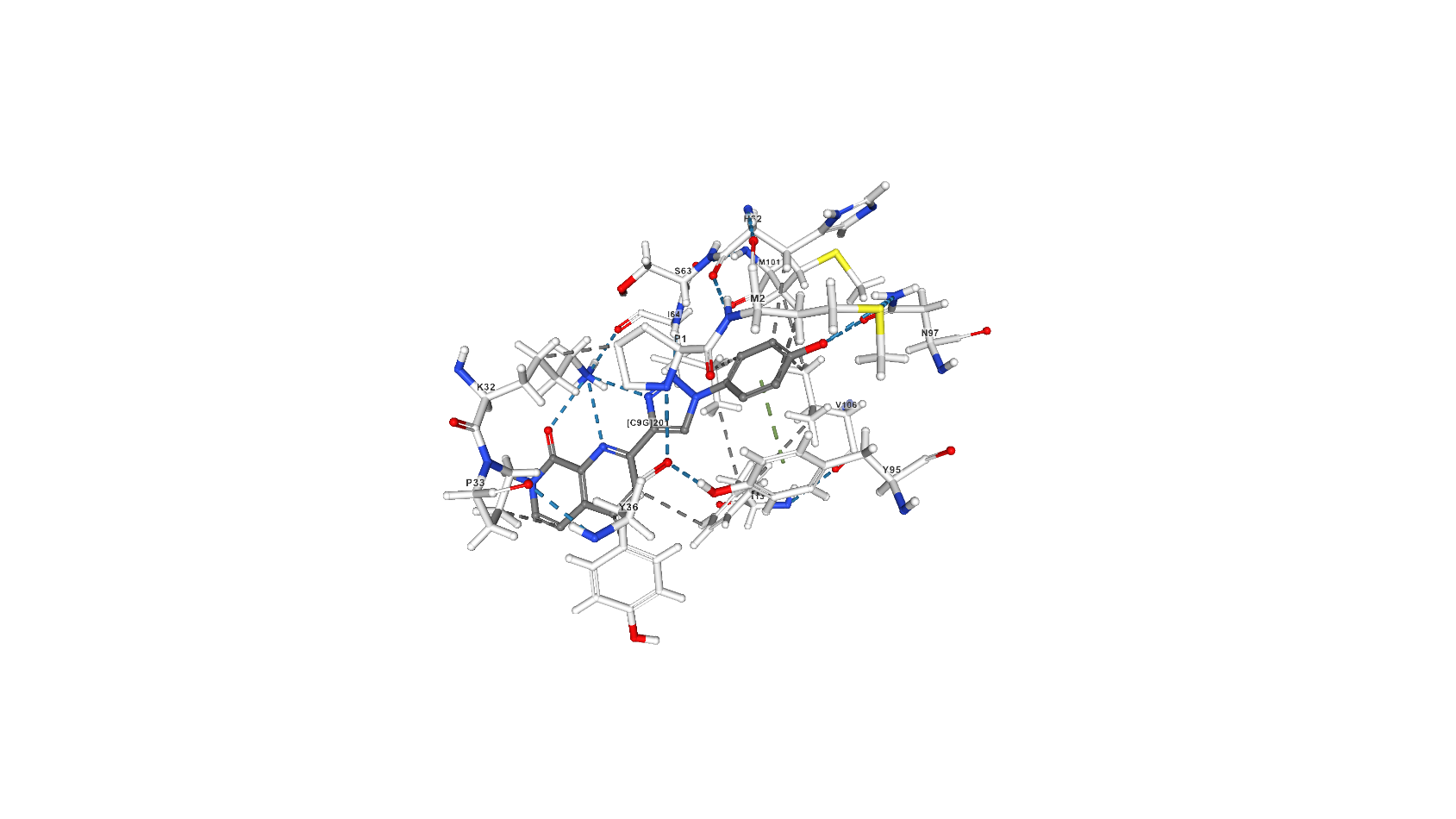
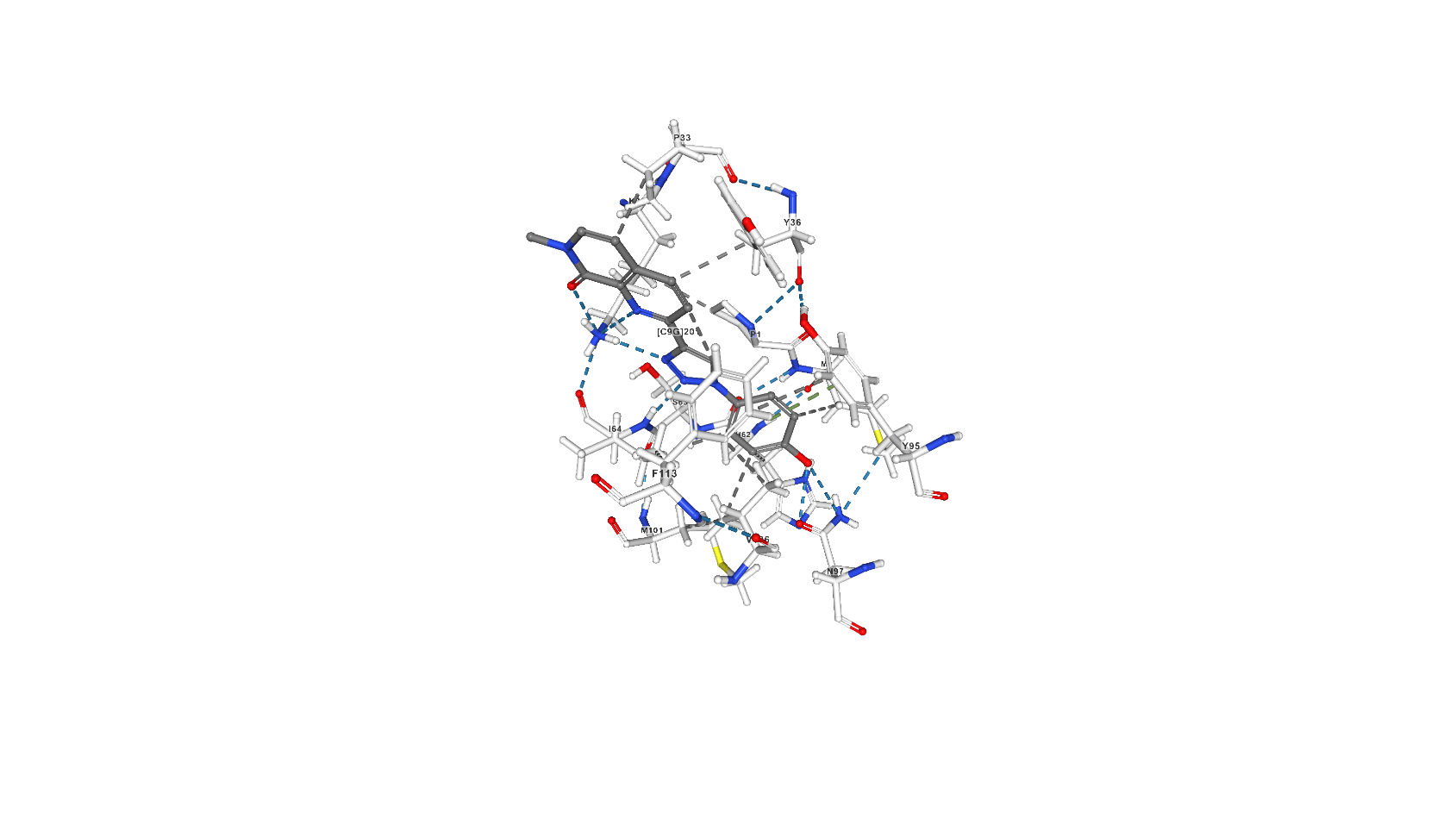
Скриншоты с изображением С9G на сайте pdb
GOL-лиганд
Тривиальное название - глицерин. Данный лиганд образует 2 водородные связи с [ASP]92 цепи A посредством двух атомов кислорода O :
[ASP]92:A.O (остовного атома кислорода) и [ASP]92:A.OD2 (бокового атома кислорода). Кроме того, глицерин образует водородные связи с водой
(4 связи). Другие типы связи у глицерина с молекулой белка не найдены.
SO4-лиганд
Белок связан с четырьмя сульфат-ионами. Рассмотрим подробнее лиганд [SO4]202 цепи А. Сульфат-ион связывается с белком лишь за счёт водородных связей. Два атома [SO4]202:A.O1 и [SO4]202:A.O4 связаны с молекулами воды,а два других - с белком, причем [SO4]202:A.O2 соединен с [ALA]70:A.H , а [SO4]202:A.O3 связан сразу с двумя атомами аминокислоты глутамина :[GLN]71:A.H и [GLN]71:A.HE21.
Апплет 1
Информация о белок-белковых контактах
Ковалентных связей между субъединицами обнаружено не было. Проверка на отсутствие дисульфидных мостиков проводилась при помощи команды "restrict Cys".
Водородные связи
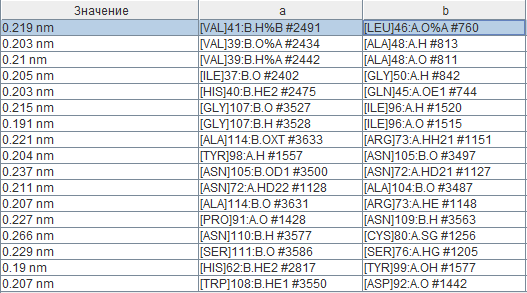
На данный момент удалось обнаружить 17 водородных связей между атомами цепей a и b. Как видно на изображении вторичной структуры, многие из них образуются за счёт наличия двух "смешанных" бета-листов, часть тяжей которых принадлежит цепи а и часть - цепи b. В остальных парах цепей взаимодействия практически идентичны, поэтому здесь они не рассматриваются. Поиск водородных связей производился следующим образом: при помощи команды "within" были найдены все такие остатки, атомы которых отстоят не более чем на 4 Ангстрем от атомов другой цепи. Длины водородных связей представлены в следующей таблице (названия колонок "а" и "b" не соответствуют названиям цепей). Средняя длина связи составляет 0,214 нм или 2,14 Ангстрем, что меньше, чем в среднем в альфа-спиралях и бета-листах (см. страницу с практикумом 1). Стоит отметить, что самая короткая из найденных водородных связей (0,19 нм) возникает между остатками гистидина (HE2) и тирозина (кислород OH-группы), что, видимо, обуславливается основными свойствами первого и слабыми кислотными свойства второго. Взаимодействие между остатками 45-50 одной цепи (бета3-тяж) и 37-42 другой (бета2-тяж) описано в литературе [3] как одно из ключевых для данного белка, отвечающее за поддержание его четвертичной структуры.
Гидрофобные контакты
На изображении, где более яркими цветами показаны гидрофильные аминокислоты, а более бледными - гидрофобные, хорошо видно, что части белка, ориентированные во внешнюю среду, представлены, по большей части, гидрофильными аминокислотами, а более внутренние - гидрофобными. Атомы гидрофобных остатков составляют около 60% от общего числа атомов белка. В качестве примера гидрофобного ядра рассмотрен Tyr 95 цепи A и его гидрофобное окружение. Гидрофобное взаимодействие начинает проявляться на расстоянии более одного Ангстрема. На расстоянии 5 и более Ангстрем окружение центрального остатка настолько плотно, что он становится слабо различим за соседними остатками. Среднее расстояние между двумя соседними ковалентно не связанными друг с другом атомами составляет, согласно выполненным измерениям, около 3,5 Ангстрем. Если пренебречь атомами водорода, то диаметр молекулы воды составляет 2,8 Ангстрем, что свидетельствует о том, что она между соседними атомами белка поместиться не может: расстояние 0,35 Ангстрем 0,5*(3,5-2,8) меньше длины ковалентной связи, на этом расстоянии действуют силы отталкивания атомных ядер, так что молекула воды вытолкнется из имеющегося промежутка.
Другой пример гидрофобного взаимодействия показан на С-конце (остатки 105-114, а именно [VAL]106, [GLY]107, [TRP]108, [PHE]113). Имеются данные о том, что удаление 105-114 остатков приводит к нарушению третичной структуры белка, потери им ферментативной активности, редукции функции активации макрофагов, но не влияет на связывание с рецептором (CD74) [3].
Солевые мостики
Обнаружено 10 солевых мостиков. Чаще всего связь наблюдается между остатками аргинина и глутаминовой кислоты. Солевые мостики выводились при помощи команды measure.
Апплет 2
Личный вклад:
Кирилл Цыганов подбирал белок, описывал физико-химические свойства лигандов, а также лиганд-белковые взаимодействия для глицерина и сульфат-иона, искал солевые мостики, создавал апплет для лигандов. Дарья Быкова описывала гидрофобные взаимодействия, водородные связи и взаимодействие с нафтиридиноном, а также оформляла html-страницу.
Ссылки на литературу:
1. http://www.uniprot.org/uniprot/P14174
2. Dawson, T.K., Dziedzic, P., Robertson, M.J., Cisneros, J.A., Krimmer, S.G., Newton, A.S., Tirado-Rives, J., Jorgensen, W.L. Adding a Hydrogen Bond May Not Help: Naphthyridinone vs Quinoline Inhibitors of Macrophage Migration Inhibitory Factor. ACS Med Chem Lett, 2017, 8: 1287-1291
3. Farah El-Turk, Bruno Fauvet, Amer Ashrafi, Hajer Ouertatani-Sakouhi, Min-Kyu Cho, Marilisa Neri, Michele Cascella, Ursula Rothlisberger, Florence Pojer, Markus Zweckstetter, Hilal Lashuel. Characterization of Molecular Determinants of the Conformational Stability of Macrophage Migration Inhibitory Factor: Leucine 46 Hydrophobic Pocket. PLoS One. 2012; 7(9): e45024.
4. Crichlow GV1, Cheng KF, Dabideen D, Ochani M, Aljabari B, Pavlov VA, Miller EJ, Lolis E, Al-Abed Y. Alternative chemical modifications reverse the binding orientation of a pharmacophore scaffold in the active site of macrophage migration inhibitory factor. J Biol Chem. 2007 Aug 10;282(32):23089-95. Epub 2007 May 25.
5. https://en.wikipedia.org/wiki/Macrophage_migration_inhibitory_factor
© Быкова Даша, 2018