В данном практикуме использовалась модель белка с pdbid 7BE3.
Задание 1. Альтернативные положения
Рассмотрим альтернативные конформации аргинина 144, а также их взаимодействия с соседними остатками. Конформаций только две, мне показалось более наглядным будет изобразить их на одной картинке.
fetch 7BE3
sele my_residue_A, resi 144 and alt "A"
sele my_residue_B, resi 144 and alt "B"
sele interact_res, resi 160+162
sele water1, resn HOH and resi 515
sele water2, resn HOH and resi 583
hide everything, solvent
hide cartoon
show licorice, my_residue_A + my_residue_B + interact_res + water1 + water2
sele alpha_C, name CA and interact_res
label alpha_C, "%s%s" % (resn, resi)
sele alts, name CD and my_residue_A | my_residue_B
label alpha_C, "%s%s" % (resn, resi)
set label_size, -0.4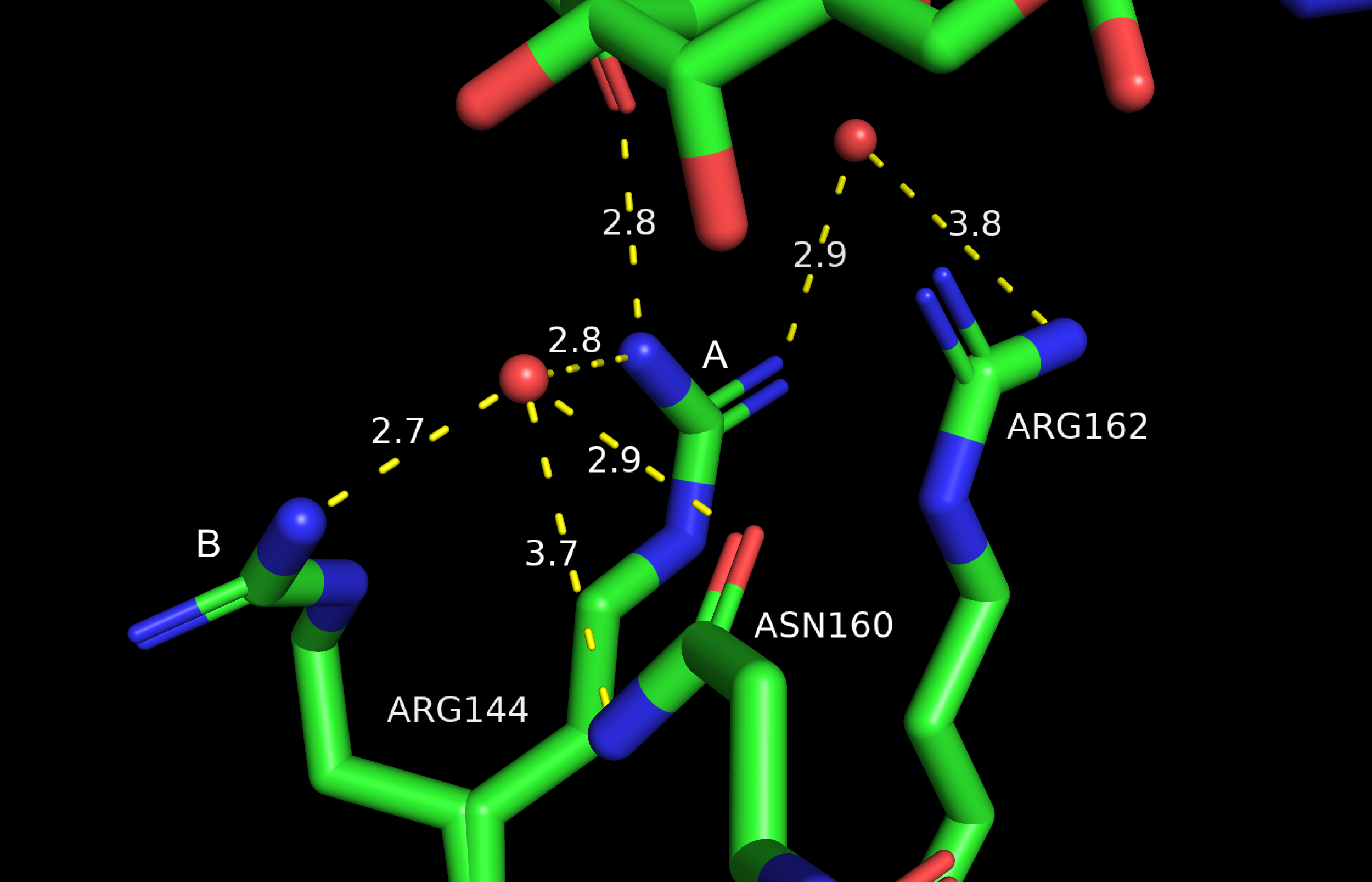
Аргинин в конформации А кажется более стабильным. Помимо взаимодействия с ASN 160 через воду (возможно там и напрямую происходит вз-ие, если аспарагин повернется немного ближе), возможно образование водородной связи с NGA (олигосахарид в 7BE3) и контакт с ARG 162 через воду. Хотя на структуре между водой и ARG 162 довольно большое расстояние – 3.8. Населенность альт-локов согласно записи в PDB 0.56 для A, 0.44 для В. Это согласуется с моими предположениями.
Pymol сессия: task1.pseЗадание 2. B-фактор
Скрываю воду, малые молекулы и cartoon для белка, визуализирую backbone с окраской по величине B-фактора. Атомы с низким значением будут покрашены синим, атомы с высоким – красным. B-фактор отражает степень неопределенности или подвижности атомов в кристаллической структуре, поэтому B-фактор выше у атомов ближе к поверхности белка. Полученное изображение подтверждает это.
fetch 7BE3
hide everything, solvent
hide everything, resn CL+GOL+NDG+NGA
hide cartoon
show sticks, 7BE3 and backbone
spectrum b, blue_white_red, backbone
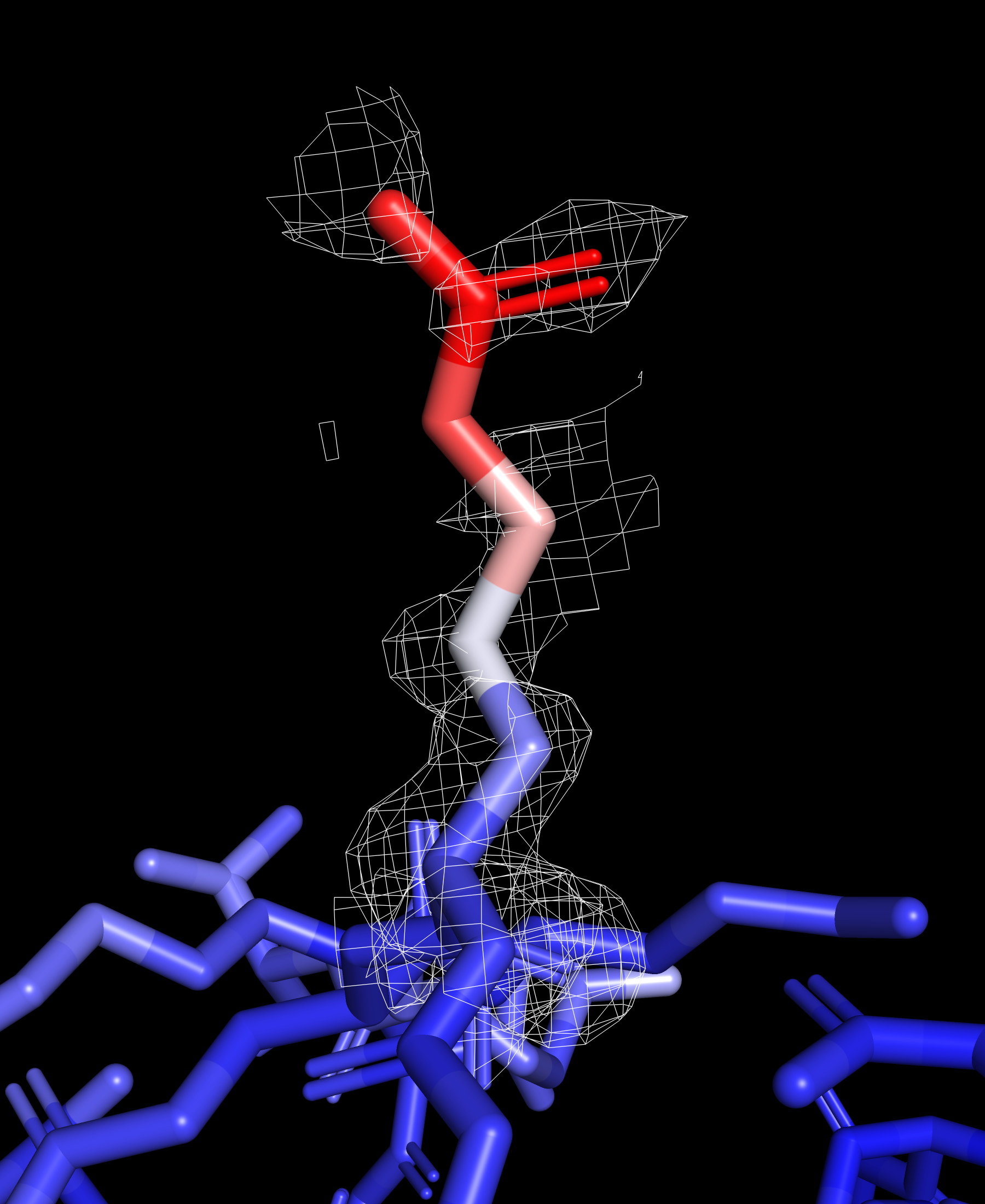
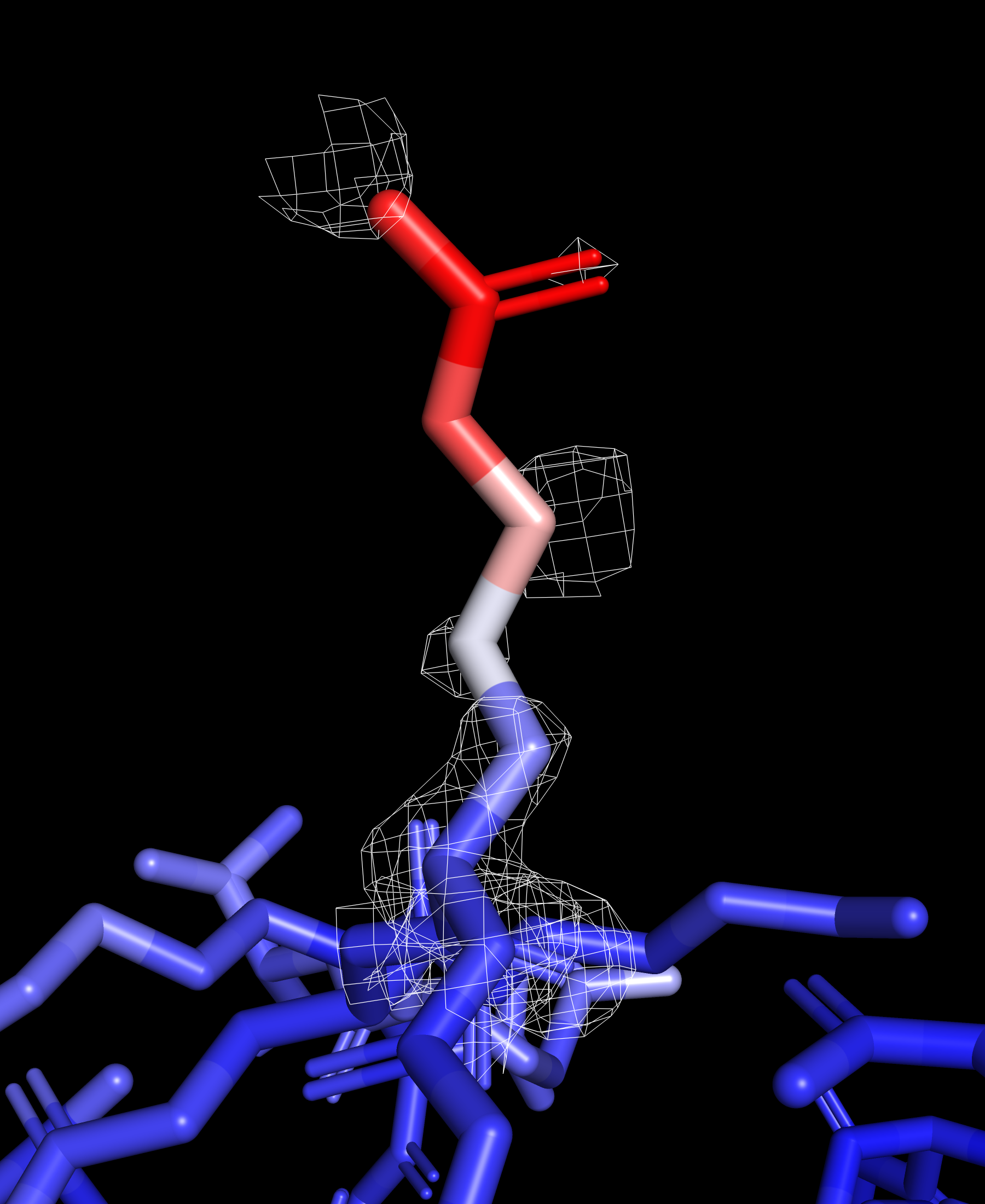
Рассмотрим отдельно ARG 183 и его электронную плотность, он расположен на поверхности и имеет высокий B-фактор.
show sticks, 7BE3
spectrum b, blue_white_red, 7BE3
sele resi 183
zoom sele
fetch 7BE3, type=2fofc
isomesh arg_mesh01, 7BE3_2fofc, 0.1, selection=sele, carve=1.5
isomesh arg_mesh05, 7BE3_2fofc, 0.5, selection=sele, carve=1.5
isomesh arg_mesh1, 7BE3_2fofc, 1, selection=sele, carve=1.5
isomesh arg_mesh2, 7BE3_2fofc, 2, selection=sele, carve=1.5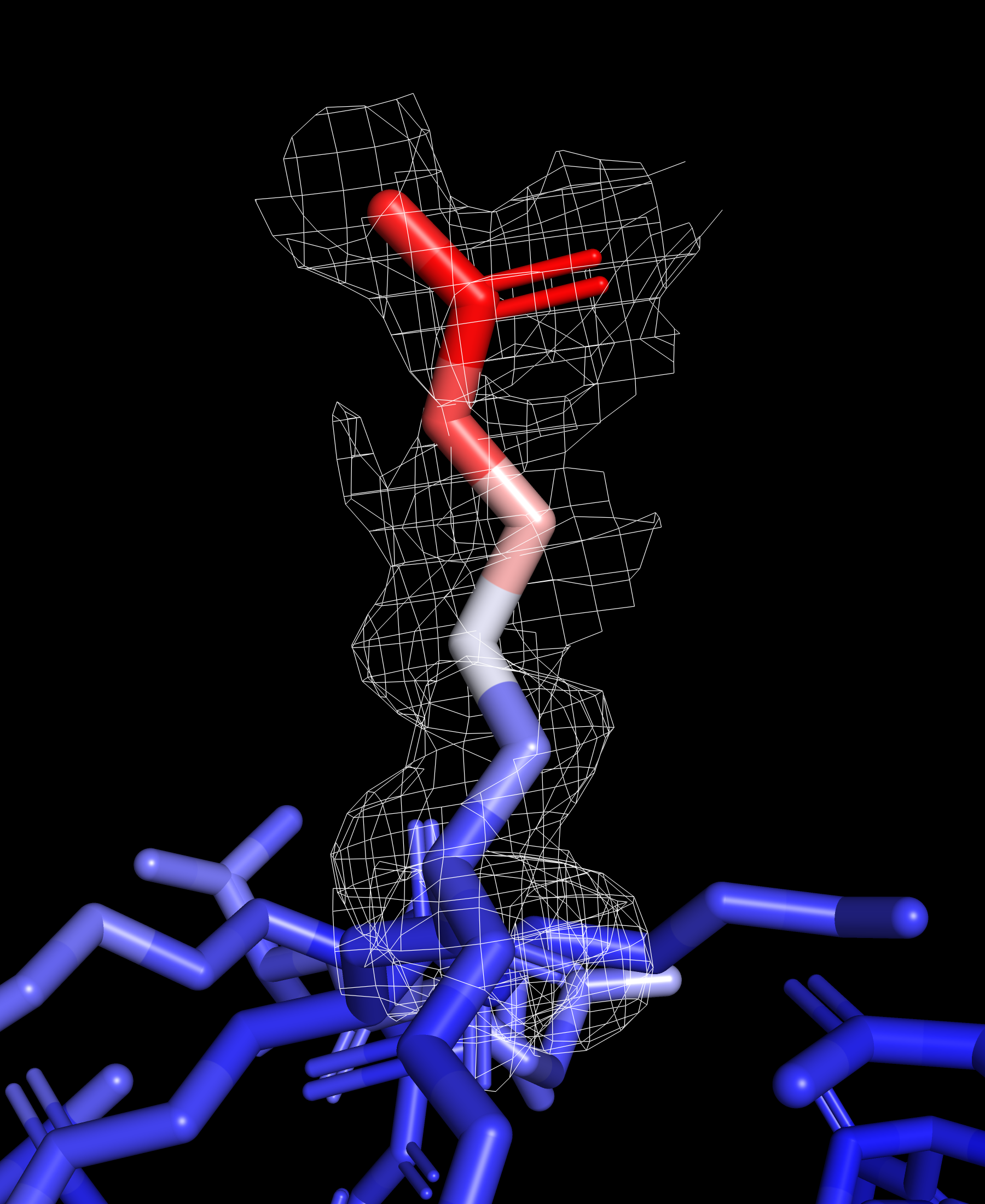 |
 |
 |
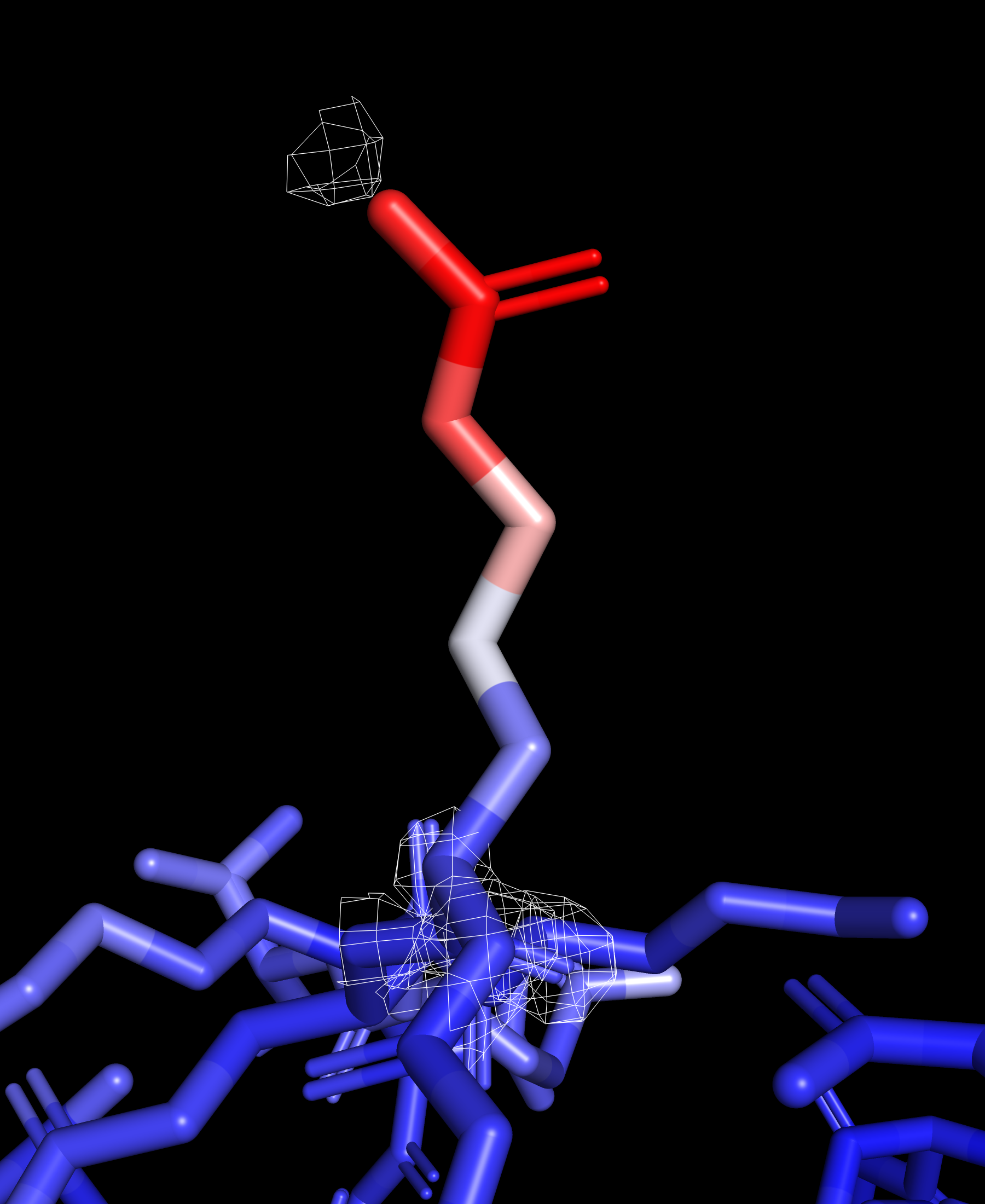 |
Атомы бокового радикала заметно краснеют к его окончанию, это говорит о большой термической подвижности данного остатка. Можно заметить, что электронная плотность снижается с ростом величины B-фактора рассматриваемых атомов.
Pymol сессия: task2.pseЗадание 3. B-фактор
fetch 7BE3
hide everything
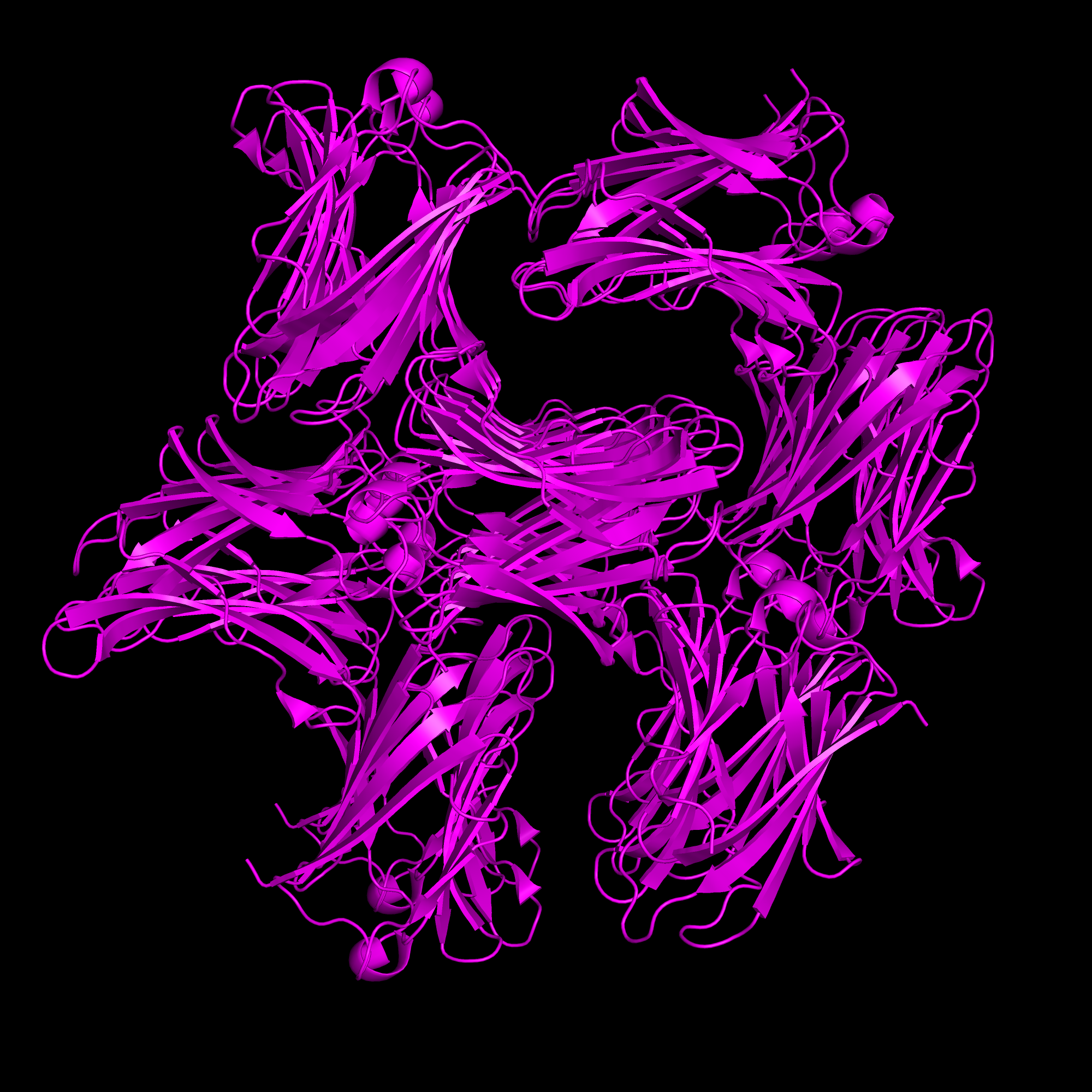
symexp sym, 7BE3, 7BE3, 5
group syms, sym*
show cartoon, all
color magenta
fetch 7BE3
hide everything
symexp sym, 7BE3, 7BE3, 6
group syms, sym*
show surface, all
spectrum count, rainbow
hide surface, sym03010000
hide surface, sym03010100
hide surface, sym02000100 #x
hide surface, sym02-10100
hide surface, sym01-10000
hide surface, sym01-100-1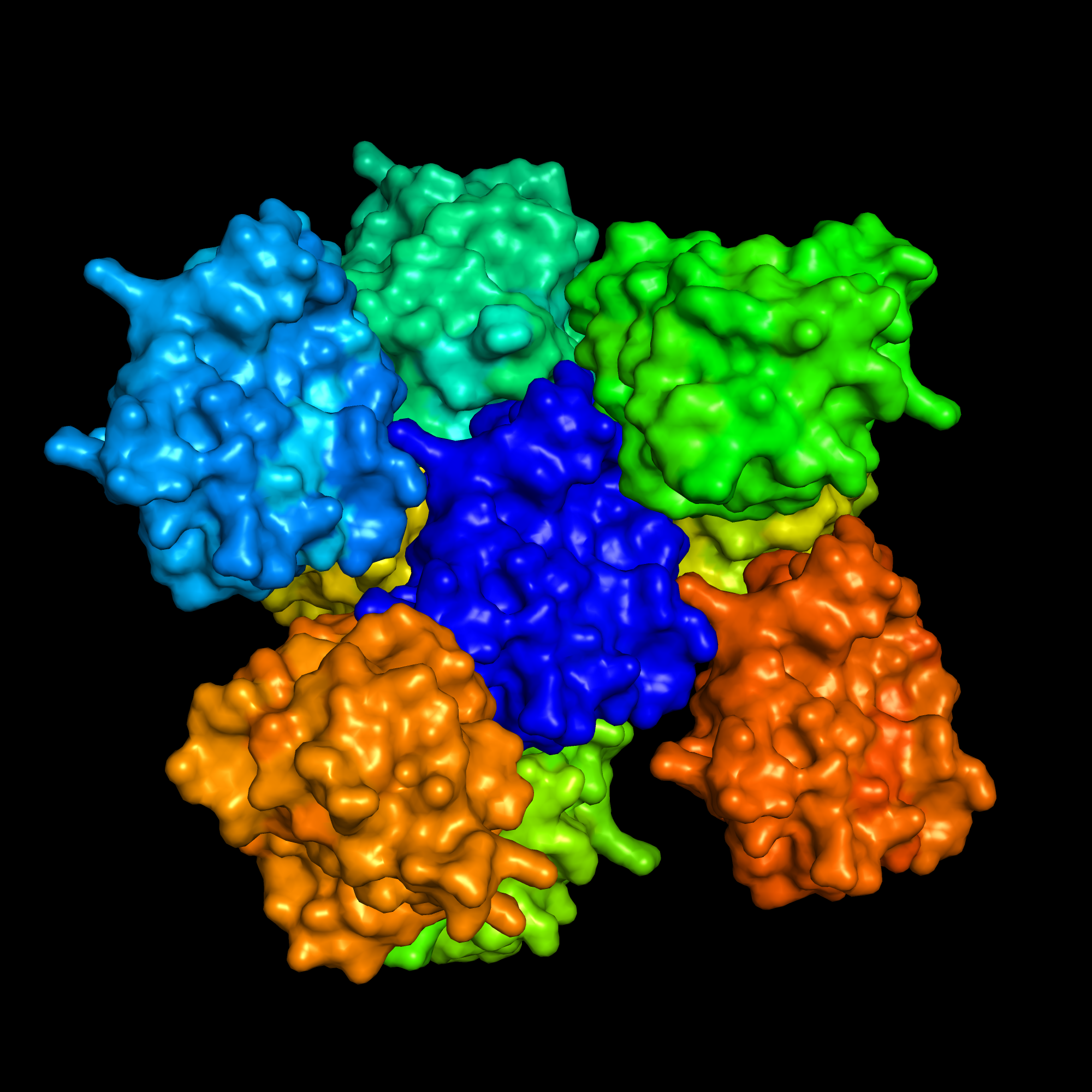
Структура непосредственно контактактирует с 8 соседями. Перепроверил еще раз, действительно 8. На глаз симметрия была бы лучше с 9 соседями. Структура sym02000100 точно не касается изначальной структуры, а её зеркальное отражение касается. Но может просто симметрия, которую я вижу, не верна.
Pymol сессия: task3.pse