Практикум посвящен предсказанию протонирования остатков атомной модели алгоритмом PROPKA (использовался веб-сервис PDB2PQR). Структура 5KHN получена в рентгеновском эксперименте в условиях кислой среды (согласно описанию в базе PDB — при рН 3.5). Для неё веб-сервис выдал структуру с протонами в формате .pqr и log-файл, содержащий таблицу предсказанных значений pKa.
Из таблицы для дальнейшего рассмотрения выбрал остатки Asp, Glu, His с самыми высокими pKa:
| Остаток, цепь | Предсказанный pKa | Стандартный pKa |
|---|---|---|
| Asp 344, A | 9.19 | 3.80 |
| Glu 761, B | 10.03 | 4.50 |
| His 90, A | 9.87 | 6.50 |
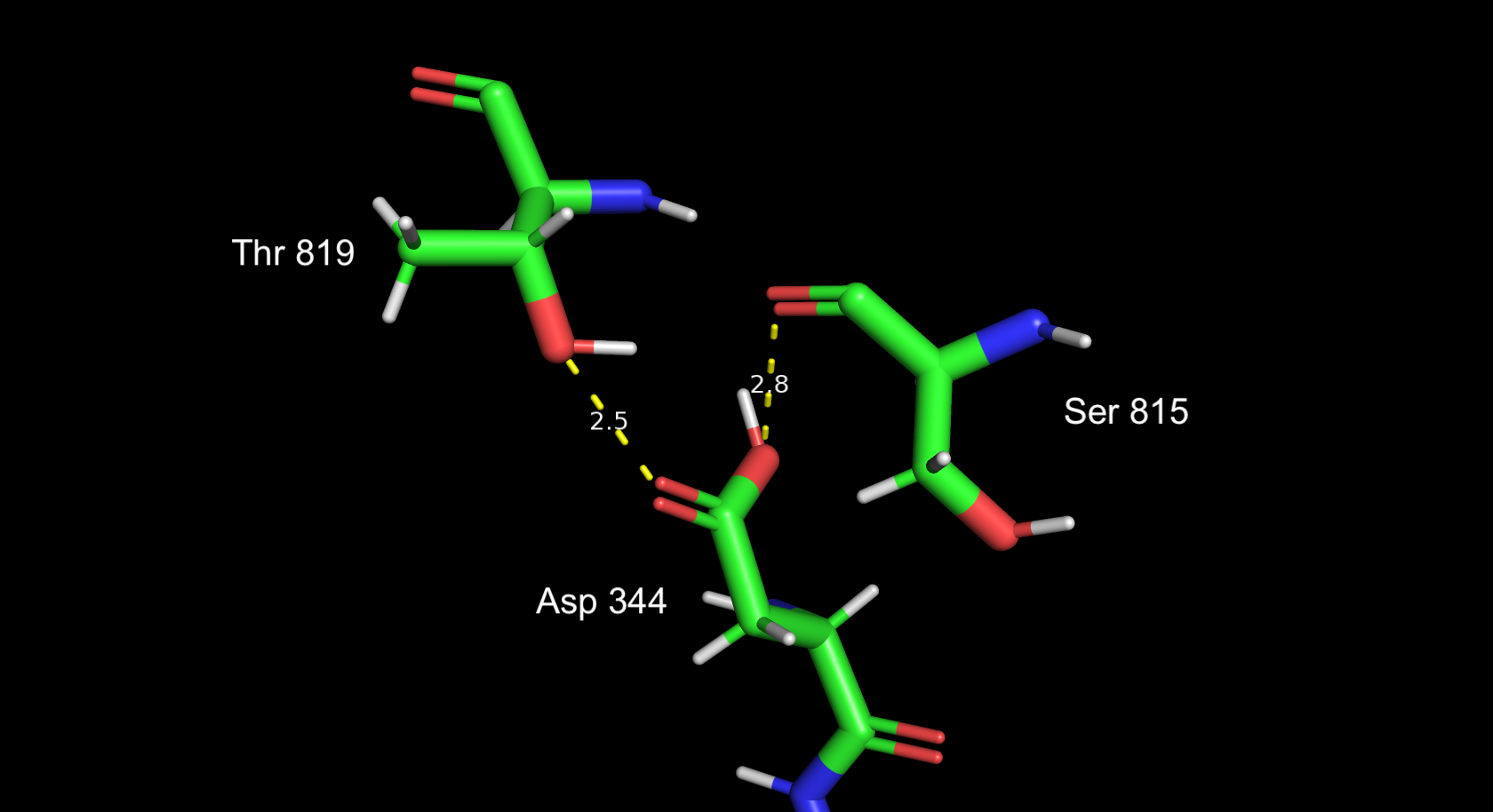
Визуализировал окружение аспартата в радиусе 3.5 ангстрем (средняя длина водородной связи, + 0.5А запас на погрешность). Думаю, протонирование верное, так как, во-первых, при таком рН карбоксильная группа аспартата преимущественно протонирована, во-вторых, можно заметить наличие соответствующих водородных связей. Но положение протонов не самое выгодное, они оба смещены относительно оси донор-акцептор. Хотя протон при треонине, видимо, расположен таким образом, чтобы участвовать еще и в водородной связи с серином (длина такой водородной связи 3.1 ангстрема)
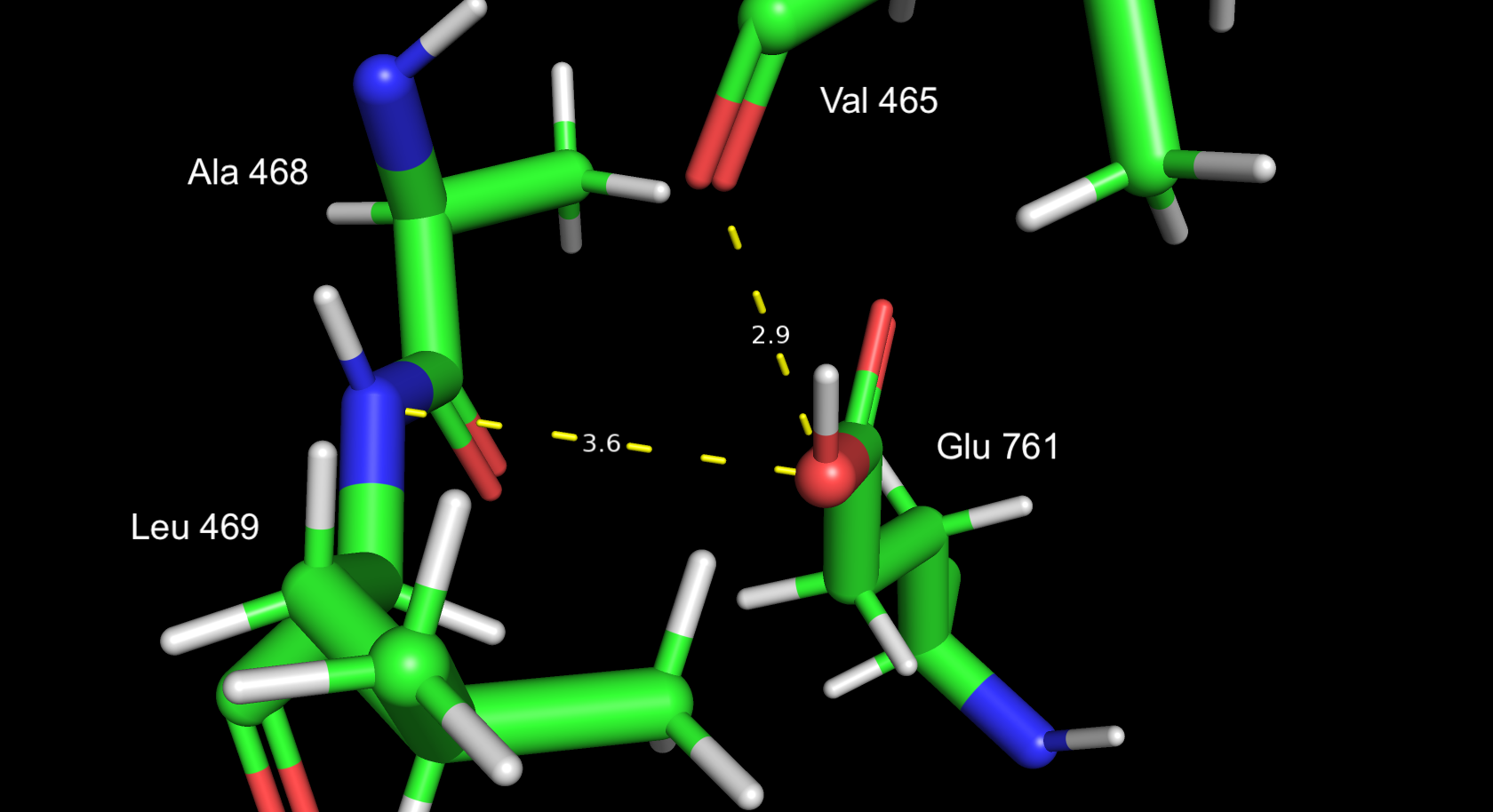
Протонирование глутамата тоже похоже на истину с поправкой на положение протона, он во всех случаях, что я наблюдал, располагается в плоскости карбоксильной группы.
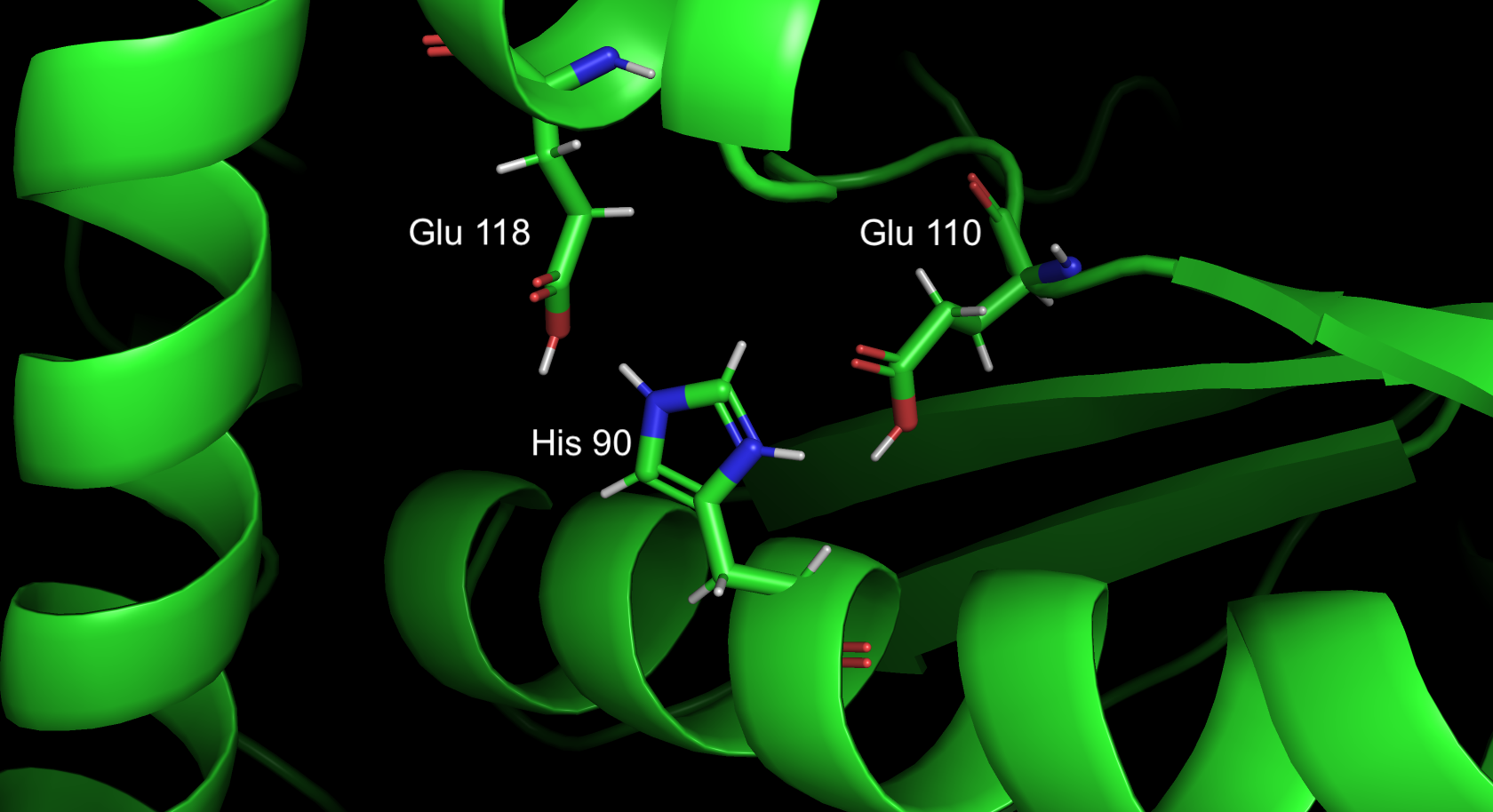
Гистидин протонирован и, следовательно, имеет положительный заряд, в окружении нет ничего отрицательно заряженного, что могло бы скомпенсировать заряд. Есть два глутамата, но они тоже протонированы. Но гистидин расположен на поверхности белка, то есть контактирует с растворителем, поэтому заряд вероятно более стабильный. Если гистидин потеряет протонирование, снизиться растворимость белка в воде и повысится аггрегируемость белков друг с другом из-за увеличения гидрофобной части на поверхности. Эти эффекты будут пренебрежимо малы, так как изменится всего одна аминокислота на поверхности