Внутримолекулярные взаимодействия в структуре 2D8L
Общая характеристика структуры 2D8L
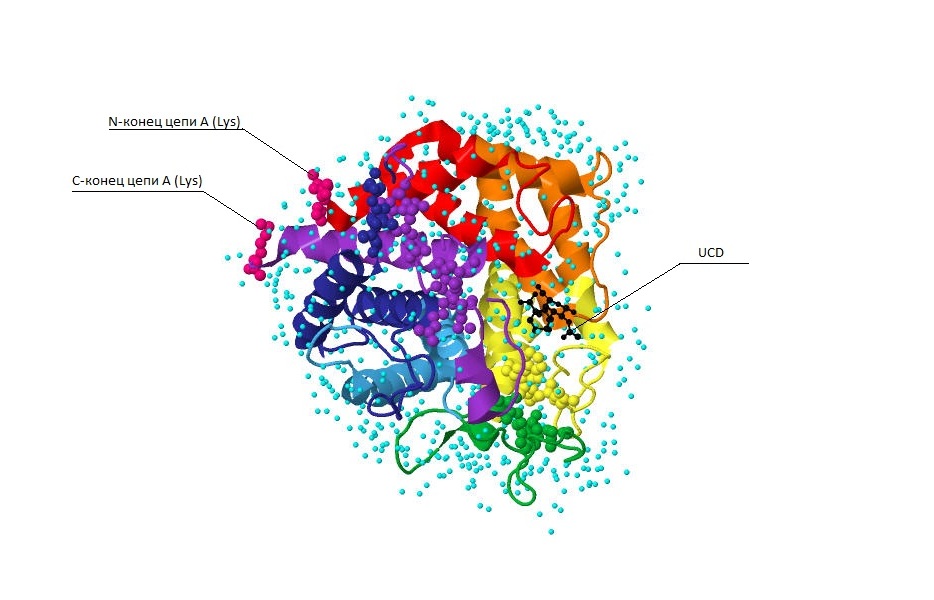
Общий вид структуры можно увидеть на рис.1, построенного с помощью программы JMol.

Рис.1 Вторичная структура и движение цепи белка 2D8L.Цветами выделена цепь А. От N-конца к С-концу цвета меняются в соответствии с цветами радуги, то есть от красного к фиолетовому. Молекула лиганда UCD выделена черным цветом, молекулы воды представлены в виде сфер голубого цвета. N- и С-конец представлены в виде аминокислоты лизин, который на схеме отображается как сферы розового цвета.
Анализ структуры альфа-спиралей и бета-листов в цепи A белка с кодом PDB 2D8L
Цепь А белка Putative glycosyl hydrolase yteR состоит из 17-и альфа-спиралей и 3-х бета-листов, каждый из которых состоит из двух антипараллельных бета-тяжей.
Рассмотрим одну альфа-спираль, состоящую из 18 аминокислотных остатков (номера с 162 по 180), и два бета-листа. На рис.2 показана позиция выбранной альфа-спирали и бета-листьев на цельной структуре цепи белка.
.jpg)
Рис.2. Белок с выделенными альфа-спиралью и бета-листьями. Красным цветом обозначена альфа-спираль, синим и желтым бета-листы, черным - лиганд. Цифрами указаны номера остатков начала и конца каждого из элементов (спирали и тяжей) с соответствующими аминокислотными остатками.
Рассмотрим альфа-спираль, состоящую из 18 аминокислотных остатков начиная с 162 по 180. В ней 5 витков(рис.3). Длина спирали составляет 27,08 ангстремов (рис.4). Используя эти данные, можно рассчитать следующие значения:
Шаг спирали рассчитывается как отношение длины спирали (в ангстремах) к числу витков, то есть 27,08 / 5 = 5,416 А.
Число остатков спирали, приходящихся на один виток, рассчитывается как отношение числа всех аминокислотных остатков, образующих данную спираль, к количеству витков, то есть 18 / 5 = 3,6.
.png)
Рис.3. Альфа-спираль цепи А.Спираль состоит из 5-и витков, каждый виток выделен цветом. Первый виток спирали окрашен в красный, последний в синий.
.jpg)
Рис.4. Исследуемая альфа-спираль цепи А белка 2D8L. Серая линия соединяет начало и конец спирали. Длина линии составляет 27,08 ангстрем, что соответствует длине спирали. Все цвета атомов соответствуют стандартным цветам их химических элементов, то есть углевод окрашен в серый, азот-синий, кислород-красный, сера-желтый.
Остаток с номером n образует водородные связи с остатками с номерами n+4 и n-4, то есть остаток с номером 165 образует водородную связь с остатком с номером 169, или остаток с номером 176 с остатком с номером 180(рис.5).
.png)
Рис.5. Исследуемая альфа-спираль цепи А белка 2D8L. Все цвета атомов соответствуют стандартным цветам их химических элементов, то есть углевод окрашен в серый, азот-синий, кислород-красный, сера-желтый. Пунктирными линиями обозначены водородные связи между 165-м и 169-м остатками и между 176-м и 180-м.
Рассмотрим два бета-листа цепи А, каждый из которых состоит из двух бета-тяжей (рис.6). Один из бета-листов состоит из тяжей, в которые входят остатки 139-141 и 190-192 (на рис.6 изображены желтым цветом), другой состоит из тяжей, в которые входят остатки 316-318 и 324-326 (на рис.6 изображены синим цветом). Оба бета-листа являются антипараллельными. Это значит, что амидные связи полипептидных цепей противоположно направленные. Стрелками указано направление пептидной цепи от начала к концу.Данные бета-листы образуют вогнуто-выпуклую поверхность. Это можно заметить на рис.7 и рис.8.
.png)
Рис.6. Изображение бета-листьев цепи А белка 2D8L. Желтым цветом показаны бета-тяжи с остатками 139-141 и 190-192, синим цветом показаны бета-тяжи с остатками 316-318 и 324-326.Данные бета-листы образуют вогнуто-выпуклую поверхность.
.png)
Рис.7. Один из бета-листов состоит из тяжей, в которые входят остатки 139-141 и 190-192. Образует вогнуто-выпуклую поверхность.
.png)
Рис.8. Один из бета-листов состоит из тяжей, в которые входят остатки 316-318 и 324-326. Образует вогнуто-выпуклую поверхность.
Внутримолекулярные взаимодействия боковых групп белка в цепи А структуры 2D8L.
В цепи А белка 2D8L содержится всего 5 остатков цистеина. Дисульфидные мостики – это ковалентная связь между двумя атомами серы, входящими в состав аминокислоты цистеин. В анализируемой цепи атомы серы не образуют дисульфидные мостики, так как они расположены далеко друг от друга (рис.9).
.png)
Рис.9. Изображение цепи А белка 2D8L. Остатки цистеина показаны в виде сфер. Атомы углерода, кислорода, азота и серы окрашены в соответствующие цвета их химических элементов.
Солевые мостики образуются в результате взаимодействия отрицательно заряженных аминокислот (аспарагиновая кис-та и глутаминовая кис-та) с положительно заряженными (лизин, аргинин и гистидин). Длина солевого мостика не может быть больше 4А. Атомы, между которыми образуются солевые мостики в цепи А белка 2D8L, показаны на рис.10. На рис.11 и рис.12 показан солевой мостик между аминокислотными остатками с номерами 154 и 288. Его длина составляет 2,99 А.
.jpg)
Рис.10. Изображение белка 2D8L. Красным цветом выделены атомы кислорода отрицательно заряженных аминокислот, синим цветом выделены атомы азота положительно заряженных аминокислот. Расстояние между атомами азота и кислорода меньше 4А.
.jpg)
Рис.11.Солевой мостик между 154-м остатком аминокислоты Lys и 288-м остатком аминокислоты Glu. Атом кислорода окрашен в красный цвет, атом азота- синий.
.png)
Рис.12. Солевой мостик между 154-м остатком аминокислоты Lys и 288-м остатком аминокислоты Glu. Атомы углерода, кислорода и азота представлены в виде сфер и окрашены в соответствующие цвета их химических элементов.