Сравнение трех водородных связей в структурах белка, расшифрованных с помощью ЯМР и РСА
Для анализа были выбраны структуры куриного транспортного белка, связывающего жирные кислоты - Lb-FABP. Его длина - 125 аминокислотных остатка, данные по его структурам представлены в таблице 1.
Таблица 1. Сравнение структур РСА и ЯМР.
| PDB ID | Цепь | Кол-во моделей/Разрешение | |
| ЯМР | 1MVG | А | 10 |
| РСА | 1TVQ | А | 2.0 |
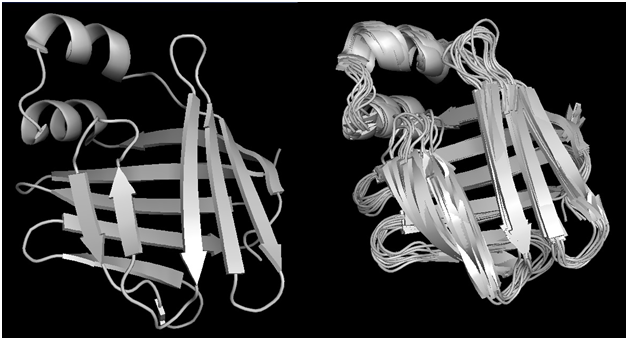
На рис.1 слева изображена структура, полученная РСА, а справа - 10 структур, полученных методом ЯМР. Можно заметить, что все вторичные структуры почти совпадают, а петли и концы варьируют в своей укладке.

Рис.1. Структуры белка FABP, полученные РСА(слева) и ЯМР(справа). Визуализация программой PyMol.
Анализ водородных связей
В качестве остовной водородной связи была выбрана связь между Gln41(N) и Val48(O) между бета-тяжами. Данные представлены на рис.2 и в таблице 2.
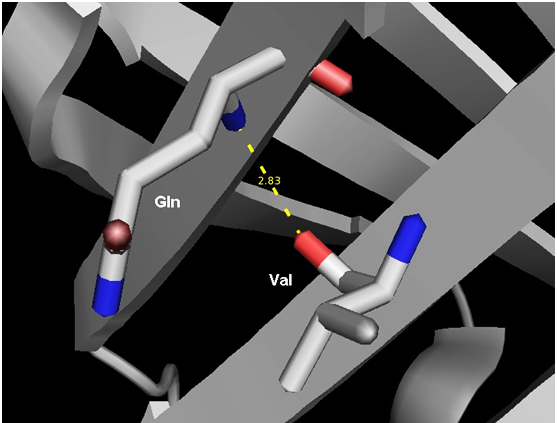
Рис.2.Структура белка FABP полученная методом РСА. Водородная связь между Gln41(N) и Val48(O). Визуализация программой PyMol
Затем для анализа водородной связи боковых цепей в ядре белка были выбраны остатки Lys92 и Ser97.Данные представлены на рис.3 и в таблице 2.
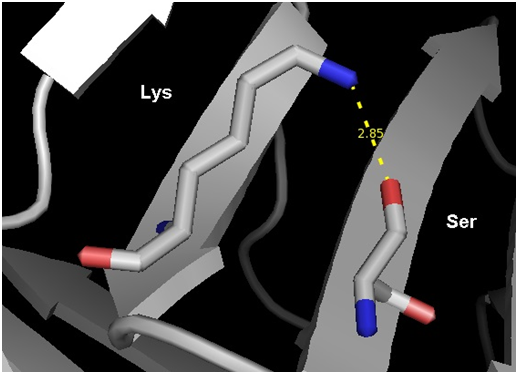
Рис.3 Структура белка FABP, полученная методом РСА. Водородная связь между Lys92 (NZ) и Ser97 (OG). Визуализация программой PyMol.
Далее в качестве водородной связи в петле на поверхности глобулы была выбрана связь между Lys76 (N) и треонином Thr72 (OG1). Данные представлены на Рис.4 и в Таблице 2.
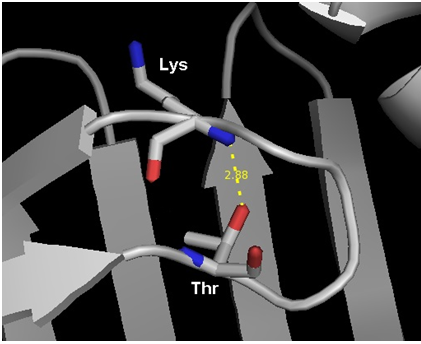
Рис.4. Рис.5 Структура белка FABP, полученная методом РСА. Водородная связь между Lys76 (N) и Thr72 (OG1). Визуализация программой PyMol.
Результаты по всем трем изученным водородным связям представлены в Таблице 2.
Таблица 2. Итоговые результаты сравнения структур, полученных с помошью ЯМР и РСА
| Где расположена водородная связь | Донор и акцептор электронов | Расстояние в РСА | Число моделей ЯМР, в которых есть связь | Min расстояние в ЯМР | Max расстояние в ЯМР | Med расстояние в ЯМР |
| Остовная водородная связь между бета-тяжами | Val48(O) и Gln41(N) | 2.83 | 5/10 | 2.01 | 3.15 | 2.84 |
| Между боковыми группами в ядре белка | Lys 92 (NZ) и Ser 97 (OG) | 2.85 | 0/10 | - | - | - |
| Между петлями на поверхности белка | Lys 76 (N) и Thr 72 (OG1) | 2.88 | 0/10 | - | - | - |
Таким образом, остовная водородная связь, присутствующая в структуре РСА, есть в половине структур ЯМР, это связано с тем, что элементы вторичной структуры очень стабильны. Однако петли белка и боковые группы отсутствовали в структурах ЯМР, что говорит об их нестабильности.