СТРОЕНИЕ БЕЛКА YokD |
Назад |
Идентификатор PDB: 2NYG
Английское название: SPBc2 prophage-derived aminoglycoside N(3')-acetyltransferase-like protein yokD
Русское название: SPBc2 профаговый аминогликозид N(3')-ацетилтрансферазоподобный белок yokD
Cокр.: yokD
Длина: 273 аминокислотных остатков
Количество цепей: 6 (A-F) (более подробно о белке)
Лиганды: COA (более подробно о лигандах)
Для проведения анализа структуры альфа-спиралей и бета-листов я выбрал командой restrict *A цепь A (фиг.1.1) в белке YokD. На фиг.1.2 показана эта же цепь белка, но с раскрашенными
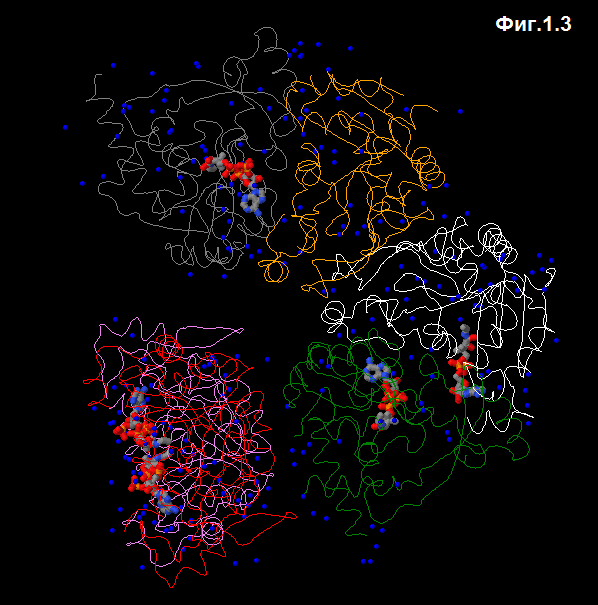
по цветам радуги участками так, что синий конец обозначает N-конец цепи, а красный ― C-конец. На фиг.1.3 показаны лиганды COA; в белке они присутствуют во всех цепях, кроме цепи F.
Синим обозначены молекулы воды.
 |
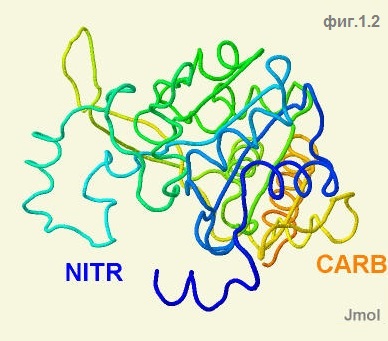 |
Cкрипт для фиг.1.2: restrict :a; cpk off; wireframe off; trace on; color group; select atomno=2113; label CARB; set fontsize 20; set labeloffset 40 0; select atomno=2; label NITR; set fontsize 20; set labeloffset -30 0 |
 |
||
Теперь с помощью команд:
select :a; trace on; select sheets and :a; trace off
select helix and :a; cartoons on; trace off; color red;
select sheets and :a; cartoons on; trace off; color orange
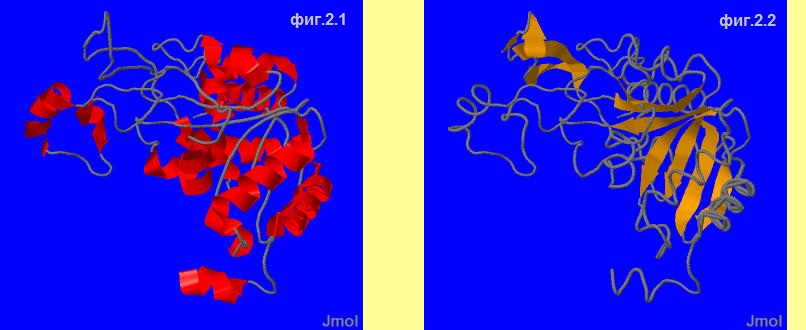
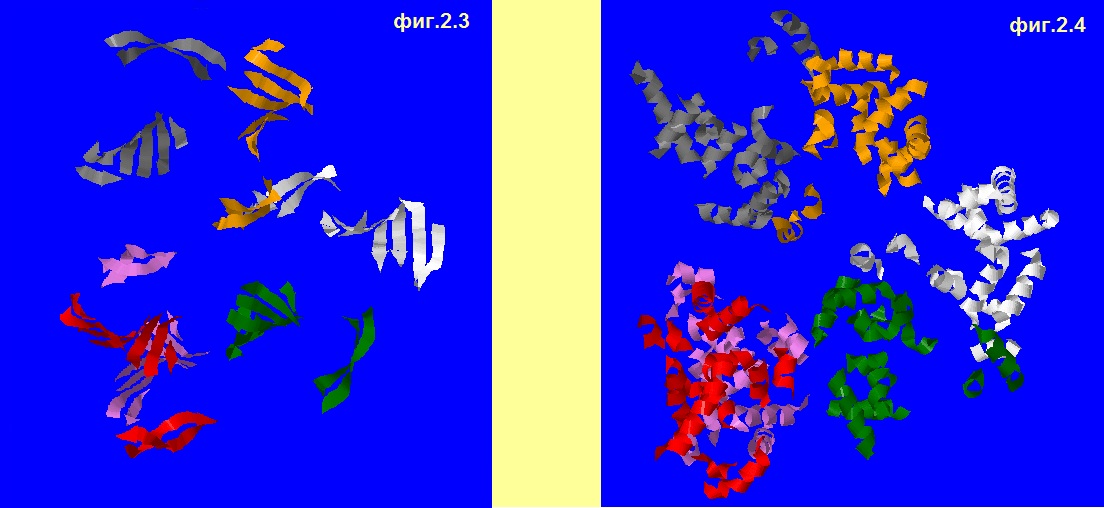
выделим сначала все альфа-спирали (фиг.2.1), а потом бета-листы (фиг.2.2) в цепи A. На фиг.2.3 показаны бета-листы во всём белке, а на 2.4 все ― альфа-спирали. Отметим, что на общей картине цепь А
покрашена в белый.
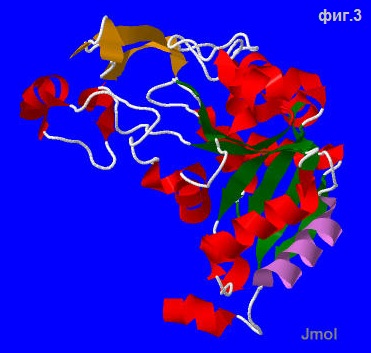
Теперь выберем спираль и лист для более глубокого рассмотрения. См.фиг.3
Отменим предыдущие две и применим команды:
select helix and *a; color red;
select sheets and *a; color orange
select 237-242 and *a; color green
select 64-69 and *a; color green
select 244-251 and *a; color green
select 170-174 and *a; color green
select 135-139 and *a; color green
select 31-37 and *a; color green
select 126-127 and *a; color green
select *a and 14-26;color violet
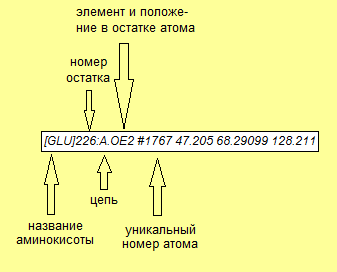
Две цифры, записанные через дефис ― адрес остатков начала и конца элемента. Чтобы узнать его, необходимо кликнуть по любому атому остатка, и в консоли
появится подробная информация о нём:
Можно также обратить внимание на то, что спирали и листы имеют на одном из своих концов стрелку ― это C-конец элемента. Конец без стрелочки ― N-конец.
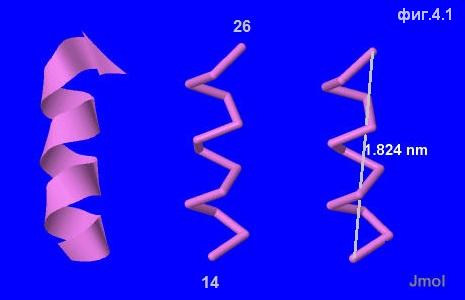
Выбранная нами спираль (фиг.4.1) совершает три полных оборота, и расстояние между остатками треонина (14) и глицина (26), находящихся на его концах, составляет
1.824 нанометра (=18.24 ангстрем), из чего можно заключить, что шаг спирали составляет примерно 0.6 нанометра (6 ангстрем). На каждый виток приходится по
четыре аминокислотных остатка.
Чтобы узнать расстояние между двумя атомами или остатками, нужно совершить двойной клик по одному элементу и протянуть появившуюся линию до другого элемента.
Чтобы выйти из режима измерения, снова кликните дважды
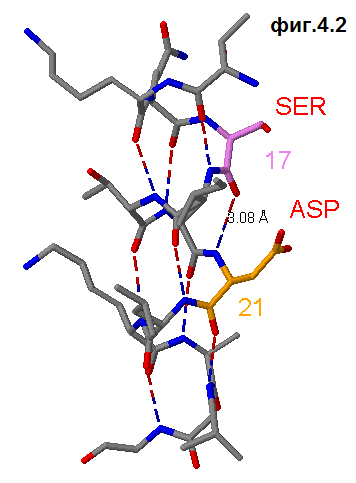
Для обнаружения водородных связей применяется команда calculate hbonds. Отобразим их в нашей спирали (см.фиг4.2). Водородные связи отмечены сине-красной прерывистой линией. Cтоит отметить,
что водородные связи образуются между остатками аминокислот, чьи номера отличаются на 4 (период спирали).
Скрипт для отображения водородных связей в спирали 14-26 цепи А:
restrict :a and 14-26; select :a and 14-26; wireframe 40; color cpk
select 17:a; color violet; select atomno=116; label SER;set fontsize 20
select 21:a; color orange;select atomno=144; label ASP;set fontsize 20
select :a and 14-26 and oxygen; color red
select :a and 14-26 and nitrogen; color blue
select :a and 14-26; calculate hbonds; hbonds 17
select atomno=112; label 17; set fontsize 20;set labeloffset 30 -1
select atomno=141; label 21; set fontsize 20; set labeloffset 0 -10
monitor 114 137
В цепи А рассмотрим также и бета-лист, состоящий из семи тяжей. Глядя на фиг.5 легко заметить, что некоторые тяжи расположены антипараллельно (то есть их C-концы и N-концы
разнонаправлены), а некоторые ― параллельно, и что лист выгнутый.

Известно, что части молекулы белка могут дополнительно скрепляться при помощи дисульфидных и солевых мостиков.
Дисульфидные мостики образуются только между цистеинами.
Для их обнаружения, применяется команда ssbonds. К сожалению, несмотря на наличие 12 цистеинов в белке, никакие двое из них не образуют дисульфидных связей. См.фиг.6
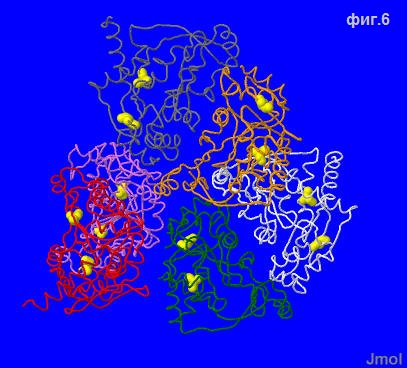 |
Скрипт для фиг.6: select all; cartoons off; trace on; trace 60; select cys; wireframe 400; color yellow; ssbonds 666 |
Про солевые мостики известно, что они образуются только между полярными положительно заряженными (лизин, аргинин, гистидин) и отрицательно заряженными (аспартат, глутамат) аминокислотами,
а если точнее, то между азотсодержащими частями первых и кислородсодержащими вторых, причём кислороды и азоты, находящиеся в радикале.
Применим ко всему протеину команду:
select glu;color brown; wireframe 50
select asp;color green; wireframe 50
select lys;color orange; wireframe 50
select arg;color yellow; wireframe 50
select his; color black; wireframe 50
select within (3.0, ((glu or asp) and oxygen and not within (2.5, *.CA))) and (nitrogen and (lys or his or arg) and not within(1.5 , *.CA)); cpk 370; color red
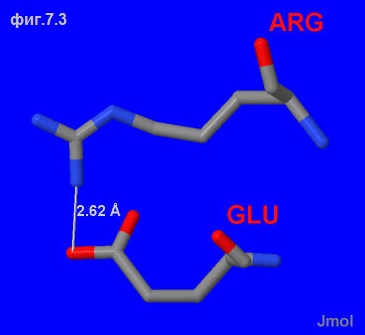
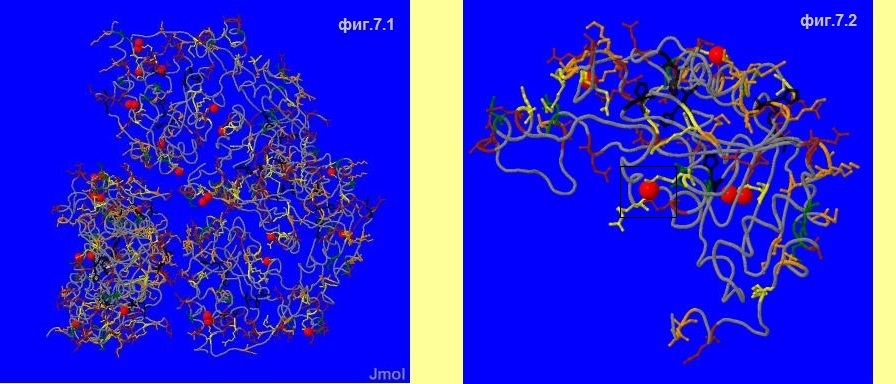
На фиг.7.1 отображено расположение соляных мостиков во всём белку, а на фиг.7.2 ― только в цепи A (5 штук).
На фиг.7.3 увеличен солевой мостик, находящийся в квадрате на фиг7.2 (синим отмечены азотные группы, красным ― кислородные).