ЭВОЛЮЦИОННЫЕ ДОМЕНЫ |
Назад |
| Домен | Организмов | Архитектур | Белков | Структур |
| Aconitase (PF00330) | 4231 | 34 | 14106 | 25 |
Табл.1 — количественная оценка распространённости аконитазного домена, согласно БД Pfam
Из Pfam в программу Jalview были загружены выровненные последовательности доменов более 14'000 белков (см.фиг.1).
Возможны проблемы с открытием файла проекта Jalview: Aco.jar
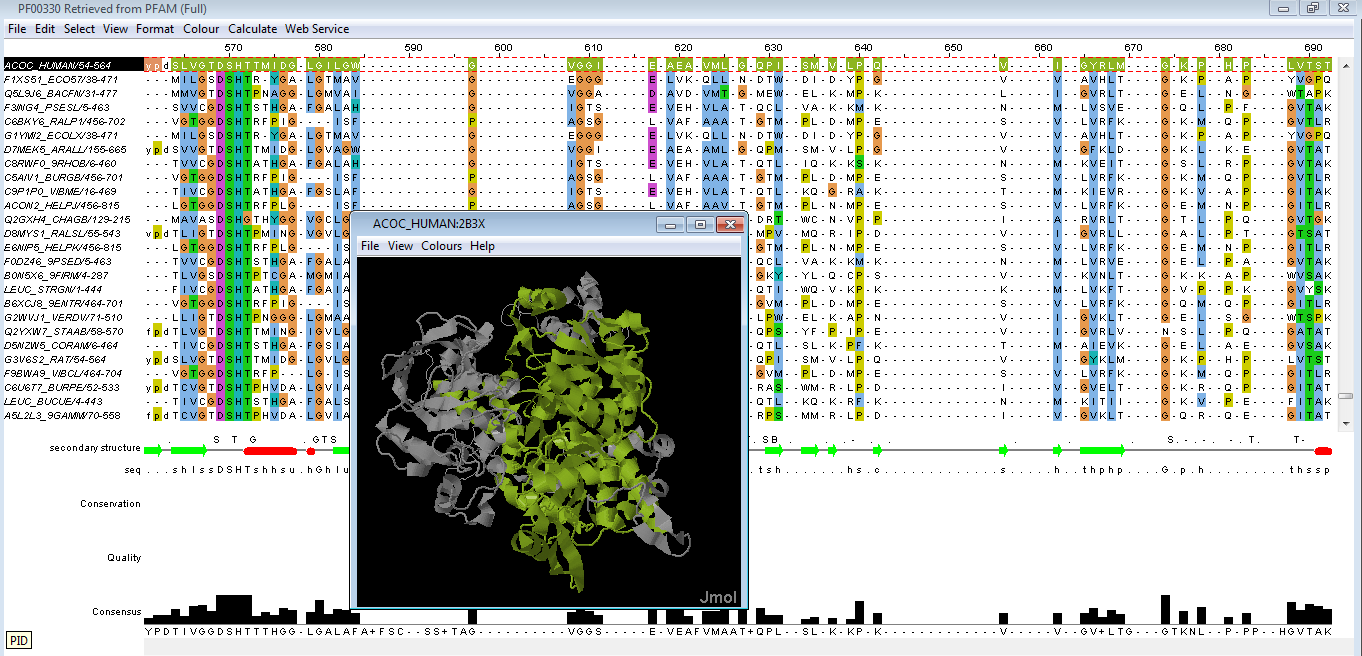
Фиг.1 — окно Jalview с выравниванием доменов в разных белках и примером структуры аконитазы.
Из множества архитектур, в которых присутствует аконитазный домен, были выбраны две:
 : : | Aconitase, Aconitase_C | |
 : : | Aconitase |
Таблицы с данными по белкам, в которых есть аконитазные домены, включая списки белков с выбранными архитектурами: Acon-Pfam.xlsx
При составлении списков белков с выбранными архитектурами использовался следующий скрипт: Search_arch.py
Записи Uniprot белков с первой и второй архитектурой:Aco_UNI.rar Таблица с данными по таксономии белков с первой и второй архитектурой Taxonomy.xlsx
Для дальнейшей работы были отобраны белки с описанной архитектурой и из следующих таксонов: Eukarya, Bacteria. Из последовательностей белков были вырезаны только участки с аконитазным доменом и выровнены(см.фиг.2)
Выравнивание: Aconitase_All.fa
У животных белки с одним аконитазным доменом этот домен сильно урезан (см.фиг.2), а существование самих белков достоверно не подтверждено. Это, скорее всего, псевдогены, они не учитывались при дальнейшей работе.
Реконструированное по выравниванию методом Maximum Likelihood филогенетическое дерево содержит много малодостоверных ветвей (см.фиг.3), но всё равно видно разделение ветвей на белки с двумя аконитазными доменами и на белки с одним.
| В деревьях используются cледующие обозначения: | |
| X_Y_Z_AC | |
| X | 1 — белок с архитектурой из единственного домена Aconitase |
| 2 — белок с архитектурой Aconitase, Aconitase_C | |
| Y | E.An — животное |
| E.F — гриб | |
| E.Pl — растение | |
| B.P — протеобиктерия | |
| B.F — фирмикут | |
| B.C — цианобактерия | |
| B.S — спирохеты | |
| Z | Имя организма или группы, к которой он принадлежит |
| AC | Accession Number белка |

Фиг.2 — выравнивание аконитазных доменов из белков бактерий и эукариот (Total.fa).
.png)
Фиг.3 — дерево белков, содержащих аконитазный домен. Дерево (All(ML).mts) построено по выравниванию аконитазных доменов (Aconitase_All.fa) методом Maximum likelihood, цифры у ветвей отражают частоты их встречаемости в Bootstrap-деревьях в процентах(было создано 500 деревьев).
Снизу — обобщённая схема этого дерева. Зелёной точкой показано событие разделения домена Aconitase и Aconitase_C.
Наличие в организме аконитазы с одной архиетектурой не исключает существования в нём же аконитазы со второй архитектурой (на дереве с фиг.3 2_E.P_Bean_I1J8H1 вверху и 1_E.Pl_Bean_B9SQS5 внизу относятся к разным видам бобовых, но в этих организмах есть и аконитазы с другими архитектурами, см.Taxonomy.xlsx, причём не являющиеся результатом альтернативного сплайсинга). Это говорит о том, что имела место дубликация гена с аконитазой. Так как листья с близкородственными группами организмов разнесены в дереве очень далеко, если у них разные архитектуры, то можно сказать, что эта дубликация произошла довольно давно, ещё до разделения фирмикут и протеобактерий.
Каким был исходный, дублированный ген? Это мог быть белок с архитектурой из двух аконитазных доменов. Тогда после дубликации у одной из двух копий гена исчез домен Aconitase_C. Это самый простой вариант. Крупную ветвь грибов и животных, в которой соседствуют белки с разной архитектурой можно объяснить горизонтальным переносом генов.
Если изначально был белок с одним аконитазным доменом, то все прочие архитектуры произошли от него. Вторая архитектура могли возникнуть в результате слияния домена Acоnitase и Aconitase_C. Кстати, предсказано, но пока не подтверждено вещественно существование белков, включающих один только Aconitase_C.
Для того, чтобы оценить возможность происхождения второй архитектуры от единственного аконитазного домена, необходимо анализировать выравнивания с другими архитектурами. Если прочие архитектуры, отличаются по последовательности аконитазного домена друг от друга ещё больше, чем от этой последовательности в белках с одним единственным аконитазным доменом, то белок с единственным аконитазным доменом действительно исходная форма. Если же в какой-то архитектуре аконитазный домен очень похож на домен из однодоменных белков, то стоит внимательней рассмотреть эту архитектуру.
Нельзя также и забывать про горизонтальный перенос, который не учитывелся при построении этого филогенетического дерева, что могло исказить картину. А горизонтальный перенос вполне возможен, как между бактериями, так и между бактериями и эукариотами в результате симбиозов, повлекших за собой образование митохондрий и пластид. Напрмер, предок современных хлоропластов мог передать растениям белок с одним аконитазным доменом, а предок митохондрий — с двумя всем ядерным организмам. Тогда становится ясным, почему такая простая архитектура не встречается у животных: у них на ранних стадиях эволюции не произошёл перенос исходного белка от предков пластид.
Этот случай показывает, насколько трудно бывает установить путь эволюции белков. Составление общей картины эволюции архитектур, в которые входит аконитазный домен, требует больших усилий и является задачей, выходящей за рамки курса. Автор этого текста считает, что достаточно подробно изложил возможные пути эволюции доменной архитектуры аконитаз и полностью анализировал полученные данные.