Восстановление "экспериментальной" электронной плотности
1. Построение изображения электронной плотности вокруг остова полипептидной цепи.
В качестве белка интереса была выбрана магниевая супероксиддисмутаза в соответствии с требованиями. PDB ID структуры в комплексе с азидом - 5t30 (получена в 2017 году), разрешение - 1.77 Å, длина - 199 а.о. Супероксиддисмутаза (СОД) - фермент, играющий ключевую роль в защите клеток от токсичных метаболитов кислорода. Они способствуют диспропорционированию двух молекул супероксида до молекулярного кислорода и перекиси водорода путем циклического восстановления и окисления в металле активного центра. Азид-анион является мощным конкурентным ингибитором, который связывается непосредственно с металлом и используется в качестве субстратного аналога супероксида в исследованиях СОД.
Изображения ЭП цепи были получены в программе PyMol. Использовалась команда isomesh с различными параметрами подрезки Z [level от 1 до 4 σ] и параметром carve=1.5 [задает максимальное расстояние от центра атома для изображения ЭП].
Изображения ЭП цепи были получены в программе PyMol. Использовалась команда isomesh с различными параметрами подрезки Z [level от 1 до 4 σ] и параметром carve=1.5 [задает максимальное расстояние от центра атома для изображения ЭП].
Рисунки 1-4, с Z от 1 до 4 σ соотвественно.
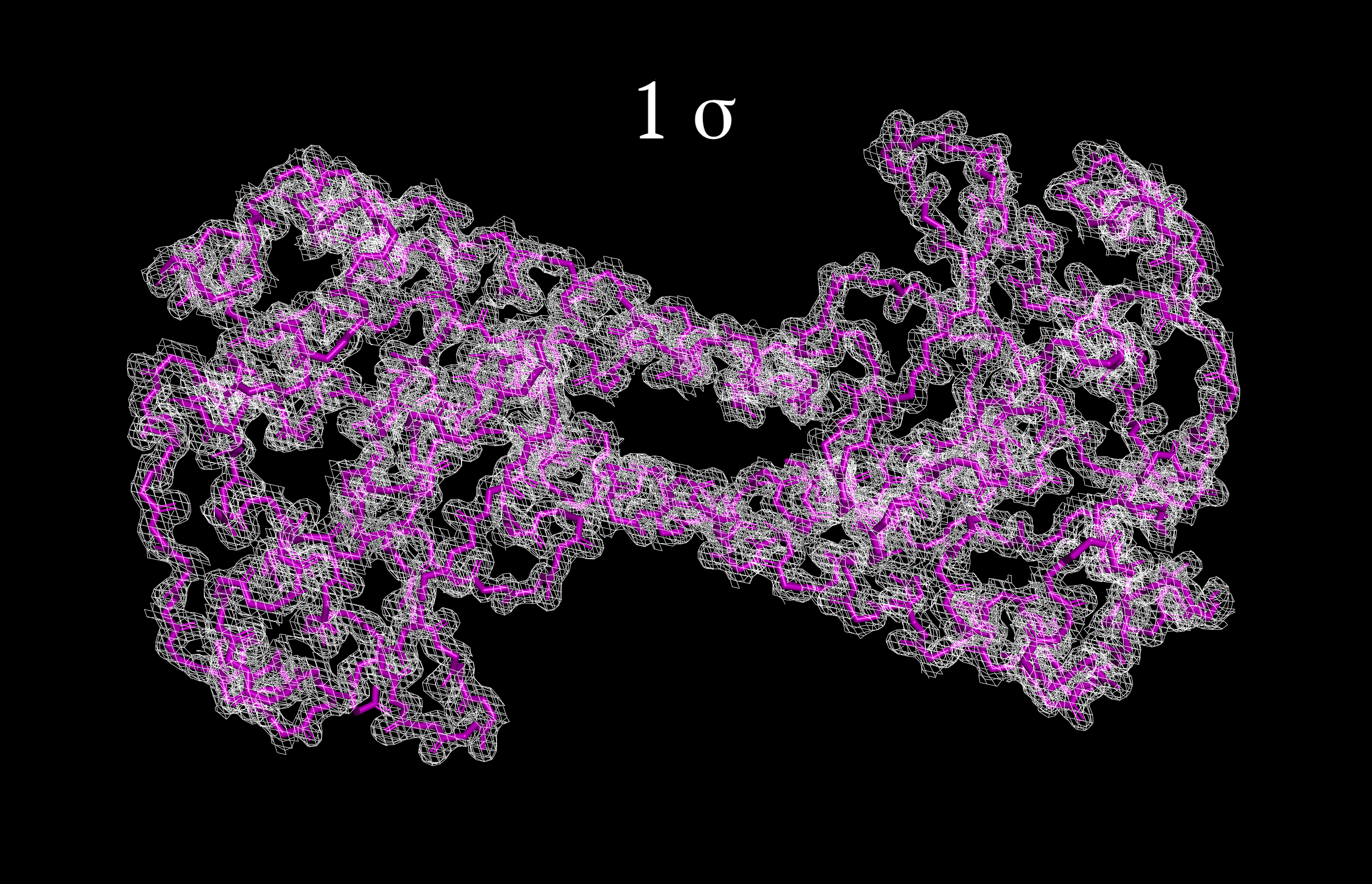
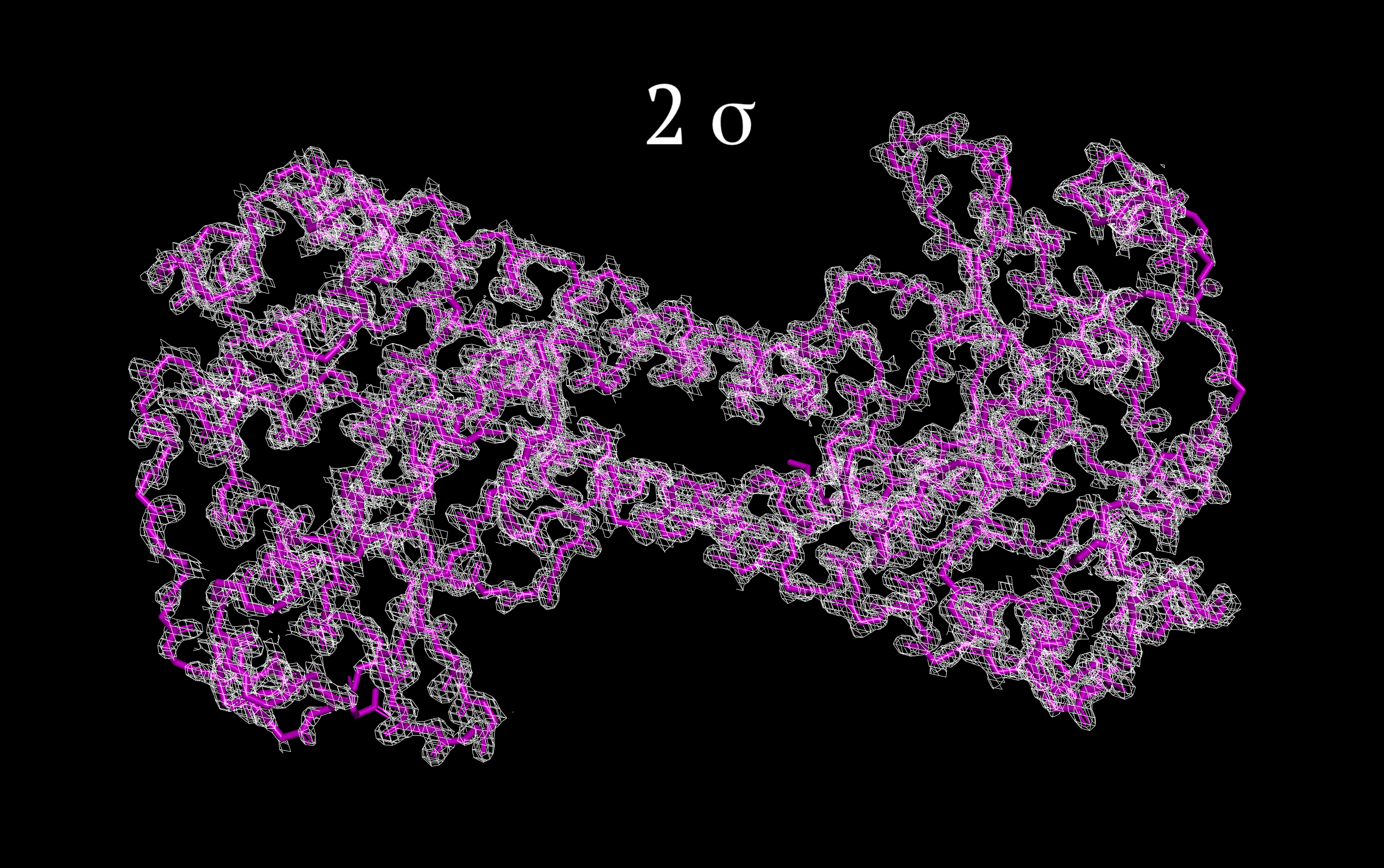
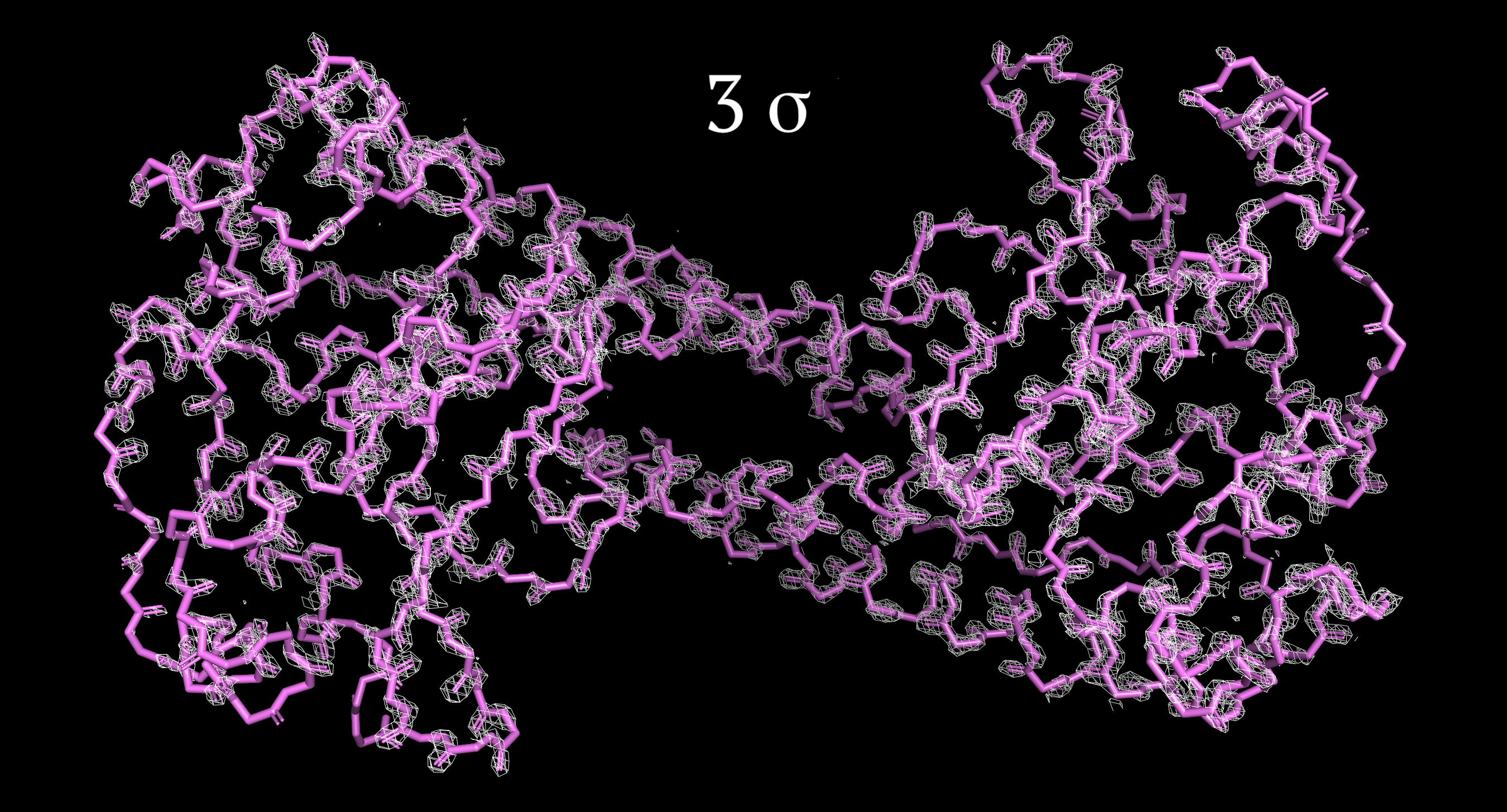

Как видно из рисунков, атомы остова полипептидной цепи модели располагаются в центрах сгущения электронной плотности. Однако при повышении уровня подрезки число атомов, выходящих за пределы поверхности ЭП, становится больше, что можно увидеть, начиная с Z=2.5 σ (не показано на рисунке) и далее. Электронная плотность с увеличением Z начинает группироваться у более электроотрицательных атомов в пептидных связях (N и O обладают большим, по сравнению с Сα, числом электронов, также имеет значение резонанс). Чуть более быстро пропадает ЭП на атомах N-конца цепи, которая соответствует альфа-спирали. Антипараллельные альфа-спирали образуют гидрофобное ядро за счет гидрофобных взаимодействий (что, вероятно, объясняет наличие здесь в основном неполярных аминокислот с меньшей разницей в электроотрицательности атомов).
2. Построение изображения электронной плотности вокруг аминокислотных остатков.
Рисунки 5-7, с Z от 1 до 2.5 σ соотвественно.
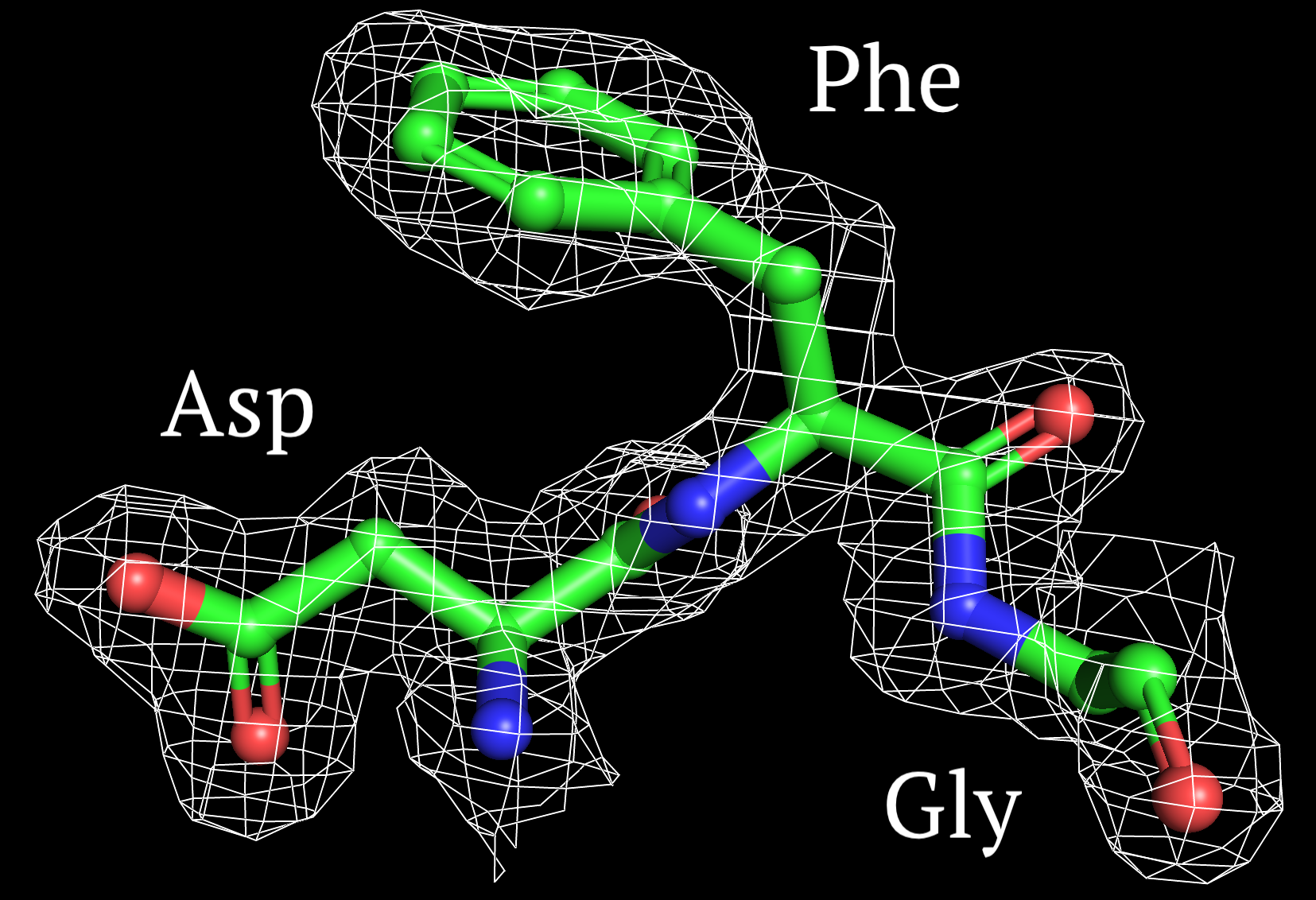
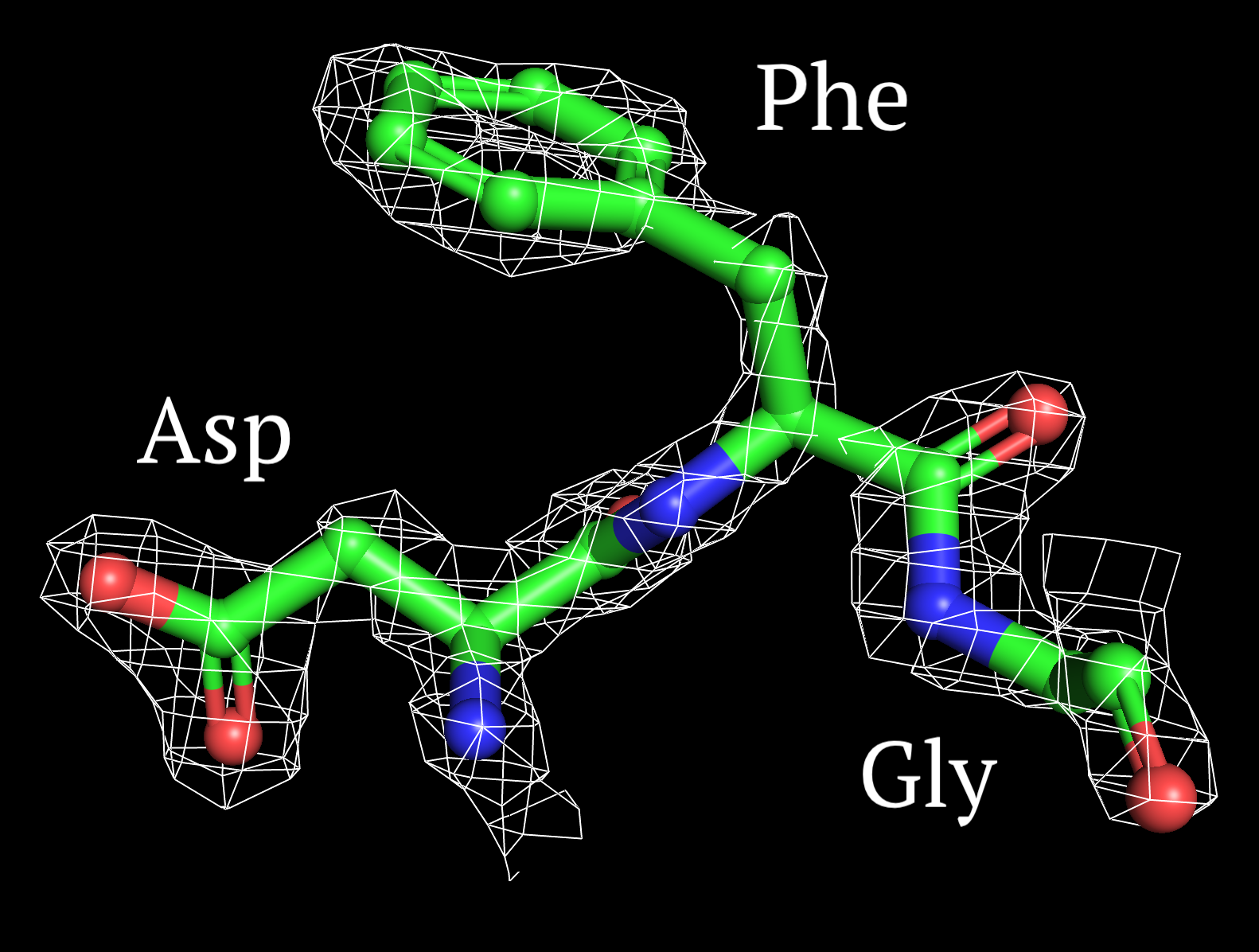
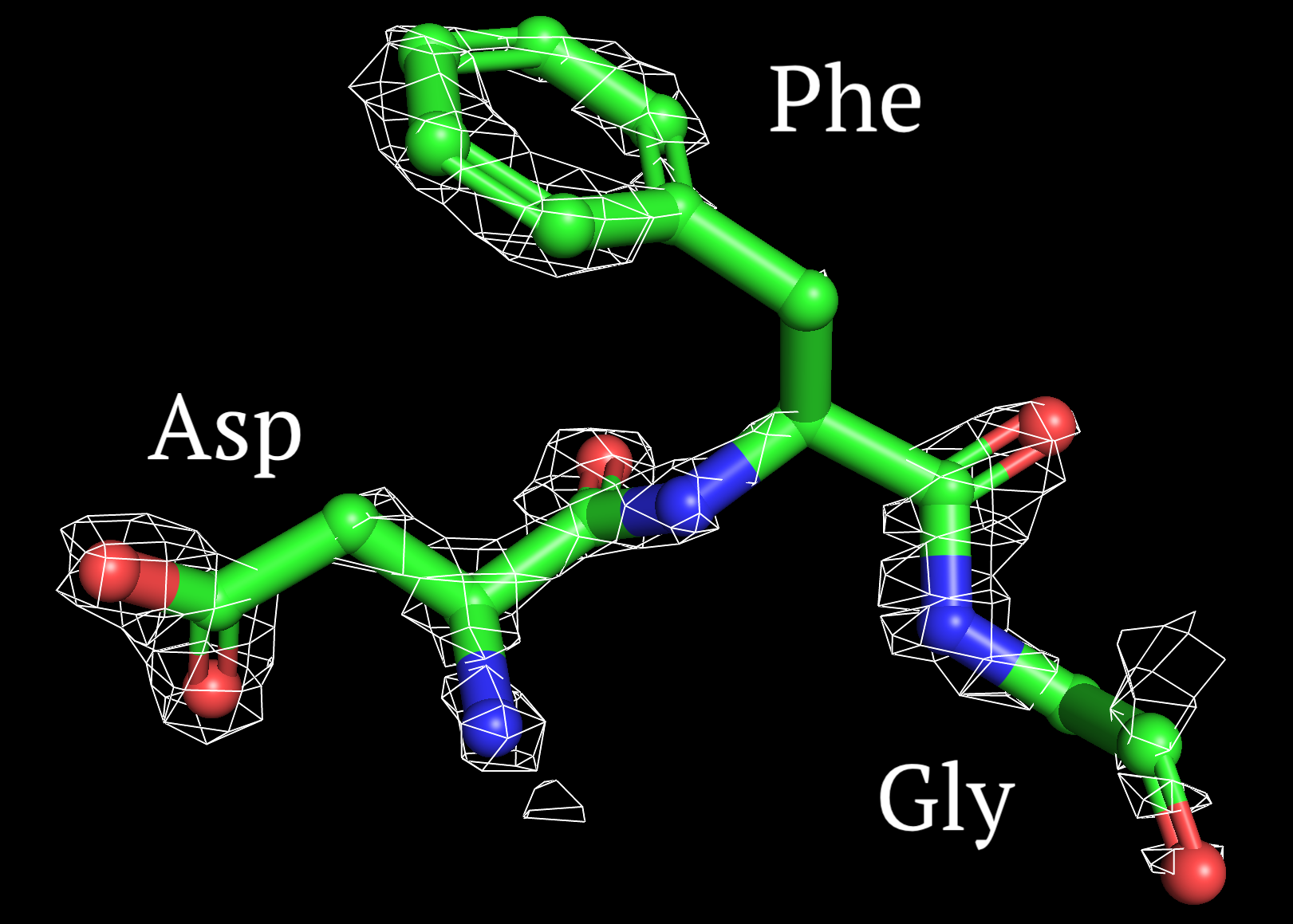
На уровне подрезки Z=1 σ сетка ЭП обтекает наибольшее количество атомов. Можно видеть, что электронная плотность сконцентрирована вокруг ароматического кольца фениланина и наиболее электроотрицательных атомов, как было сказано выше. А с ростом значения Z покрытие сеткой ЭП уменьшается, следовательно, пространственное расположение друг относительно друга определяется сложнее, чем вторичная структура полипептидной цепи.