С помощью сервиса MRS программой DSSP была предсказана вторичная структура целевого белка (см. файл). Он содержит несколько α-спиралей и β-лист.
Рисунок 1. Структура 5EUW
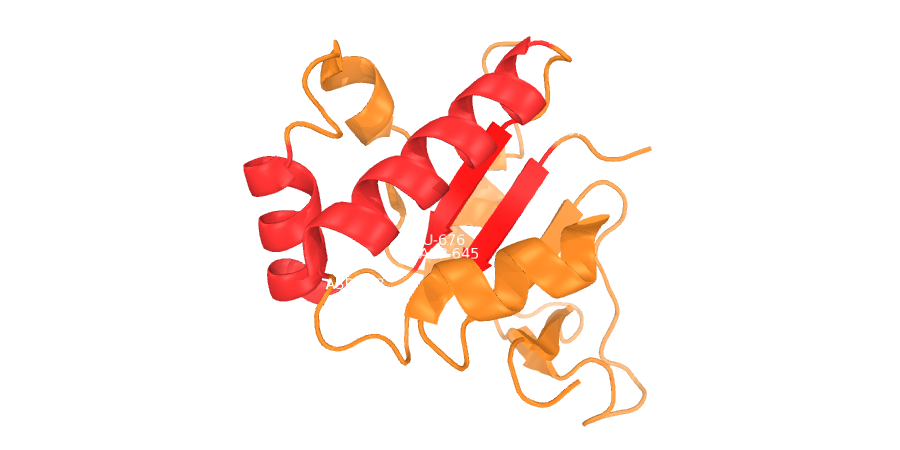
Красным выделены α-спирали и β-тяжи, которые будут рассматриваться в дальнейшем.
Запись PDB:
HELIX 3 AA3 SER A 680 ASN A 690 1 11
HELIX 2 AA2 ASP A 653 ASP A 669 1 17
SHEET 5 AA1 6 TYR A 673 ALA A 677 1 O TYR A 675 N LEU A 644
SHEET 4 AA1 6 THR A 641 ASP A 645 1 O ILE A 643 N LYS A 536
Запись PDB:
HELIX 3 AA3 SER A 680 ASN A 690 1 11
HELIX 2 AA2 ASP A 653 ASP A 669 1 17
SHEET 5 AA1 6 TYR A 673 ALA A 677 1 O TYR A 675 N LEU A 644
SHEET 4 AA1 6 THR A 641 ASP A 645 1 O ILE A 643 N LYS A 536
Элементы вторичной структуры в выдаче обозначены следующим образом:
G = 3-turn helix (3-10 helix). Min length 3 residues.
H = 4-turn helix (α helix). Min length 4 residues.
I = 5-turn helix (π helix). Min length 5 residues.
T = hydrogen bonded turn (3, 4 or 5 turn)
E = extended strand in parallel and/or anti-parallel β-sheet conformation.
Min length 2 residues.
B = residue in isolated β-bridge (single pair β-sheet hydrogen bond formation)
S = bend (the only non-hydrogen-bond based assignment).
C = coil (residues which are not in any of the above conformations).
H = 4-turn helix (α helix). Min length 4 residues.
I = 5-turn helix (π helix). Min length 5 residues.
T = hydrogen bonded turn (3, 4 or 5 turn)
E = extended strand in parallel and/or anti-parallel β-sheet conformation.
Min length 2 residues.
B = residue in isolated β-bridge (single pair β-sheet hydrogen bond formation)
S = bend (the only non-hydrogen-bond based assignment).
C = coil (residues which are not in any of the above conformations).
Сравним границы элементов вторичной структуры в файле PDB и выдаче DSSP.
α-спирали:
a) PDB: SAQVVNDLTSN
DSSP: AQVVNDLTS
b) PDB: DSVGVKTLAGIVKEYGD
DSSP: SVGVKTLAGIVKEYG
β-тяжи:
a) PDB: YVYLA
DSSP: YVYLA
b) PDB: TVILD
DSSP: TVILD
Согласно сравнению, DSSP точно (так же, как и в PDB) предсказал последовательности для 2-х β-тяжей, а в случае α-спиралей укоротил их на 1 остаток с каждой стороны.
Рисунок 2. Карта β-листа 5EUW и расположение его в структуре.
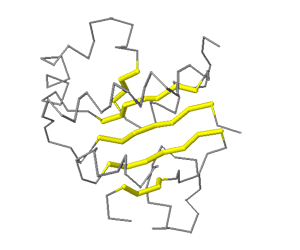

Проверим соответствие карты структуре.
Рисунок 3. Соответствие карты хребтам в листе
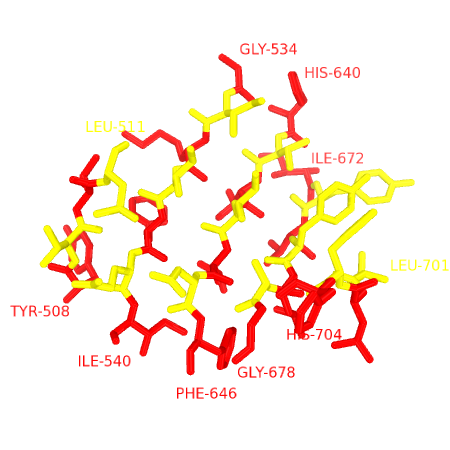
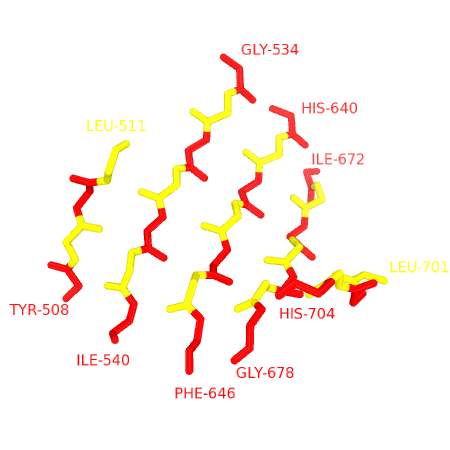
Чередующимися цветами выделены остатки, расположенные в одном столбце на карте из Рис.2. Слева представлена структура с боковыми цепями, справа - только скелет.
На изображении выше прослеживается зубчатая структура β-тяжей в составе листа. Практически все остатки, входящие в состав листа, гидрофобны. Принимая во внимание структуру белка, можно сказать, что весь лист расположен в коре, т.е. обе его стороны обращены в ядро.
С помощью детектора β-листов STRIDE на сайте SheeP была получена карта водородных связей, а в консольной версии - список водородных связей.
Рисунок 4. Расположение водородных связей

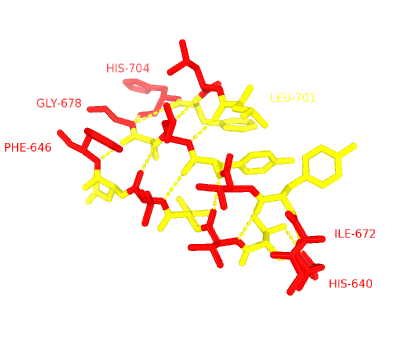
Между 3 цепями на Рис.4 показаны водородные связи. На выбранном участке не найдены нерегулярности (нет ни "выпадающих" из общей картины водородных связей остатков, ни β-bulge-петель). Основные виды водородных связей: NH-----O (и для скелетов, и для His, у которого есть водородная связь с Thr).