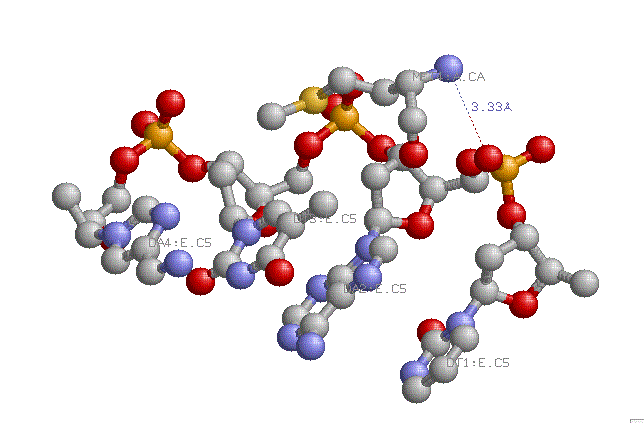
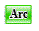Белок и ДНК из Бактериофага Р22 .
Для исследования были выбраны
цепи A, B, C, D белка и цепи E, F, представляющие ДНК со следующей последовательностью:
цепь E [1] 5'- TATAGTAGAGTGCTTCTATCAT - 3' [22]
|||||||||||||||||||||
цепь F [22] 3' - TATCATCTCACGAAGATAGTAA - 5' [1],
Classification of each dinucleotide step in a right-handed nucleic acid
structure: A-like; B-like; TA-like; intermediate of A and B, or other cases
step Xp Yp Zp XpH YpH ZpH Form
1 AT/AT -3.45 8.72 0.64 -5.74 8.68 1.09
2 TA/TA -3.40 8.86 0.59 -6.68 8.41 2.85
3 AG/CT -3.09 8.74 0.35 -5.54 8.49 2.14 B
4 GT/AC -3.34 9.30 0.31 -7.43 9.07 2.11 B
5 TA/TA -2.14 8.80 0.57 -0.84 8.74 -1.16
6 AG/CT -3.18 8.89 -0.14 -4.91 8.43 2.76 B
7 GA/TC -3.07 8.97 0.05 -4.23 8.88 1.30 B
8 AG/CT -2.96 8.94 -0.21 -2.85 8.91 0.74 B
9 GT/AC -3.65 9.08 -1.25 -4.97 9.16 -0.40 B
10 TG/CA -2.96 8.92 -0.10 -1.65 8.89 -0.74 B
11 GC/GC -2.93 8.90 0.03 -1.28 8.75 -1.60 B
12 CT/AG -3.29 9.19 -0.86 -5.06 9.22 0.54 B
13 TT/AA -2.31 9.08 -0.07 -1.59 9.07 -0.55 B
14 TC/GA -2.76 9.12 0.09 -4.66 8.71 2.70 B
15 CT/AG -3.12 8.93 -0.11 -2.96 8.92 0.25 B
16 TA/TA -2.77 8.65 0.42 -2.08 8.65 -0.34 B
17 AT/AT -3.81 9.06 0.24 -8.03 8.66 2.67 B
18 TC/GA -3.16 8.86 0.51 -5.27 8.57 2.29
19 CA/TG -3.33 8.74 0.85 -7.57 8.30 2.85
20 AT/AT -3.66 8.59 0.34 -5.15 8.59 0.48
Были определены средние значения торсионных углов для внутренних нуклеотидов.
Наиболее отклоняющиеся от средних значения торсионных углов имеют Тимин19 из цепи Е и Аденин5 из цепи F, причем они образуют комплементарную пару..
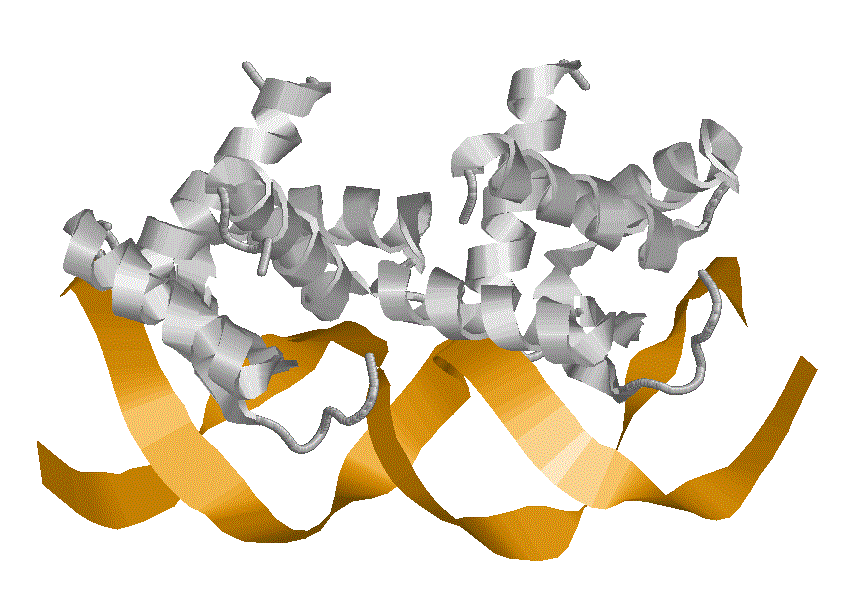
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 2 | 29 | 31 |
| остатками фосфорной кислоты | 35 | 41 | 76 |
| остатками азотистых оснований со стороны большой бороздки | 6 | 25 | 31 |
| остатками азотистых оснований со стороны малой бороздки | 0 | 0 | 0 |
 |
 |
|
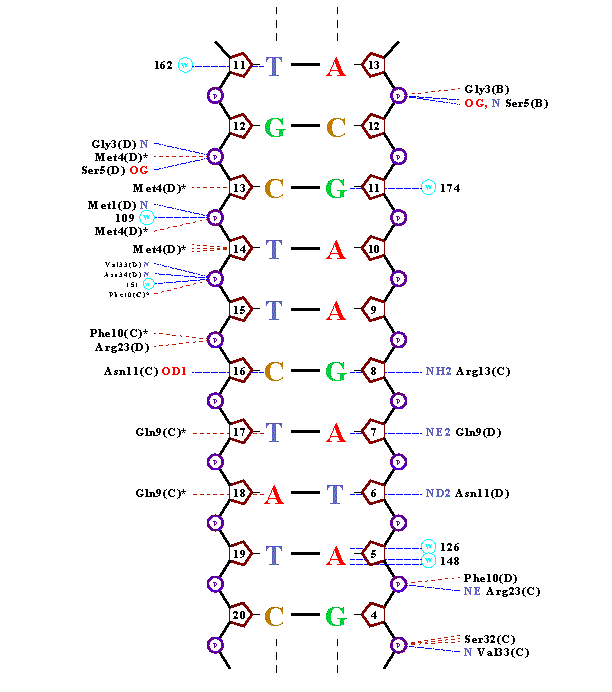
Очевидно, что контактов белка с остовом молекулы ДНК намного больше, чем с
азотистыми основаниями. Взаимодействия белка с азотистыми основаниями можно рассматривать как проявление
селективности, избирательности белка. Это можно положить в основу рассуждений при выборе распознающих контактов. Интересно то,
что контакты между водой и азотистыми основаниями представлены в таком большом количестве.
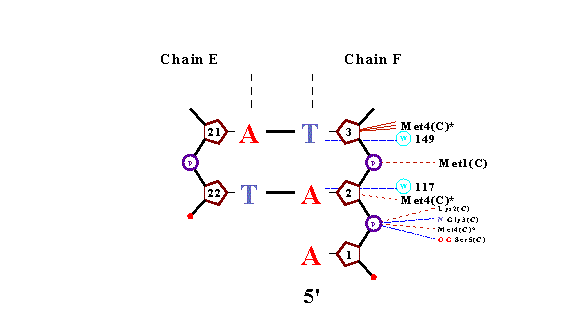
Результаты на картинке и мой собственный вывод из пункта 3 весьма коррелируют. В коментариях к заданию III я указал пару 19Т(Е) - 5А(F) с наиболее отклоняющимися значениями торсионных углов. Как видно из представленных картинок, никакое основание из пары не взаимодействует непосредственно с белком, лишь аденин опосредованно,через фосфат; когда же число водородных связей с водой максимально для всего комплекса и равно трем. Предположительно, это имеет некое функциональное значение. Должно быть, эти пять связей и вызвали такие отклонения в значениях двугранных углов. |
 |