| Глицин | |
 | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование |
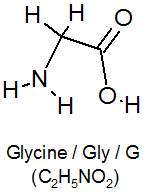
Аминоуксусная кислота
|
| Сокращения | Гли, Gly, G GGU,GGC,GGA,GGG |
| Традиционные названия | Глицин |
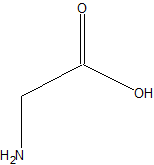
| Хим. формула | NH2 —CH2 —COOH |
| Рац. формула | C 40,82 %, H 6,17 %, N 9,52 %, O 43,5 % |
| Физические свойства | |
| Состояние | белый кристаллический порошок |
| Молярная масса | 75,0666г/моль |
| Плотность | 1,161г/см³ |
| Термические свойства | |
| Т. плав. | 233 ;°C |
| Т. кип. | 260 °C |
| Т. разл. | 290 °C |
| Химические свойства | |
| pKa | 2.37 |
| Растворимость в воде | 2,49 г/100 мл |
| Изоэлектрическая точка | 3,21 |
| Классификация | Рег. номер CAS | 56-40-6 |
| PubChem | 750 |
| SMILES | |
| InChI | |
| Безопасность | |
| ЛД50 | 4920(мыши, перорально) |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Глицин явился первой аминокислотой, выделенной из белкового гидролизата. В 1820 г. Браконно получил глицин из сернокислого гидролизата желатины и обратил внимание на сладкий вкус этой аминокислоты. В дальнейшем описанный Браконно «сахар желатины» был назван гликоколлом, а затем глицином. Браконно не знал о наличии азота в молекуле глицина; более поздние работы, завершением которых явились исследования Каура, привели к установлению строения гли цина и синтезу его из монохлоруксусной кислоты и аммиака.
Глицин присутствует в больших количествах в желатине и
входит в состав многих других белков. В виде амида он встречается в окситоцине и вазопрессине. Глицин является
составной частью целого ряда природных веществ, например
глутатиона, а такж е гиппуровой и гликохолевой кислот. Помимо
этого, в природе встречается N-метилпроизводное глицина, саркозин; было показано, что это вещество является продуктом
тканевого обмена у млекопитающих. Саркозин обнаружен также в составе белка земляного ореха и в гидролизатах некоторых антибиотиков.
Вайнхауз и сотрудники доказали, что в организме
крыс происходит взаимопревращение глицина и глиоксиловой
кислоты. Глицин, глиоксиловая и гликолевая кислоты быстро
окисляются срезами печени крысы с образованием CO2, щавелевой кислоты и гиппуровой кислоты (последняя появляется
в присутствии бензойной кислоты). При помощи метода «изотопной ловушки» было доказано превращение глицина в глиоксиловую кислоту в гомогенате печени крысы. Найдено, что
щавелевая кислота образуется не прямо из глицина, а из глиоксиловой кислоты, в условиях, когда последняя присутствует
в относительно больших концентрациях. Дальнейшими исследованиями выяснено, что в обычных условиях щавелевая кислота,
вероятно, не образуется и что а-углеродные атомы глицина, гликолевой кислоты и глиоксиловой кислоты переходят в муравьиную кислоту.
Эти данные можно резюмировать следующим образом:
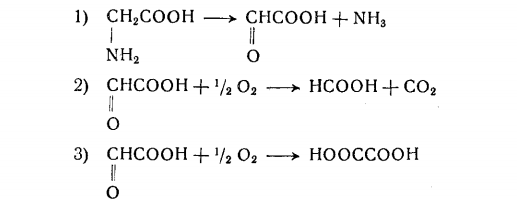 Реакция (3) может протекать при участии ксантиндегидроге-
назы, а такж е другого фермента, найденного в печени го
лубя. Реакция (2) может осуществляться неферментатив
ным путем с участием перекиси водорода, а такж е под влия
нием ферментной системы, детально еще не изученной. Превра
щение глицина в глиоксиловую кислоту происходит путем окис
лительного дезаминирования или переаминирования.
Д оказано, что муравьиная кислота быстро окисляется в CO2:
H C O O H + H2O2 — ► C O 2 + 2Н20 .
Эта реакция, наблю даемая в растительных и животных тканях, может протекать за счет пероксидазной активности каталазы, с использованием перекиси водорода, образующейся
в ходе других реакций.
Другие пути образования глиоксиловой кислоты (не из глицина) еще не вполне ясны. У некоторых бактерий глиоксиловая кислота образуется в результате расщепления изолимонной
кислоты. В экстрактах из листьев шпината наблюдали
образование глицина из рибозо-5-фосфата. При этом процессе
в качестве промежуточных продуктов, по-видимому, образуются
гликолевый альдегид, гликолевая и глиоксиловая кислоты.
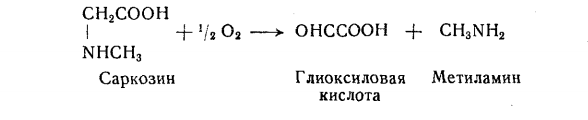
Глиоксиловая кислота образуется также при действии глициноксидазы на саркозин, согласно следующему
уравнению [1]:
Реакция (3) может протекать при участии ксантиндегидроге-
назы, а такж е другого фермента, найденного в печени го
лубя. Реакция (2) может осуществляться неферментатив
ным путем с участием перекиси водорода, а такж е под влия
нием ферментной системы, детально еще не изученной. Превра
щение глицина в глиоксиловую кислоту происходит путем окис
лительного дезаминирования или переаминирования.
Д оказано, что муравьиная кислота быстро окисляется в CO2:
H C O O H + H2O2 — ► C O 2 + 2Н20 .
Эта реакция, наблю даемая в растительных и животных тканях, может протекать за счет пероксидазной активности каталазы, с использованием перекиси водорода, образующейся
в ходе других реакций.
Другие пути образования глиоксиловой кислоты (не из глицина) еще не вполне ясны. У некоторых бактерий глиоксиловая кислота образуется в результате расщепления изолимонной
кислоты. В экстрактах из листьев шпината наблюдали
образование глицина из рибозо-5-фосфата. При этом процессе
в качестве промежуточных продуктов, по-видимому, образуются
гликолевый альдегид, гликолевая и глиоксиловая кислоты.
Глиоксиловая кислота образуется также при действии глициноксидазы на саркозин, согласно следующему
уравнению [1]:
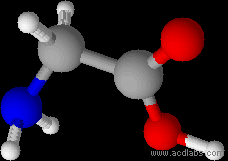
При нажатии на кнопку "Show labels" можно видеть шаро-стержневую модель молекулы глицина (в изоэлектрической точке) с обозначенными тяжелыми атомами.
Содержание
Информация о физико-химических свойствах
Глицин (glycine) — простейшая алифатическая аминокислота, единственная протеиногенная аминокислота, не имеющая оптических изомеров.
Способы получения
Известны способы получения глицина через аммонолиз и последующее омыление водных растворов гликолонитрила. Исходный гликолонитрил образуется по реакции формальдегида с синильной кислотой или ее солями. Необходимость использования этого сильно-ядовитого реагента является основным недостатком описанного способа. Последующие стадии аммонолиза и омыления проводятся в разбавленных водных растворах и требуют по меньшей мере эквимолярных затрат щелочей и кислот, что обусловливает образование больших количеств загрязненных сточных вод. Выход глицина невысок - 69%.
Известен способ получения глицина щелочным гидролизом гидактоина с последующим выделением свободной аминокислоты. Выход глицина - 95%.
Однако гидактоин не относится к числу доступных для промышленного синтеза реагентов, к тому же для его получения также необходима HCN (синтеза Штрекера).
В промышленной практике наиболее распространен способ синтеза глицина аммонолизом монохлоруксусной кислоты (МХУК), которая является доступным крупнотоннажным реагентом, в водном растворе в присутствии эквомолярных количеств гексаметилентетрамина.
Так, например, известен способ получения глицина обработкой МХУК или ее аммонийной или натриевой соли аммиаком и NaOH в водной среде, содержащей гексаметилентетрамин и NH4+ -ионы в мольном соотношении с МХУК не менее чем 1: 3.
Первую половину водного раствора 238 г МХУК добавляют по каплям за 1 ч при 65-70оС к раствору, содержащему 52,5 ч. гексаметилентетрамина, 42,5 ч. NH4Cl, 180 ч. - вода, рН раствора 6,5-7,0 поддерживают пропуская в раствор газообразный аммиак. Затем при той же температуре в течение часа добавляют вторую половину раствора и одновременно вводят раствор 100 ч. NaOH в 234 ч. воды. Смесь нагревают еще 1 ч при 65-70оС, после чего добавляют 2000 ч. воды и анализируют. Получают 175,5ч. глицина, выход 93,0% . Приведен пример с 2-кратным использованием маточных растворов. Общий выход глицина 88%.
Недостатки способа: высокие расходные коэффициенты: 0,57 г NaOH, 0,30 т гексаметилентетрамина, 2,85 т воды на 1 т неочищенного глицина. Особо следует подчеркнуть наличие большого объема сточных вод, который недопустим в cовременной экологической ситуации.
Наиболее близким по технической сущности и достигаемому эффекту к предлагаемому способу является способ синтеза глицина из МХУК и аммиака, проводимый в среде метилового или этилового спирта [3 - прототип] .
Согласно способу-прототипу 189 кг МХУК в 80 л 90% -ного СН3ОН и 68 кг NH3 одновременно добавляют к 70 кг гексаметилентетрамина в 1000 л 90% -ного СН3ОН при 40-70оС и соотношении гексаметилентетрамин : МХУК = 1: 4. Затем из полученной реакционной смеси удаляют кристаллический глицин в смеси с NH4Cl. Выход глицина в расчете на затраченную МХУК составляет 95% , чистота продукта после дополнительной очистки - 99,5% .
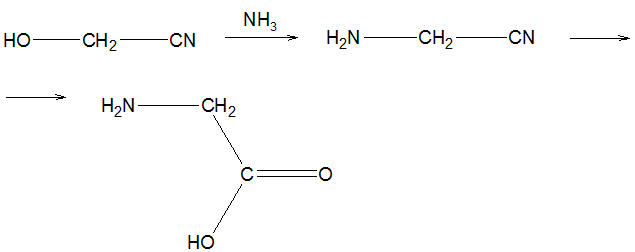
Новый путь синтеза
МХУК и гексаметилентетрамин, взятые в молярном соотношении (9-15): 1 растворяют в метаноле, содержащем 10 мас. % воды, добавляют хлороформ в количестве 3-5% от массы введенной МХУК и в полученную смесь барботируют газообразный аммиак при 40-70оС в течение 1,5-2 ч. Образующийся глицин в смеси с NH4Cl выпадает в кристаллический осадок, который после охлаждения реакционной смеси до 20оС отделяют центрифугированием. Маточную реакционную жидкость используют вновь в качестве реакционной среды вместо метанольного раствора гексаметилентетрамина после восполнения уноса с осадком метанола гексаметилентетрамина и хлороформа [2].
Химические свойства
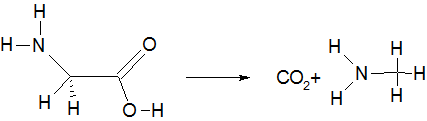
При нагревании аминокислот в сухом состоянии или в высококипящих растворителях они декарбоксилируются, в результате чего образуется соответствующий амин. Реакция аналогична ферментативному декарбоксилированию аминокислот
С метиловым эфиром глицина реакция протекает легче, чем с глициновыми эфирами высших спиртов.
При получении фосфоамидных производных на глицин воздействуют хлорокисью фосфора в щелочной суспензии гидрата окиси магния и выделяют продукт реакции в виде магниевой соли. Продукт синтеза гидролизуется разбавленными кислотами и препаратами фосфатазы.
Кислотно-основные свойства
Наличие NH3-группы в молекуле глицина повышает кислот
ность карбоксильной группы глицина, что можно объяснить тем, что NH3 rpynna способствует отталкиванию иона водорода от карбоксильной группы. Ацилирование аминогруппы глицина уменьшает степень диссоциации карбоксильной группы. При титровании гидроксидом натрия получаются приведенные ниже значения рКа (титруется хлоргидрат для лучшей растворимости). На кривой заметно, что для превращения NH3CH2CO2H в NH2CH2CO2 требуется два эквивалента основания: рН в ходе добавления первого эквивалента основания соответствует кислоте, Ка которой равна 5*10-3 (при низком значении рН (ниже pK1) почти все молекулы глицина являются полностью протонированными и несут положительный заряд), тогда как рН полунейтрализации при добавлении второго эквивалента соответствует Ка=2*10-19 (рКа=9.60). При рН=7 аминокислота находится в состоянии цвиттер-иона. Точка эквивалентности достигается при рН=3,21 (рКа=5,97), однако из его титрационной кривой видно, что глицин находится в изоэлектрическом состоянии в довольно широком интервале pH.
Методы определения
Аминокислоты,
обладающие первичной аминогруппой, реагируют с азотистой
кислотой с образованием соответствующей оксикислоты и выделением азота [1]:
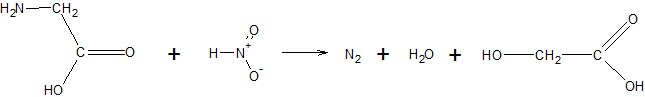
*Далее можно посмотреть взаимодействия глицина с другими аминокислотами из разных белков. Обращаем внимание на то, что отбор белков для визуализации контакта проводился по критерию наиболее удобного написания скрипта (то есть использовались белки, в которых содержится наибольшее число водородных связей), поэтому многие белки не будут описаны в объяснении далее.
Каналы
Консенсусная последовательность, входящая в состав Enac, содержит остатки глицина и серина (Гли-Х-Сер) в селективном фильтре, где они (связанные водородной связью) определяют связывание с ионами натрия.
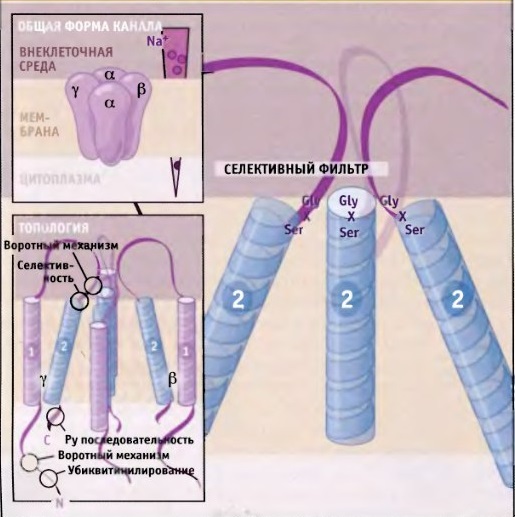
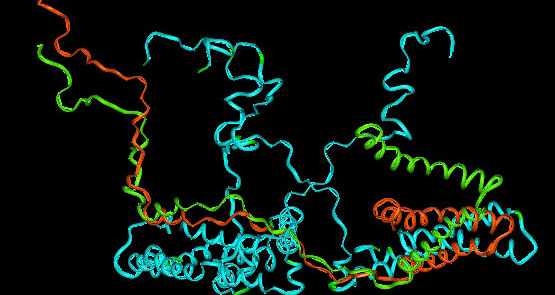
Структура эпителиального натриевого канала ENaC [3]
Потенциал-зависимый калиевый канал в составе каждой внутренней спирали содержит ключевой остаток глицина, что обеспечивает гибкость. В частности, в KcsA K-канале бактерий во внутренней спирали селективного фильтра расположенны идущие подряд остатки глицина, тирозина, глицина и валина, по-видимому, водородные связи между ними благоприятствуют возникновению данной укладки и взаимодействию с ионами калия (сайты связывания Р1-Р4 образованы атомами кислорода, 1К4С)
Структурные белки
Расположенные рядом, пролин и глицин (длина водородной связи 2.82 A, угол N-O-C=132.5) играют ключевую роль в формировании и поддержании структуры коллагена (к тому же, регулярно расположенный глицин вносит регулярность, в случае нахождения здесь большей аминокислоты, структура бы ломалась). Глицин способен образовывать водородную связь с ОН-группой гидроксипролина, характерной модификацией в коллагене.
Другой белок - эластин - богат глицином, валином и аланином, но беден пролином. Более тонкие и более многочисленные нити характеризуются наличием гидрофобных последовательностей, вкрапленных среди гидрофильных, где первые обеспечивают эластичность за счет сворачивания молекулы в спираль в нерастянутом состоянии, и ее растяжении при приложении силы
Глутатион - очень простая молекула, это комбинация из трех блоков аминокислот - цистеина, глицина и глутамина (длина водородной связи 2.93 A, угол N-O-C=153.6).Синтез происходит в две АТР-зависимые стадии: на первой стадии синтезируется гамма-глутамилцистеин из L-глутамата и цистеина ферментом гамма-глутамилцистеин синтетазой (или глутаматцистеин лигазой). Данная реакция является лимитирующей в синтезе глутатиона. На второй стадии фермент глутатион синтетаза присоединяет остаток глицина к С-концевой группе гамма-глутамилцистеина. Глицин, образующий пептидную связь с цистеином, при присоединении других аминокислот глутатионом, переносит цистеин (что видимо и является его функцией в данном трипептиде - просто небольшая гидрофобная аминокислота)
Глицин входит в состав многих консенсусных последовательностей, например в киназах встречается последовательность Gly-X-Glу, где возможно образование водородных связей между двумя концевыми остатками (длина водородной связи 3.22 A, угол N-O-C=115.3).
Глицин, являясь незаряженной алифатической аминокислотой, не вносит значительного вклада в функционирование белков, взаимодействующих с ДНК (данный факт был проверен на белке 4xzq, GLY644:E, расстояние, на котором расположен данный остаток от ДНК, превышает максимально возможное для водородной связи.
Редко встречается в гидрофобных ядрах и также не вносит вклада в поддержание их конформации (его нахождение здесь случайно, т.к. гидрофильный). Не способен к образованию так называемых солевых мостиков ввиду отсутствия соответствующего радикала.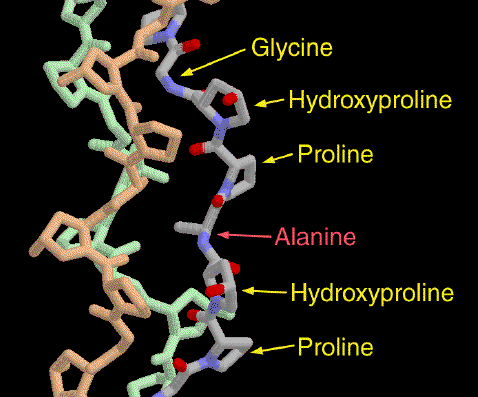
Замена остатка глицина на аланин и влияние на структуру коллагена [8]
Любопытно отметить, что в составе G-белков (Ras) имеется участок Р-петли, игграющий ключевую роль в работе всего белка, образованный взаимодействующими Gly40, Thr35.
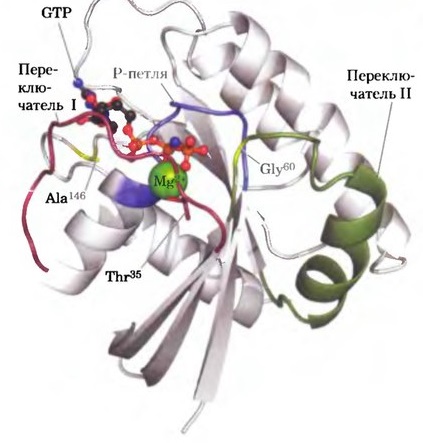
Ras-белок и его консенсус [3]
Являясь небольшой гидрофильной молекулой, глицин принимает участие в формировании изгибов бета-петель. Так, в фиброине шелка можно обнаружить расположенные последовательно аспартат и глицин (3UA0 Asp91:a, Gly92:a), аспарагин и глицин ((3UA0 Asn93:a, Gly92:a): поскольку аспартат заряжен отрицательно, а аспарагин положительно, между ними возникает кулоновское взаимодействие, которое смягчает глицин, расположенный посередине. Другой пример - белок креатин аминогидролаза (1CHM), где наблюдается аналогичное взаимодействие глутамата и аргинина.
Белок GFP, активно использующийся во флуоресцентной микроскопии, состоит из 11 нитей, собранных в бета-цилиндр, в центре хроматофор, содержит консенсусную последовательность Сер-Тир-Гли, окисление которого и приводит к флуоресценции [3].
При физиологическом значении рН в свободном состоянии аминокислоты находятся в протонированной форме, таким образом, глицин, образуя водородную связь, теряет этот протон.
Метаболизм
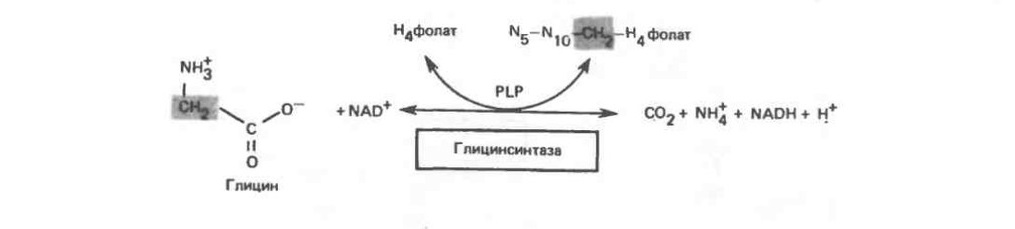
Главный путь катаболизма глицина у позвоночных - это катализируемое глицинсинтазным комплексом превращение, в результате которого образуются углекислый газ и ион аммония, а метиленовая группа переносится на тетрагидрофолат. Данная реакция является основным путем катаболизма глицина и серина у многих позвоночных
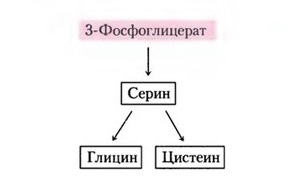
Синтез глицина из 3-фосфоглицерата [3]
Синтез глицина в тканях млекопитающих осуществляется несколькими путями. В цитозоле печени содержится глицинтрансаминаза , катализирующая синтез глицина из глиоксилата и глутамата (или аланина). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина. Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина холин и серин; в последнем случае катализ осуществляется серингидроксиметилтрансферазой .
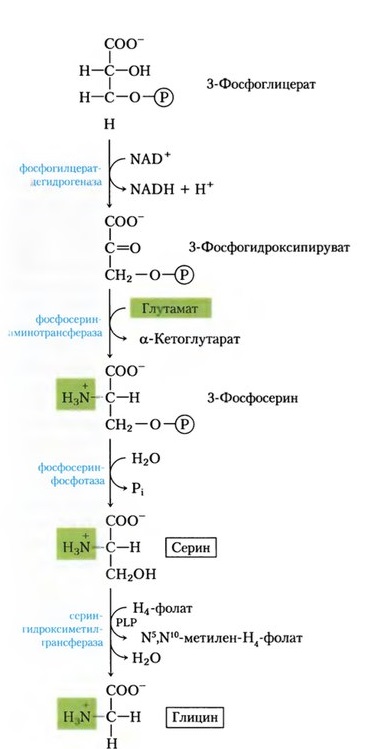
Синтез глицина из 3-фосфоглицерата [3]
Участие глицина в синтезе гема было доказано при инкубировании глицина, меченного N и С , с серповидными эритроцитами, образующимися у человека при особой форме анемии, или с ядерными эритроцитами птиц. Пиррольное кольцо порфирина образуется, по всей вероятности, при конденсации глицина с р-кетоальдегидом. Порфирины можно получить in vitro при конденсации глицина с ацетоуксусным альдегидом СНз- СО СНг СОН. Опыты с мечеными аминокислотами показали, что ни пролин, ни глутаминовая кислота не являются предшественниками порфиринов, и, следовательно, представление о том, что пролин является исходным веществом в синтезе пиррольных колец, должно быть отброшено. Порфириновая часть гемоглобина, введенная интраперитонеально, не используется для образования новых молекул гемоглобина. Организм осуществляет полный синтез порфирина из глицина и не использует для этой цели порфирин, введенный с пищей или парентерально.
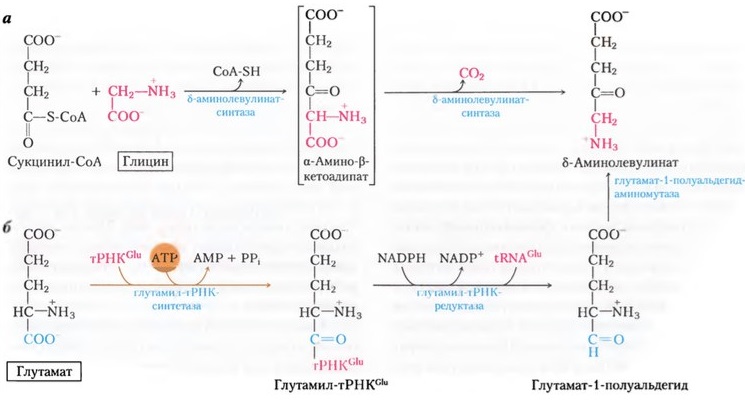
Биосинтез дельта-аминолевулината [len]
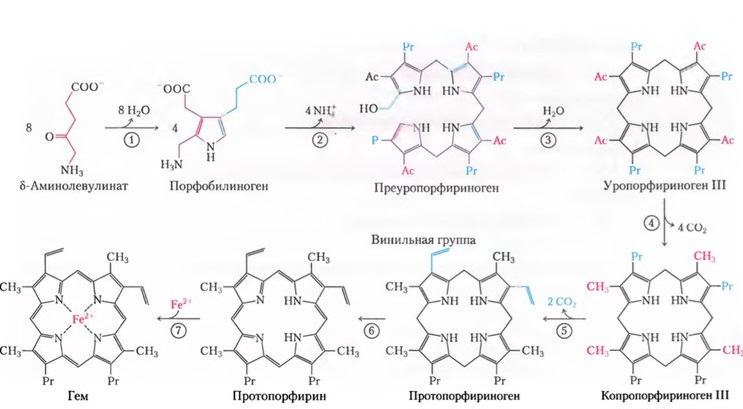
Биосинтез гема [3]
Патологии
Радиолигандные исследования позволили локализовать и изучить особенности распределения в центральной нервной системе участков связывания, которые метятся Н-стрихнином. Эти участки, имеющие Кд = 10~ М, являются рецепторами глицина. Наибольшая плотность глициновых рецепторов обнаружена в области ядер.подъязычного и тройничного нервов, локализованных в продолговатом мозге. Участки связывания стрихнина найдены также в ретикулярных ядрах продолговатого мозга, моста и среднего мозга. Серое вещество спинного мозга также отличается высокой плотностью глициновых рецепторов как в передних, так и в задних рогах. Глициновый рецептор спинного мозга млекопитающих был очищен с помощью аффинной хроматографии на аминострих-нин-агарозе. Обнаружено, что он представляет собой гликопро-теид-липидный комплекс с Мг = 250 кД, состоящий из 3 полипептидов: 48, 58, 93 кД. Стрихнин и глицин-связывающий сайт расположены на пептиде с Мг - 48 кД, который обладает способностью взаимодействовать с экзогенными лектинами. Встроенный в липосомы белок активирует транспорт ионов ОТ, который блокируется в присутствии стрихнина. Иммунохимический анализ пептидных компонентов глицинового рецептора с помощью моноклональных антител позволил обнаружить существование общих антигенных детерминант этих рецепторных белков, выделенных из разных объектов: головного и спинного мозга мышей, крыс, свиньи и человека. Более того, интересными являются данные о том, что некоторые участки глицинового и ГАМК-рецепторов иммунологиче-ски идентичны. Этот факт хорошо подтвержден генно-инженерными исследованиями. До недавнего времени предположение о существовании гомологии между нейрорецепторами I класса, т.е. быстродействующих инотропных рецепторов, выдвигалось лишь в качестве гипотезы. В последние годы одновременно в нескольких лабораториях было показано, что гены рецепторов ГАМК и глицина имеют гомологичные последовательности. Так, оказалось, что имеется примерно 50%-ная гомология между аминокислотными последовательностями а-субъединичной структуры глицинового рецептора с Мг = 48 кД и а- и р-субъединицами ГАМКА-рецептора. Обнаружена 25%-ная гомология между нуклеотидными последовательностями всех трех субъединиц н-ХР. Характерными особенностями являются высокая степень в гомологии аминокислотной последовательности и расположении трансмембранных участков М1-М4. Обязательное присутствие двух цистеинов в районе 140-150 аминокислоты на расстоянии 14 нуклеотидов друг от друга -- отличительная черта нейрорецепторов 1-го класса. Возможно, что все эти нейрорецепторы принадлежат одному семейству белков, кодируемых родственными генами.
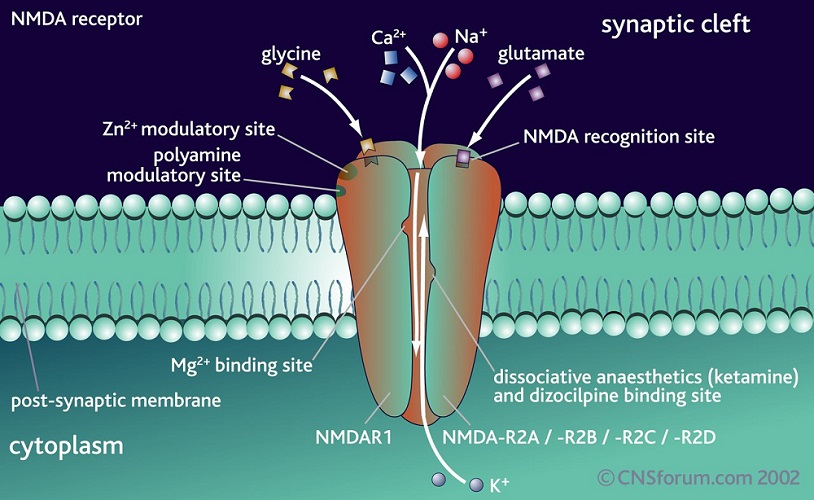
Структура рецептора глутамата NMDA и механизм работы[4]
NMDA-рецепторы состоят из ряда субъединиц сМг = 40-92 кД и легко олигомеризуются, образуя высокомолекулярные комплексы сМг = 230-270 кД. Эти белки являются гликопротеид-липидными комплексами, формирующими ионные каналы для катионов Na+, К+, Са+. Молекула глутаматного рецептора содержит большое количество гидрофобных аминокислот, которые связаны и с внутренней, и с внешней частью мембраны, организуя взаимодействие с липидами.
Рецептор NMDA имеет несколько участков, взаимодействующих аллостерически. Выделяют пять функционально различных участков, взаимодействие с которыми приводит к изменению активности рецептора:
1) участок связывания нейромедиатора;
2) регуляторный, или коактивирующий, глициновый участок;
3) участок внутри канала, который связывает фенциклидин и родственные соединения;
4) потенциал-зависимый Mg+- связывающий участок;
5) тормозной участок связывания двухвалентных катионов.
Наиболее специфический синтетический агонист этих рецепторов -- NMDA -- не обнаружен в мозге. Предполагается, что кроме глутамата эндогенными медиаторами в этих рецепторах является L-аспартат и L-гомоцистеинат. Из наиболее известных антагонистов рецепторов NMDA типа можно назвать 0-2-амино-5-фосфоновалериат' и D-2- ами-но-7-фосфоногептаноат. Более специфичны, однако, новые синтетические антагонисты: 3--пропил-Ь-фосфонат и МК-801.СРРл МК-801 - это неконкурентные ингибиторы NMDA, они не действуют непосредственно на участки связывания глутамата. Своеобразна роль глицинового участка. Глицин в концентрации ОД мкМ увеличивает ответы NMDA-рецептора, и этот эффект не может быть заблокирован стрихнином (напомним, что последний является блокатором самостоятельных глициновых рецепторов). Сам глицин не вызывает ответа, а лишь увеличивает частоту открывания канала, не влияя на амплитуду тока при действии агонистов NMDA. Наличке глицина вообще необходимо, поскольку при полном его отсутствии рецептор не активируется L-глутаматом. Самой важной функцией, которую осуществляет рецептор NMDA в ЦНС, является управление ионным каналом. Важным свойством является способность канала после связывания агониста пропускать ионы Na+ и К+, а также ионы Са+. Предполагают, что внутриклеточный Са+, концентрация которого возрастает при участии рецепторов NMDA, вовлечен в инициацию процессов пластичности развивающегося и взрослого мозга. Наибольшие токи при активации агонистами возникают при умеренной деполяризации мембраны: от -30 до -20 мВ и уменьшаются при высокой гиперполяризации или деполяризации; следовательно, ионные каналы NMDA-рецепторов являются в определенной мере потенциалзависимыми. Ионы Mg+ селективно блокируют активность рецепторов при таких сдвигах потенциалов. Ионы цинка также ингибируют ответ, но не имеют потенциалзависимого действия, очевидно влияя на другой участок связывания. К другому подтипу рецепторов глутамата -- не NMDA-pe-цепторам -- относятся, в частности, рецепторы квискваловой кислоты. Изучение последних привело к пересмотру представления о том, что действие глутамата как нейромедиатора сводится лишь к деполяризации мембраны. Многие типы глутаматных рецепторов, и в особенности рецепторы квисквалата, могут функционировать как медленнодействующие метаботропные. Они вполне соответствуют общим характеристикам метаботропных рецепторов, изложенным выше. Пептидная цепочка, составляющая их основу, содержит от 870 до 1000 аминокислотных остатков. Часть He-NMDA-рецепторов--mGlnRl--реализует сигнал через О0-белки и систему внутриклеточных посредников: инози-толтрифосфатов, диацилглицерола, ионов кальция и др. Другая разновидность метаботропных He-NMDA-рецепторов -- mGlnR2 -- реализует сигнал, подавляя синтез цАМФ или активируя синтез цГМФ.
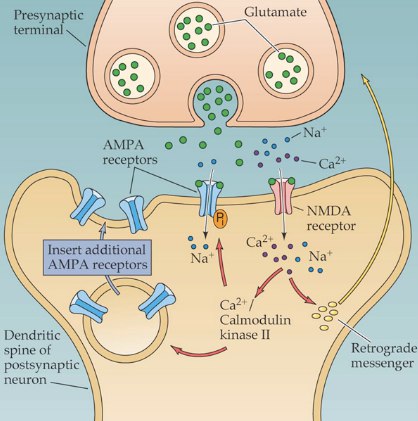
Структура синапса с АМРА- и NMDA-рецепторами[6]
Имеются сведения о том, что рецепторы этой категории участвуют в механизмах синаптогенеза и в изменениях, возникающих при деафферентации. В целом этот тип глутаматных рецепторов, как полагают, участвует в механизмах пластичности аналогично рецепторам NMDA. Но при этом активация рецепторов NMDA блокирует механизм инозитолфосфатной регуляции, связанной с He-NMDA-рецепторами, и наоборот: антагонисты NMDA усиливают действие глутамата на не-NMDA-pe-цепторы [7].
Глицин широко используется в качестве пищевой добавки, усилителя вкуса в напитках. В качестве пищевой добавки, усилитель вкуса: в алкогольных напитках, чтобы усилить аромат в сочетании с аланином.
Проявления психической дезадаптации играют важную роль в диагностике последствий стрессовых ситуаций, а методы их лечения включают широкий спектр терапевтических вмешательств. В данной работе описывается рандомизированное плацебо-контролируемое исследование эффективности и переносимости препарата «Глицин» на основе фармацевтической композиции из микрокапсулированного глицина и магния стеарата при расстройстве адаптации с преобладанием нарушения других эмоций. В группе, принимавшей глицин, 82,4% пациентов достигли выраженного улучшения по шкале CGI, тогда как в группе, получавшей плацебо, этот показатель составил 14,3%. Глицин был безопасен и хорошо переносился пациентами, никто из пациентов не был исключен преждевременно из-за нежелательных явлений. Результаты исследования подтверждают эффективность глицина и его превосходство над плацебо в данной выборке пациентов с улучшением всех измерявшихся показателей [5].

Лечение глицином обладает разнообразными положительными эффектами: пациенты с диабетом типа 2, получавшие глицин, имели более низкий уровень HbA1c и провоспалительных цитокинов, а также значительный рост IFN-гамма. Это означает, что глицин может помочь предотвратить повреждение тканей, вызванное хроническим воспалением у пациентов с диабетом 2 типа. В центральной нервной системе глицин действует как тормозной нейромедиатор, особенно в спинном мозге, стволе мозга и сетчатке. Тормозящие нейроны спинного мозга, которые высвобождают глицин действуют на альфа-мотонейроны и снижают активность скелетных мышц. Высокая концентрация глицина улучшает качество сна. В переднем мозге глицин является необходимым коагонистом вместе с глутаматом для NMDA-рецепторов. NMDA рецепторы относят к возбуждающим рецепторам (80% возбуждающих рецепторов - NMDA-рецепторы), они играют важную роль в синаптической пластичности, клеточных механизмах обучения и памяти. Недавнее исследование показало, что лечение глицином может помочь пациентам с обсессивно-компульсивным расстройством (неврозом навязчивых состояний). У пациентов с шизофренией уровни глицина в сыворотке имели отрицательную связь с интенсивностью негативных симптомов, что предполагает возможное участие дисфункции NMDA рецепторов в патогенезе шизофрении. У пациентов с обсессивно-компульсивным расстройством и у пациентов с шизофренией сывороточные уровни глицина значительно ниже по сравнению со здоровыми людьми.
[1] - Майстер А. Биохимия аминокислот /Под ред. и с предисл.: А. Е. Браунштейн ; пер. с англ.: Г. Я. Виленкина – М. : Иностр. лит., 1961 . – 530 с
[2] - http://ru-patent.info/20/05-09/2009123.html
[3] - Lehninger, Albert L., David L. Nelson, and Michael M. Cox. 2000. Lehninger principles of biochemistry. New York: Worth Publishers.
[4] - https://www.cnsforum.com/upload/imagebank/download/hrl_rcpt_sys_NMDA.png
[5] - О.В. Григорова, Л.В. Ромасенко, А.З. Файзуллоев, Т.И. Вазагаева, Л.Н. Максимова, Я.Р. Нарциссов ФГБУ «ГНЦССП им. В.П. Сербского» Минздравсоцразвития России НИИ цитохимии и молекулярной фармакологии, г. Москва
[6] - http://bethycotter.wdfiles.com/local--files/reticularsystemneurotransmission/Screen%20Shot%202012-09-04%20at%209.32.29%20PM.png
[7] - http://kineziolog.bodhy.ru/content/molekulyarnye-receptory
© Yuliia Preobrazhenskaya,I. Sabirov, M. Gladkova 2015-2016