Описание связей в белке на основании pdb-модели
Гистодеацетилаза 8 в комплексе с ингибитором
Выполняли: Школиков А. С., Якушев А. С., Перелыгин Ф. С.
Гистоны - небольшие консервативные белки эукариот, имеющие в клетке положительный заряд (сосредоточенный, в основном, на N-конце), благодаря чему способны связываться с ДНК, формируя структуры, называемые нуклеосомами. Нклеосомы укладываются в более крупные структуры, в конечном счете формируя т.н. хроматин. Степень связанности гена или отделых его участков с гистонами на прямую влияет на уровень экспрессии данного гена, в связи с чем регуляция способности гистонов связывать ДНК имеет важное значение для организма. Гистоны могут подвергаться различным модификациям, таким как метилирование, цитруллинирование, ацетилирование, фосфорилирование и др. В большинстве случаев они подавляют сродство гистонов к ДНК и к друг другу, т.к. направлены на положительно заряенные аминокислотны е остватки в составе белкоа (в первую очередь, лизин и гистидин). Большинство модификацийявляются обратимыми. Так, ацетилированныые боковые цепи лизина, лишенные положительного заряда, могут обратно деацетилироваться, позволяя гистонам крепче связываться с ДНК, снижая ее доступность для факторов транскрипции. Эту функцию выполняют белки семейства гистондеацетилаз (HDAC), котрые, впрочем, способны катализировать аналагичную реакцию не только с молекулами гистонов, но и с большинством других белков, несущих N-ацетилированные остатки лизина, в т.ч. также связывающих ДНК: p53, транскрипционных факторов [1]. Таким образом, активность гистондеацетилаз играет важную роль в регуляции функционирования генетического аппарата клетки.
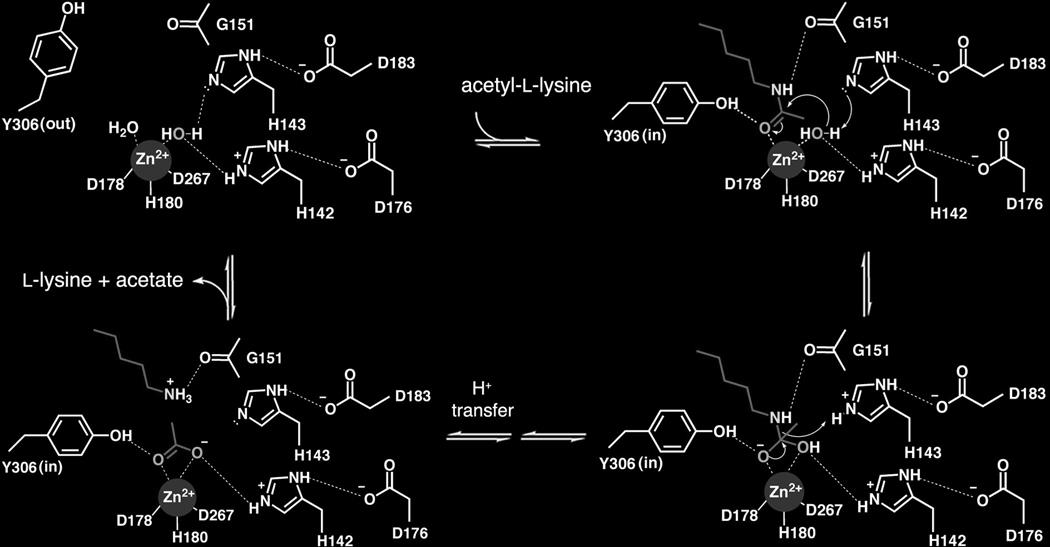
Гистондеацетилаза 8 относится к гистондеацетилазам класса I, для которых характерно наличие цинка в активном центре. Ген, кодирующий HDAC8, расположен у человека на Х хромосоме. HDAC8, по видимому, выделилась среди своих гомологов из класса I довольно рано, что указывает на обособленную функциональную специализацию [2] . У нее отсутствует С-концевой (ак 50–111) белок-связывающий домен других HDAC. Петля в непосредственной близости от активного сайта очень гибкая и может претерпевать конформационные изменения для размещения различных субстратов [3]. Активный центр устроен по общему для HDAC принципу: D267, D178 и H180 удерживают ион цинка, котроый в совою очередь вместе с H142 и H143 удерживает молекулу воды. Гистидины же образуют ионную связь с D176 и D 183. Вся система обеспечивает перенос заряда и нуклеофильную атаку молекулы воды на ацетильную группу субстрата, дополнительно стабилизируемую водородной связью с Y306. Помимо этого азот при альфа-атоме лизина субстрата дополнительно удерживается D101. В результате ацетильная группа отщепляется в виде молекулы уксусной кислоты (фактически ацетат-иона)[4] Ингибирование активного центрабудет рассмотрено ниже
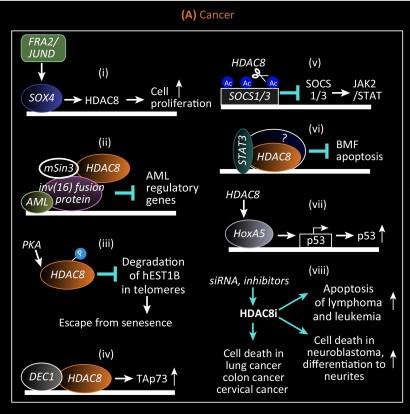
Интерес к белку привлекает то, что HDAC8 активно экспрессируется в различных раковых тканях взрослых, таких как толстая кишка, молочная железа, легкие и поджелудочная железа, а также в раковых тканях у детей, таких как нейробластома. Нокдаун HDAC8 с помощью РНК-интерференции ингибирует пролиферацию клеточных линий рака легких, толстой кишки и рака шейки матки [6 , 7] Было показано, что HDAC8 влияет на активность теломеразы, функция зависит от фосфорилирования HDAC8. Активность HDAC8 также может привести к аномальной пролиферации гемопоэтических клеток, как это наблюдается при лейкозе. Другой важный путь демонстрирует связь между HDAC8 и опухолевым супрессором p53. [7]
Также HDAC8 оказалась важной мишенью в лечении шистосомоза, паразитического заболевания вызываемого трематодой. Фермент паразитов устроен аналогично человеческому, а прием ингибиторов HDAC8 в значительной степени нарушает их жизненный цикл [7]
| UniProt ID | Q9BY41 |
| Enzyme class | 3.5.1.98 |
| Organism | Homo sapiens |
Спецификация данной модели | |
| PDB ID | 1T64 |
| Expresssion system | Spodoptera frugiperda |
| Method | X-ray diffraction |
| Resolution | 1.9 Å |
| Year | 2004 |
Связи в молекуле HDAC8
Выводы о плотности гидрофобного ядра: минимальное расстояние, на котором остаток полностью перекрывается Ван-дер-Ваальсовыми радиусами других атомов составляет приблизительно 6 ангстрем. Среднее расстояние между не связанными ковалентно атомати составляет приблизительно 4.2 ангстремБыло замерено 10 расстояний между наиболее близко расположенными атомами боковых цепей разных остатков гибдрофобных АК, входящих в ядро. Таким образом, полагая радиус атома углерода равным 1.85 ангстрем Дж. Эмсли. Элементы. 1993г, а молекулы воды - 1.4, можно сделать вывод о том, что ни вода, ни, тем более, другая более крупная структура не поместятся между соседними атомми гидрофобного ядра.
Лиганды
Благодаря большому медицинскому значению рассматриваемого фермента (точнее всей группы гистондеацетилаз) ингибиторы HDAC довольно хорошо изучены и разработано огромное количество таких веществ. В основном это конкурентные ингибиторы, блокирующие активный центр фермента. Типичный план строения таких веществ показан на рисунке 4, примеры - рисунки 5, 6. В большинстве случаев можно выделить металл-связывающий участок, ароматическую систему, вступающую в стекинговое взаимодействие с аминокислотами белка, и связывающую их углеродную цепь [8]. Есть данные об эффективности веществ, не имеющих протяженного связующего участка [9].
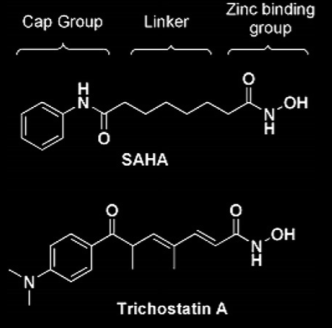
Трихостатин A
| IUPAC name | (2E,4E,6R)-7-[4-(dimethylamino)phenyl]- N-hydroxy-4,6-dimethyl-7-oxohepta- 2,4-dienamide | |
| Formula | C17H22N2O3 | |
| Molar mass | 302.374 g/mol | |
| SMILES | CC(C=C(C)C=CC(=O) NO)C(=O)C1=CC=C(C=C1) N(C)C | |
| PubChem ID | 444732 |
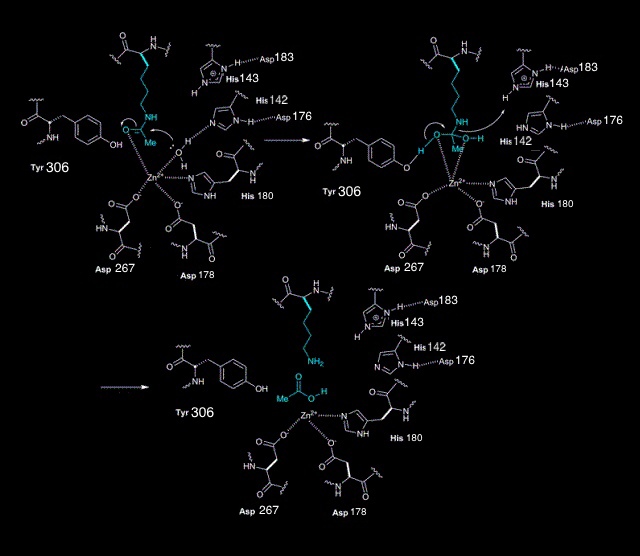
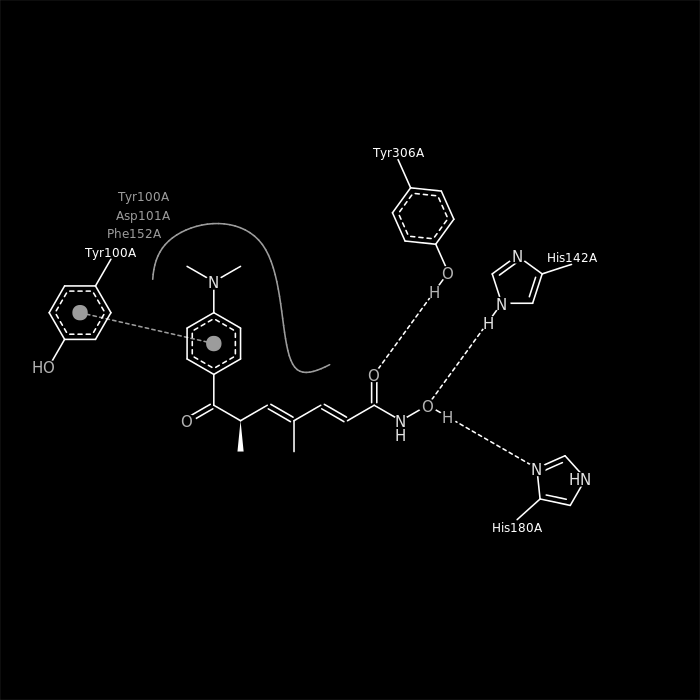
Трихостатин А является селективным конкурентным ингибитором гистондеацетилаз, связывает активный центр белка. Как говорилось выше, активный центр HDAC8, как и прочих гистондеацетилаз, содержит ион цинка, который связывается с субстратом (N-ацетилированным остатком лизина), далее с помощью системы переноса заряда с участием двух гистидинов и двух астартатаов, а так же некоторых других аминокислот окружения, ацетильная групаа отщепляется, превращаясь в ацетат. Трихостатин связывается как с самим ионом цинка, образуя хелат через два атома кислорода гидроксамовй группы. Дополнительно образуются две водородные связи с двумя остатками гистидина, один из которых входит в состав активного центра, и с одним остатком тирозина, также входящего в активный центр. Другой остаток тирозина вступает в стекинговое взаимодействие с бензольным кольцом в составе трихостатина. В итоге молекула лиганда блокирует активный центр как химически, так и стерически. Основные связи лиганда с активным центром, а также все прочие компоненты последнего, представлены на 3D-модели выше.
Ионы металлов
Помимо иона цинка в активном центре, имеется не менее двух сайтов связывания ионов металлов. Первый сайт может связывать одновалентный ион металла (калий либо натрий, причем в среде клетки калий предпочтительнее) за счет координационный связи с D176, что в свою очередь снижает pK H142 и понижает каталитическую активность фермента. Из этого следует, что для осуществления реакции H142 должен оставаться заряженным. Другой сайт находится на растоянии 21 ангстрем от первого, обладает большим сродством к иону и, напротив, повышает каталитическую способность. [4]
| Calcium | Zink | Sodium |
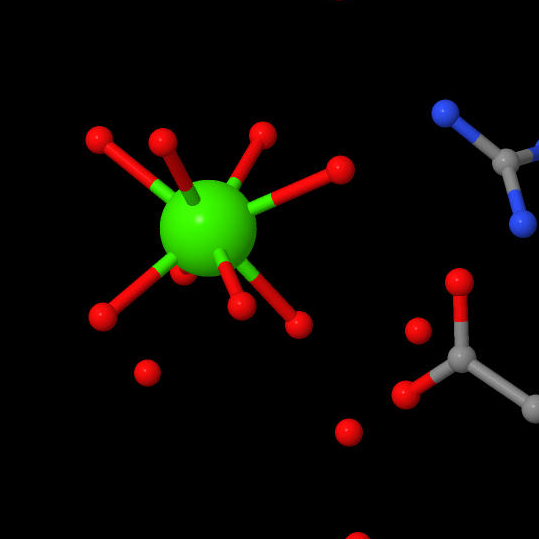 |
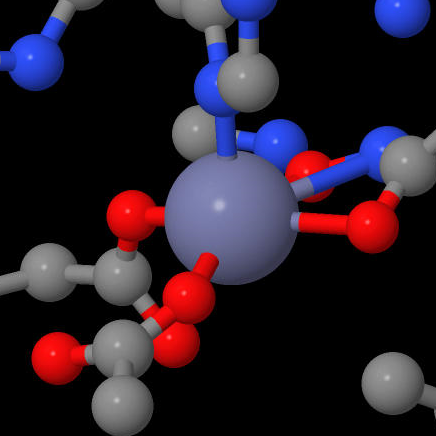 |
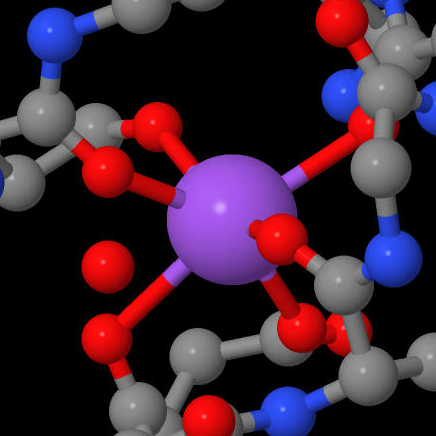 |
| Ionic | Coordinational/Ionic | Coordinational/Ionic |
- "Acetylation and deacetylation of non-histone proteins" Michele A. Glozakб Nilanjan Sengupta, Xiaohong Zhang, Edward Seto Gene, 2005
- "Molecular Evolution of the Histone Deacetylase Family: Functional Implications of Phylogenetic Analysis" Ivan V. Gregoretti, Yun-Mi Lee†, Holly V. Goodson Journal of Molecular biology, 2004
- "Structural Snapshots of Human HDAC8 Provide Insights into the Class I Histone Deacetylases" John R.Somoza et al.Cell Structure, 2004
- "Structure, Mechanism, and Inhibition of Histone Deacetylases and Related Metalloenzymes" Patrick M. Lombardi et al.Current Opinion in Structural Biology, 2011
- "Discovery, biological activity, synthesis and potential therapeutic utility of naturally occurring histone deacetylase inhibitors" Tenaya L. Newkirk, Albert A. Bowers and Robert M. Williams Natural Product Reports, 2009
- Был доступ, теперь нет - не помню, что там было
- "HDAC8: a multifaceted target for therapeutic interventions" Alokta Chakrabarti et al. Trends in Pharmacological Sciences, 2015
- "Synthesis and applications of benzohydroxamic acid-based histone deacetylase inhibitors" Rob De Vreese, Matthias D'Hooghe. European Journal of Medicinal Chemistry, 2017
- "Design and evaluation of ‘Linkerless’ hydroxamic acids as selective HDAC8 inhibitors" Keris KrennHrubec, Brett L. Marshall, Mark Hedglin, Eric Verdin, Scott M. Ulrich Bioorganic & Medicinal Chemistry Letters, 2007
- "Sulfur‐Aromatic Interactions: Modeling Cysteine and Methionine Binding to Tyrosinate and Histidinium Ions to Assess Their Influence on Protein Electron Transfer" Esam A. Orabi, Ann M. English Israel Journal of Chemystry, 2016
Техническая информация
Ссылки на скрипты:- Водородные связи
- Стекинговые взаимодействия
- Гидрофобное ядро
- Ионные связи
- Ингибирование активного центра
- Взаимодействия между цепями
Методика поиска связей:
1. Ионные связи искались выделением всех аминокислот, имеющих заряд при физиологических значениях pH (белок локализуется приимущественно в ядре, где значение pH близко к нейтральному*). Такими являются лизин, аргининин, гистидин (вменьшей степени), аспарагиновая и глутаминовая кислоты. Из них выбирались те, радикалы которых расположены на расстоянии не более 4 ангстрем и направлены друг на друга*. На модели отображены не все предпологаемые связи.
2. Стекинговые взаимодействия определялись аналогичным образом с выделением ароматических аминокислот. Для связей арматических групп с серой допустимой длиной считолсь 4 ангстрема [10]
3. Гидрофобное ядро выбиралось с помоощью покраски всех гидрофобных аминокислот модели одним цветом и визуального поиска участков с наиболее однородной прокраской.
4. Взаимодействия, определяющие четвертичныю структуру, а так же S-ароматеческие взаимодействия искались с использованием Калькулятора белковых взаимодействий
Личный вклад: Школиков Алексей - верстка сайта, скрипты про ионные, стекинговые взаимоействия, взаимодействия между цепями, структура активного центра, информация о ферменте; Перелыгин Федор - поиск и описаие гидрофобного ядра; Якушев Александр - информация по ингибиторам.