Mycoplana bullata(ramosa) - гетеротрофная, грамм-отрицательная бактерия, белок которой мы рассматриваем(PDB: 4ZUR), обитает в почве, в слабощелочной среде образует колония.[1]
Полиамины это алифатические катионы(заряженные сильнее чем +1) соединенные с нуклеиновыми кислотами и соответственно участвующие в разнообразных клеточных процессах. Функции полиаминов могут быть урегулированы путем ацетилирования и деацетилирования, также как и гистоны можно регулировать путем ацетилирования лизина и его деацетилирования. Acetylpolyamine amidohydrolase (APAX) от Mycoplana ramosa это цинк-зависимые полиамины хроматина, которые примерно на 20% идентичны аминокислотной последовательности деацетилазы гистона человека.[2]
7-Amino-N-hydroxyheptanamide | |||
IUPAC |
[7-(hydroxyamino)-7-oxoheptyl]azanium |
||
Брутто формула |
C7H17N2O2+ |
||
Молярная масса |
161.225 г/моль |
||
| PubChem | 91824280 |
||
Является мощным ингибитором деацетилазы гистонов, за счет этого останавливает жизненный цикл и запускает апоптоз целой цепочки раковых клеток.[3]
Глицерин | |||
IUPAC |
propane-1,2,3-triol |
||
Брутто формула |
C3H8O3 |
||
Молярная масса |
92.094г/моль |
||
| PubChem | 753 |
||
Катион калия | |||
IUPAC |
potassium(1+) |
||
Брутто формула |
K+ |
||
Молярная масса |
38.964 г/моль |
||
| PubChem | 813 |
||
Катион цинка | |||
IUPAC |
zinc(2+) |
||
Брутто формула |
Zn+2 |
||
Молярная масса |
65.38 г/моль |
||
| PubChem | 32051 |
||
Катион аммония | |||
IUPAC |
azanium |
||
Брутто формула |
H4N+ |
||
Молярная масса |
18.034 г/моль |
||
| PubChem | 223 |
||
Лиганды, являющиеся катионами металлов, формируют ионные связи и образуют комплексные соединения с отрицательно заряженными группами соседствующих с ними аминокислот. Ион аммония образует водородные связи с атомами кислорода в аминокислотных остатках (в JMol подобные связи не отобразились).[19]
Гидрофобный эффект - это свойство неполярных веществ собираться вместе в водных растворах, вытесняя молекулы воды.[16] Гидрофобный эффект важен для понимания структуры белков, включающих в себя такие гидрофобные аминокислоты как глицин, аланин, валин, лейцин, изолейцин, триптофан, метионин и фенилаланин, так как благодаря нему возможен фолдинг данных белков. Структуры водорастворимых белков содержат гидрофобное ядро, в котором радикалы аминокислотных остатков изолированы от воды, благодаря чему поддерживается третичная структура белка.[17] В качестве остатка MyResidue был выбран остаток PHE27. Атомы в окружении 4 ангстрем почти полностью его закрывают. Чтобы установить характерное расстояние между соседними не связанными ковалентно атомами в белке, было проведено несколько измерений, среднее значение которых составило 4,32 Å, а между границами Ван-дер-Ваальсовых радиусов – 0,62А. Атом кислорода с радиусом 1,4 А не войдет между двумя соседними атомами, и тем более молекула воды. [18]
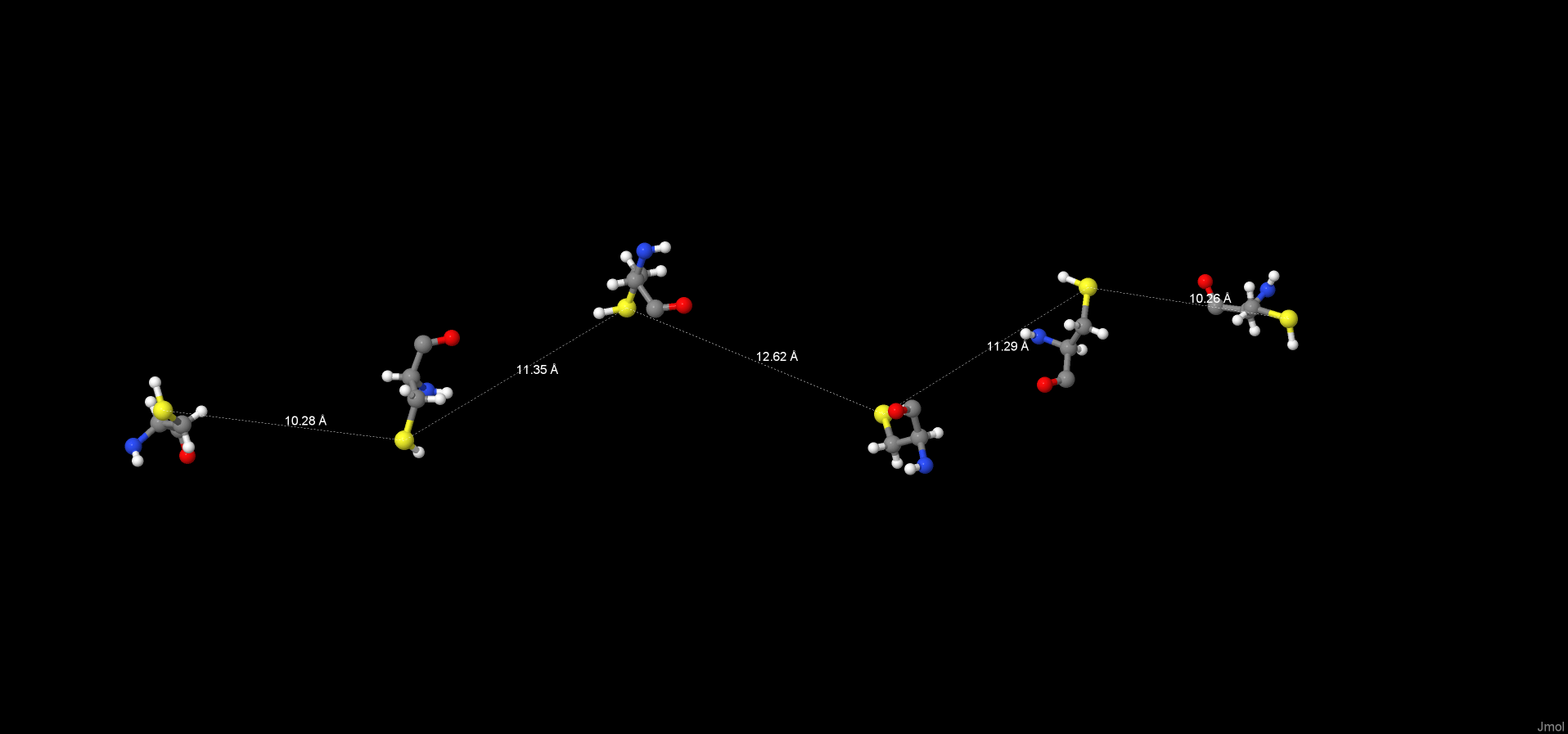
Дисульфидная связь часто образуется между двумя остатками цистеина внутри одной полипептидной цепи или между двумя полипептидными цепями, способствуя тем самым стабилизации молекулы белка.[4] Поиск дисульфидных связей производился вручную, измеряя растояние между атомами серы молекул цистеина в белке. Так как минимальное измеренное расстояние – 10.26 Å ( характерная длина связи - 2.05 Å ), образование взаимодействий данного типа не представляется возможным.[5]
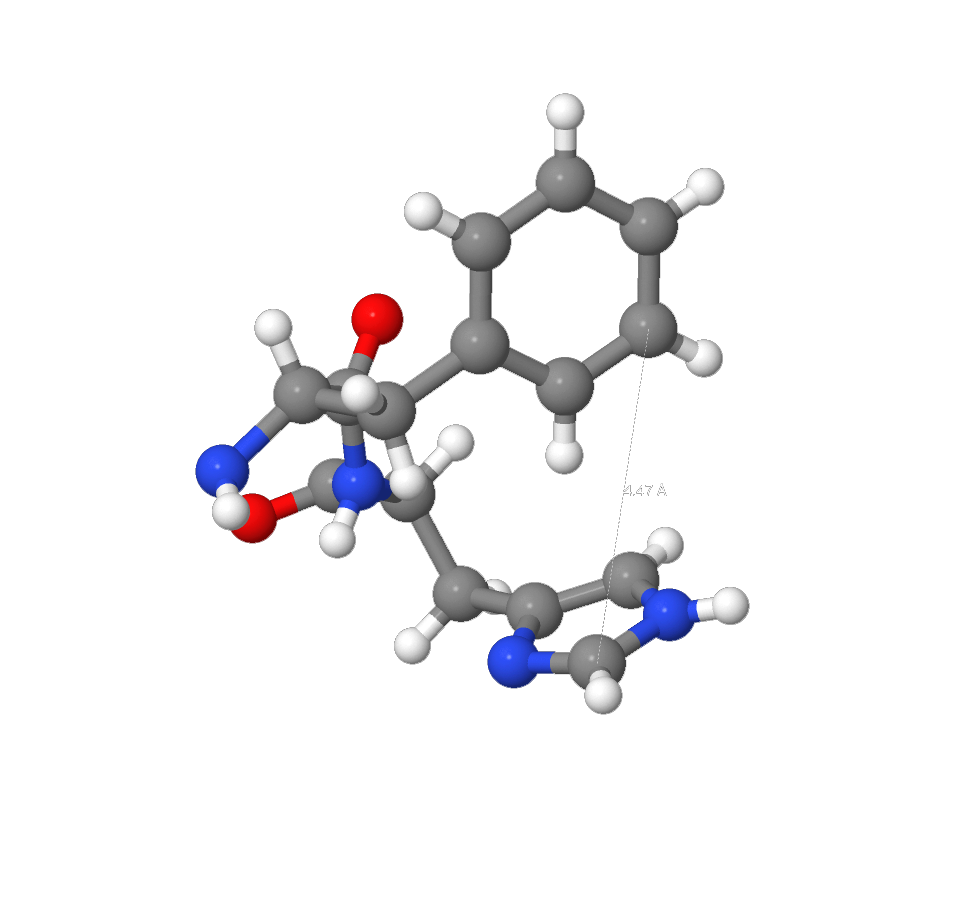
В органической химии ароматическое взаимодействие (или π-π-взаимодействие) — это нековалентное взаимодействие между органическими соединениями, содержащими ароматические компоненты. π-π-взаимодействия вызываются межмолекулярным перекрыванием p-орбиталей в π-сопряженных системах[6]. Стекинг – взаимодействия были найдены в окружении атома Zn c помощью модели окружения, размещенной на сайте pdb (также данное взаимодействие можно было обнаружить путём измерения расстояний между ароматическими структурами в Jmol9 (среднее характерное расстояние – 3.4 Å [7]). Было обнаружено взаимодействие между [HIS]196 и [PHE] 197.( я немного срезал инфы, вроде так легче воспринять )
Определение по IUPAC: Водородная связь - это связывающее (аттрактивное) взаимодействие между атомом водорода молекулы или фрагмента X-H, где X — более электроотрицательный, чем H, и атомом или группой атомов этой или другой молекулы. [8] В роли электроотрицательных атомов главным образом выступают F, O и N. В биомолекулах типичными донорами являются атомы кислорода в группах –OH (в радикалах SER, THR, TYR) и HOH и атомы азота в –NH3 (в радикалах LYS, ARG) и –NH– (как в пептидных связях между остатками или в радикалах TRP, HIS, ARG) группах. Неразделенные электронные пары этих же атомов могут позволить им быть акцепторами водородной связи. Атомы в =N- и =O группах могут выступать только в качестве акцепторов. [9] Угол N-H-O в связи в лучшем случае приближен к 180°, однако в биомолекулах разрешается погрешность ± 45° и средними считаются углы 130°-180°. [10] Водородные связи подразделяются в зависимости от расстояний между донором и акцептором на слабые (3.2-4.0 Å), средние (2.5-3.2 Å) и сильные (2.2-2.5 Å). В биомолекулах чаще всего встречаются средние значения. [10] [11] В белке 4ZUR для анализа была взята водородная связь N(109ILE)-O(105ILE) в альфа-спирали из аминокислотных остатков 104-112 цепи A. Акцептором является атом кислорода =O в составе пептидной связи. Донором – атом азота –NH– также в составе пептидной связи. Расстояние между донором и акцептором составляет 2.91 Å. Угол N-H-O равен 162.6°. Таким образом, данная водородная связь является стандартной в соответствии с данными, приведенными выше. Для определения водородных связей с помощью JMol были использованы команды calculate hbonds; restrict для выделения нужных остатков; measure для определения угла N-H-O и длины связи.
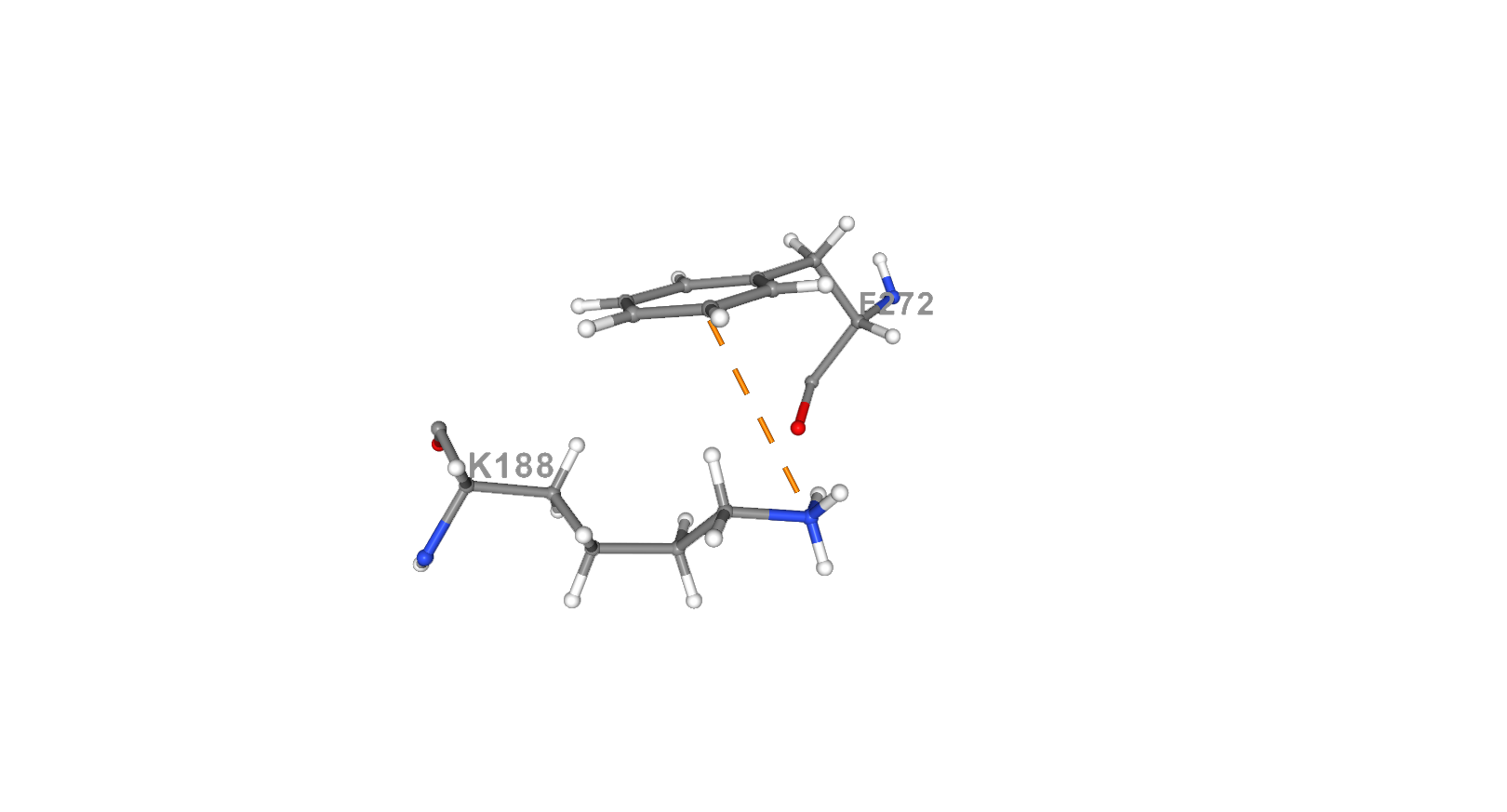
Катионные части аминокислот могут вступать в полярные взаимодействия с ароматическими кольцами других аминокислот (PHE, TRP, TYR) при сближении их на расстояние 6 Å. Такие взаимодействия называются π-катионными. Ароматические кольца имеют частично отрицательный заряд из-за делокализации π-электронов. Катионы (например радикалы LYS или ARG) выстраиваются по центру над кольцом. Такие связи вносят значительный вклад в поддержание структуры белка.[12] [13] В белке 4ZUR для анализа была взята π-катион связь [LYS]188:A.NZ- [PHE]272:A.CE2. Радикал лизина выполняет роль катиона, а кольцо фенилаланина – π-системы с отрицательным зарядом. Расстояние между катионом и π-системой составляет 5 Å, т.е. взаимодействие является эффективным. [13] Для более эффективного определения данных взаимодействий была использована программа NGL Viewer [14], а также команды restrict и measure в JMol для выделения необходимых аминокислотных остатков и измерения расстояния между катионом и π-системой соответсвенно.
Солевые мостики могут возникать между положительно заряженными группами гистедина[HIS], аргинина[ARG] или лизина[LYS] и отрицательно заряженными аспарагиновой[ASP] и глутаминовой[GLU] кислотами. Таким образом солевые мостики образуются за счет ионных связей. Образование мостиков возможно при длине связи не более 4 Å.[15] В белке 4ZUR для анализа была взят солевой мостик между [ARG]32:B.NH2 и [GLU]28:B.O. Для измерения длины связи была использована команда “measure”,а для выделения аминокислот "restrict" в Jmol.Расстояние между NH2 группой аргинина и COOH группой глутаминовой кислоты составляет 3.53 Å, т.е. взаимодействие является эффективным.
Атомы цинка играют ключевую роль в каталитической активности белка, механизм работы схож с таковым у карбоксипептидазы А. Лиганд белка аmino-N-hydroxyheptanamide(APAH) связывается двумя ионами Zn2+, причем один из ионов координируется боковыми цепями имидазола H158 и H159 и молекулой воды. Ионизация лиганда в активном центре происходит за счёт образования комплекса ZnOH+. В частности, эта структура указывает на то, что увеличивающийся отрицательный заряд тетраэдрического оксианиона стабилизируется координацией с Zn2+, а также водородной связью с Y323. Предполагается,что имидазольные боковые цепи H158, H159 связаны водородом с нуклеофильной Zn2+-связанной молекулой воды. Таким образом, Zn2+ играет ключевую роль в работе ингибитора.[2]

Предлагаемый механизм апах. Режим связывания субстрата основан на комплексе N8-ацетилспермидина с неактивным мутантом APAH H159A (код присоединения PDB 3Q9C).
[1] Mycoplana on Wikipedia [2] Carboxypeptidase A: mechanism of zinc inhibition. [3] Histone Deacetylase Inhibitor M344 Inhibits Cell Proliferation and Induces Apoptosis in Human THP-1 Leukemia Cells. [4] БИОЛОГИЧЕСКАЯ ХИМИЯ Березов Т.Т., Коровкин Б.Ф. [5] Formation and transfer of disulphide bonds in living cells [6] Rethinking the Term "Pi-Stacking" [7] Hunter & Sanders J.Am. Chem. Soc. 1990, v112, p 5525-5534 [8] Defining the hydrogen bond: An account (IUPAC Technical Report) [9] Hydrogen bonds on Proteopedia [10] Professor David A. Evans group seminar on Noncovalent interactions: An Introduction to Hydrogen Bonding (2009) [11] Jeffrey, George A., An introduction to hydrogen bonding, Oxford University Press, 1997 [12] Cation-pi interactions on Proteopedia [13] Cation-pi interactions in structural biology. [14] NGL Viewer [15] Salt bridges on Wikipedia [16] Chandler D (2005). "Interfaces and the driving force of hydrophobic assembly" [17] (Pace CN, Shirley BA, McNutt M, Gajiwala K (1 January 1996). "Forces contributing to the conformational stability of proteins" [18] Дж. Эмсли. Элементы. 1993г [19] Ligand view from RCSB PDB site
1. Иванов Михаил Перевод на английский язык, описание для водородных связей и п-катионных стекинг – взаимодействий, скрипт для лигандов. 2. Косарецкий Егор Оформление сайта, описание активного центра, солевых мостиков и лигандов. 3. Ажугим Денис Скрипт и описание гидрофобного ядра, описание п-п взаимодействий и дисульфидных мостиков.