Взаимодействия боковых цепей: солевые мостики, дисульфидные мостики
Связь цепей белка осуществляют не только водородные связи. Взаимодействия боковых цепей происходят за счёт образования "мостиковых связей". Их образование происходит за счёт разнозаряженных остатков белков (положительнозаряженные Lys,Arg и отрицательнозаряженные Asp,Glu). Например, между положительнозаряженными лизином (+1) и отрицательнозаряженной аспарагиновой кислотой (-1) могут возникнуть кулоновские взаимодействия, и образуется солевой мостик. В моём белке оказалось всего два солевых мостика, изображённых на рисунке 1.
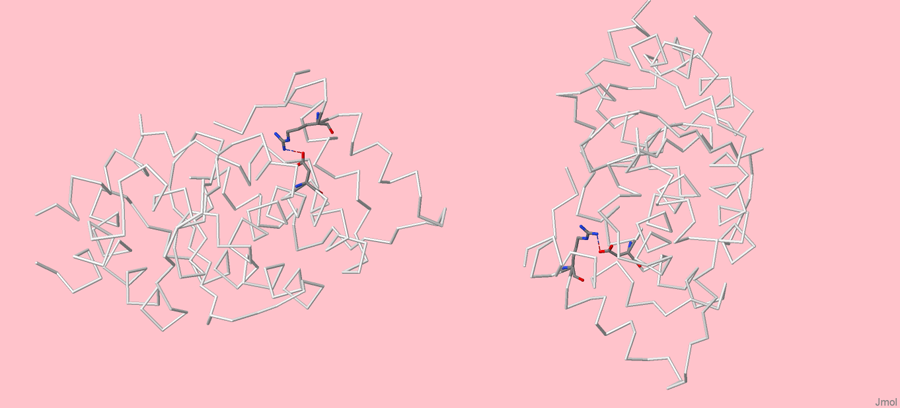
Рисунок 1. Соляные мостики в белке 3C37.
На рисунке белым цветом отмечена основная цепь белка, режимом cpk прокрашены те аминокислоты, которые образуют солевой мостик. Такое изображение Вы можете получить сами, выполнив следующие действия в Jmol'е:
1. Подготавливаем остов для более удобной работы: select all, cartoons off, cpk off, wireframe off, select backbone, wireframe 50, color white.
2. Ищем положительнозаряженные аминокислоты с помощью следующей команды: select within(GROUP,within(3.5,glu*.od? or asp*.od?) and arg*.nh? or lys*.nh?),
и выделяем их таким образом: cpk 100, color cpk, wireframe 50
3. Проделываем аналогичные действия для поиска и выделения отрицательнозаряженных аминокислот: select within(GROUP,within(3.5, arg*.nh? or lys*.nh?) and asp*.od? or glu*.od?), cpk 150, color cpk, wireframe 50
4. Выделяем две аминокислоты, между которыми будет находится соляной мостик (в данном случае это Arg214 и Asp166): select arg214:A.NH2,asp166:A.OD2
5. Строим связь: connect hbond
6. Снимаем лишние выделения (если Вам так нравится, можно оставить): select all, cpk off
7. Строим соляной мостик на второй цепи (аминокислоты расположены точно так же): select arg214:B.NH2,asp166:B.OD2, connect hbond
На рисунке 2 я выделила отдельно цепь А, чтобы показать ближе соляной мостик. Его длина оказалась равной 0,348 нм, что опять меньше 3,5 нм.
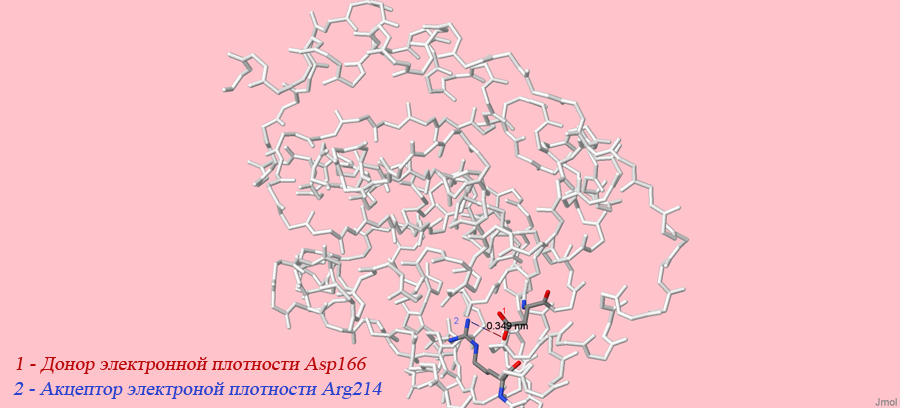
Рисунок 2. Соляной мостик на цепи А белка 3C37.
Помимо соляных мостиков, белок может образовывать и другие водородные связи. Это возможно в таких случаях, когда радикалы полярны, или заряжены. Также могут возникать взаимодействия между радиколом и остовным атомом, если он свободен. Пример такого взаимодействия представлен на рисунке 3. Здесь донором протона является аргинин 83 (а точнее атом азота в его радикале), а акцептором - аспарагин (атом кислорода в его радикале). Длина такой связи составляет 2,5 А.
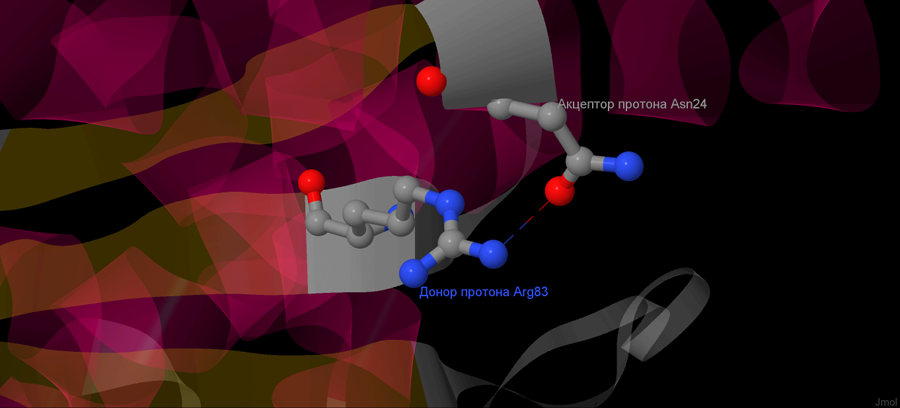
Рисунок 3. Водородная связь-мостик на цепи А белка 3C37.
Кроме разнозарядных мостиков, есть другой тип - дисульфидные мостики. Они образуются между двумя двумя атомами серы в радикалах цистеина. К сожалению, в моём белке цистеиновые мостики отсутствуют, поэтому я рассмотрела их в молекуле белка инсулина с идкетификатором 4IYD. Его структура представлена на рисунке 4.
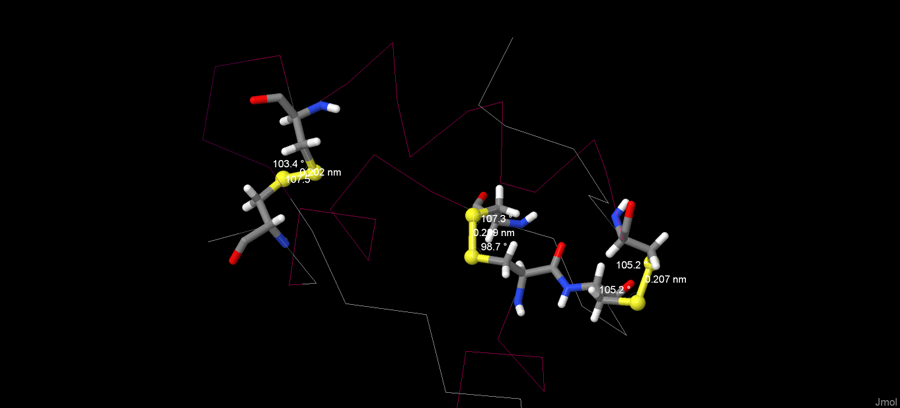
Рисунок 4. Дисульфидные мостики в белке 4IYD.
Из изображения видно, что в среднем длина дисульфидных мостиков почти не отличается - лежит в диапазоне от 0,202 нм до 0,209 нм. Углы, образованные связями, тоже примерно в одном диапазоне - около 105 градусов, и лишь слегка выбивается центральный цистеиновый мостик, где один из углов - 98,7 градусов.
Дата последнего изменения: 04.03.2014
