Мембранные белки
Анализ множественного выравнивания
Цели данного практикума: (1) проверить корректность предсказания сервиса TMHMM и (2) проверить консервативность различных частей трансмембранных белков.
Для этого сначала была составлена репрезентативная выборка гомологов желудочной H+,K+-АТФ-азы (идентификатор PDB - 4UX1). При помощи PSI-BLAST в базе RefSeq
был произведен поиск и было отобрано по 7 гомологов из каждого домена: Bacteria (за исключением Proteobacteria, Firmicutes, Actinobacteria), Archaea и Eukaryotes (за исключением Chordata).
Выбранные белки имеют маленькие значения e-value и Identity не менее 30%. Также можно посмотреть файл с последовательностями в fasta-формате и их выравнивание, построенное с помощью программы MUSCLE (изображено на рисунке 1).

Рисунок 1. Множественное выравнивание белков из репрезентативной выборки для выданного белка. Выравнивание получено с помощьюпрограммы Muscle. Рисунок получен с помощью программы Jalview, раскраска Hydrophobicity, Above Identity Threshold 20%: : синий цвет - гидрофильные аминокислоты, красный - гидрофобные.
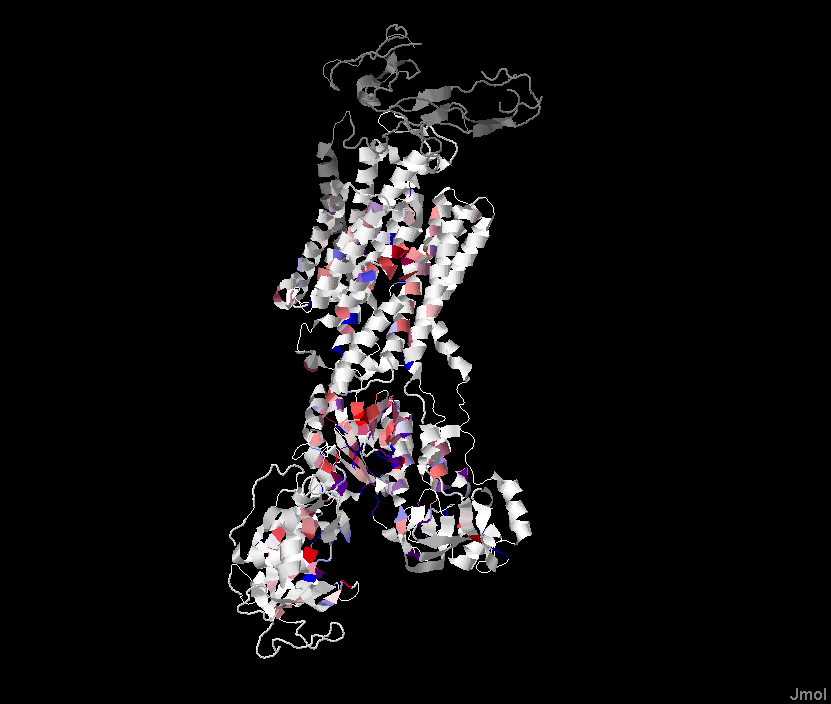
Рисунок 2. Изображение исходного белка. Цвет соответсутвует приведенному выше выравниванию, Above Identity Threshold 20%.
Для выданного белка были помечены аминокислоты ("M"), принадлежащие к трансмембранным спиралям: TM_REAL (определены по PDB структуре), и для гомолога WP_013294940.1 трансмембранные аминокислоты были определены с помощью сервера TMHMM: TM_PREDICTED. Сервер TMHMM нашел следующие 8 участков: 51-73, 77-96, 241-263, 706-728, 770-792, 807-829, 842-864, 879-895.
Исходя из выравнивания можно судить, что лишь немногие трансмембранные части консервативны, в большинстве своём они консервативными не являются. Но также можно заметить, что на месте предполагаемых трансмембранных спиралей гомологов находятся гидрофобные аминокислоты, что как раз и указывает на то, что этот участок рсположен в мембране. Среди консервативных остатков трудно выделить наиболее часто втречающиеся, но я решила, что "самые популярные" - неполярные аминокислоты, то есть глицин, аланин, валин, лейцин и изолейцин. Возможно, их присутствие объяснимо тем, что что они способствуют переносу катионов через канал (данный белок - калиевая АТФ-аза).
В данном случае программа TMHMM очень хорошо предсказала трансмембранные участки. Если по PDB-структуре было определено 10 участков, то сервер попал в 8 из них. Не совсем точно - некоторые участки определил со смещением на несколько аминокислот, другие - захватил не полностью. Возможно, это произошло из-за малого сходства последовательностей данных белков, а также из-за того, что эти белки принадлежат организмам из разных таксонов (бактерия и свинья).
Дата последнего изменения: 15.09.2013
