Вторичная структура
Задание 1. Работа с разметкой вторичной структуры в ручном режиме
В данном задании я работала со структурой 5C8T. Описание структуры и белков можно прочитать на странице практикума 6.
С помощью сервиса 2Struc для вторичной структуры белков были сгенерированы аннотации. Генерации происходила с помощью программ DSSP и STRIDE. Выдача для всех цепей представлина на рисунках ниже.

Рисунок 1.
На рисунке 1 представлены аннотации вторичной структуры цепей А и С, поскольку это цепи одинаковые. Справа на рисунке 1 можно найти расшивровку обозначений, эта расшифровка также относится к рисунку 2.

Рисунок 2.
На рисунке 2 представлены аннотации для цепей B и D.
После изучения аннотаций я выбрала наиболее интересные участки структур, которые были аннатированы DSSP и STRIDE по-разному.
Первый выбранный мной участок принадлежит цепи B. В него входят 5 аминокислотных остатков. Данный участок можно увидеть на рисунке 3. Также на рисунке 3 можно увидеть участок аннотации для данного участка. На аннотации подписан всего один номер остатка, но аннотацию для этих остатков можно идентифицировать по консенсусу, который отображен как "X".Обе программы аннотировали этот участок как поворот и продолжение 310-спирали либо альфа-спирали.
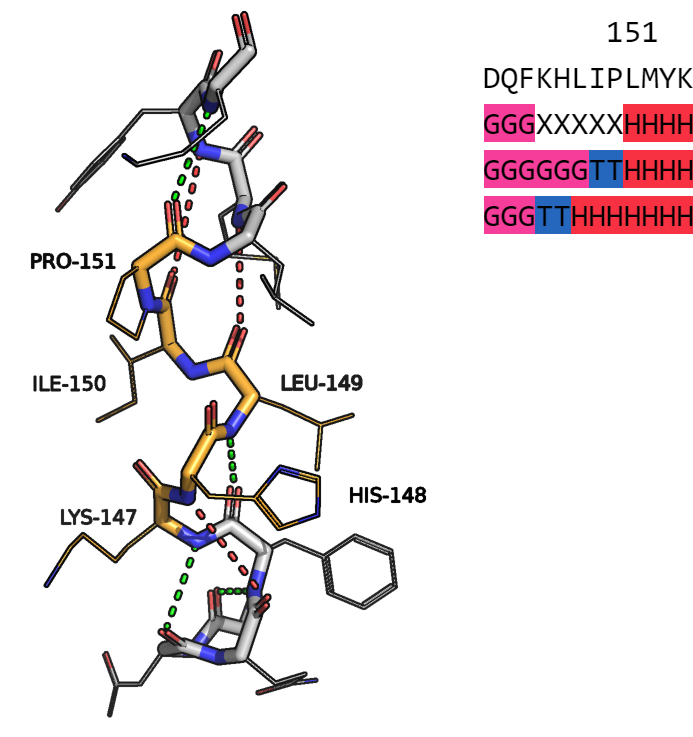
Рисунок 3.
На рисунке 3 оранжевым цветом отображены исследуемые остатки, водородные связи отображены зеленым пунктиром, а красным пунктиром отображены не существующие водородные связи, так как расстояние между атомами слишком велико или потому что нет возможности образовать данную водородную связь (азот пролина, неправильный угол). Покрутив участок структуры и подробно его рассмотрев, я пришла выводу, что я не согласна полностью ни с одной из аннотаций.
Я считаю, что лизин 147 можно считать участком 310-спирали, а пролин 151 - участком альфа спирали. Остальные три остатка: гистидин 148, лейцин 149 и изолейцин 150 относятся к повороту. Пролин может входить в любую спираль, только являясь последним с N-конца остатком, так как его азот не может образовывать водородную связь.
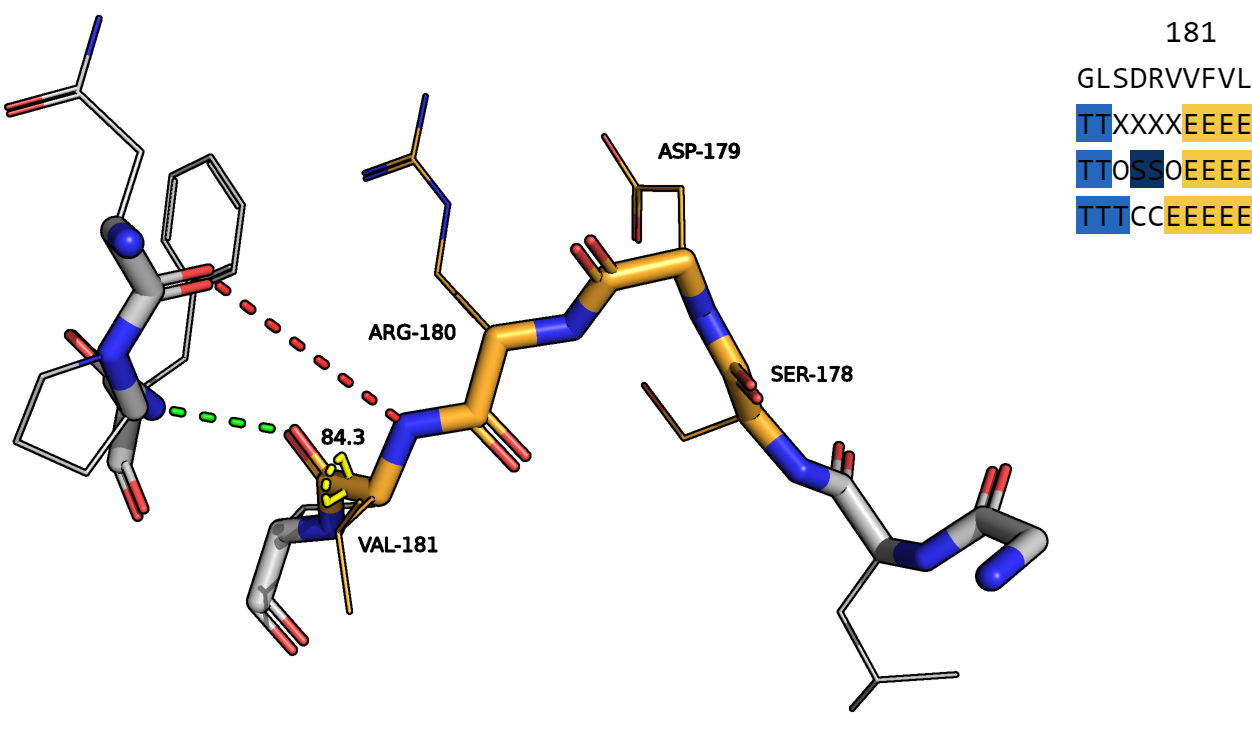
Рисунок 4.
Далее я рассматривала тоже участок цепи В. На рисунке 4 изображены оражевым цветом 4 выбранных мной аминокислотных остатка и их аннотации. Обозначения связей аналогичны рисунку 1. Желтым цветом отображен торсионый угол пси валина 181. Одна из программ посчитала, что этот остаток принадлежит бета-листу, однако ни торсионный угол, ни водородные связи, образованные данным остатком, не соответствуют структуре бета-листа. Что касается "излома", DSSP отнес к нему аспарагиновую кислоту 179 и аргинин 180. Однако, только аспартат 179 кардинально меняет направление цепи. Остатки серина 178 и аргинина 180 я бы отнесла к "другому".
Последний рассмотренный мной участок принадлежит цепи С и изображен на рисунке 5.
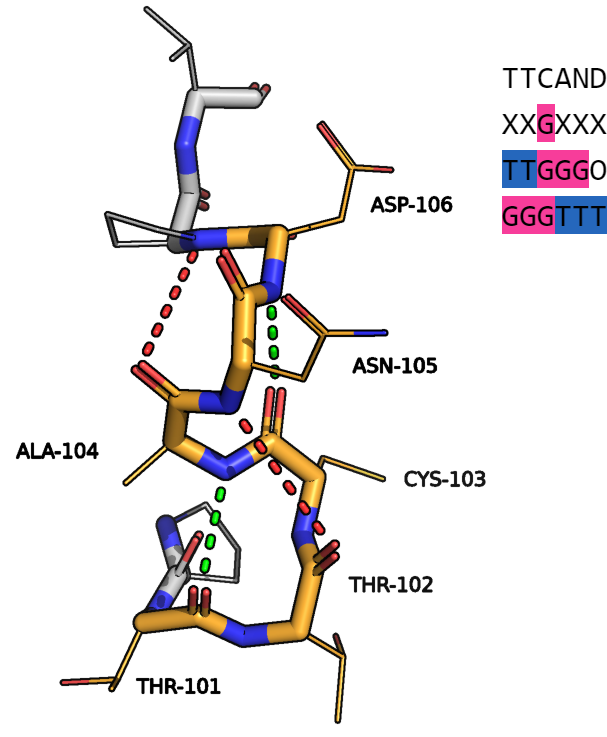
Рисунок 5.
Все обозначения на рисунке 5 аналогичны предыдущим рисункам. Этот участок похож на первый, но есть большое отличие: в первом случае аннотированные как спирали остатки были продолжениями более длинных спиралей, а здесь этот участок окружен бета-листом и альфа-спиралью. То есть обе программы решили, что на этом участке есть 310-спираль из трех остатков, но нашли её в разных местах. (В консенсусе вообще всего один остаток образует 310-спираль...) Однако, из-за напряженности структуры чаще всего 310-спирали состоят из 3-4 остатков с маленькими боковыми цепями. Либо представляют собой деформированные структуры. Нахождение программами спирали можно обяснить характерными для 310-спирали водородными связями, образованными треонином 101 и аланином 104, цистеином 103 и аспартатом 106. При этом окружающие их аминокислотные остатки не образуют характерных 310-спирали водородных связей. Кроме того, данные 6 остатков окружены двумя пролинами. Тем не менее, тут можно различить 2 спирали с общим цистеином. Выходит, структура данного участка весьма спорная. Точно можно сказать, что аспартат не является частью спирали. По факту, 310-спираль ломается из-за одной водородной связи между треонином 102 и аспарагином 105. Случай не однозначный и, по моему мнению, каждый волен определять структуру данного участка на свое усмотрение. Я считаю, что остатки 101-105 образуют деформированную 310-спираль, а аспартат относится к неопределенной структуре. Но аннотации обеих программ тоже можно расценить как верные с определенных точек зрения.
PSEA
Рассмотрев выдачи для DSSP и STRIDE, я решила посмотреть на выдачу PSEA для обсужденных выше участков струтуры. Эта программа выделяет только альфа-спирали и бета-листы. Выдача для всех трех участков представлена на рисунке 6.
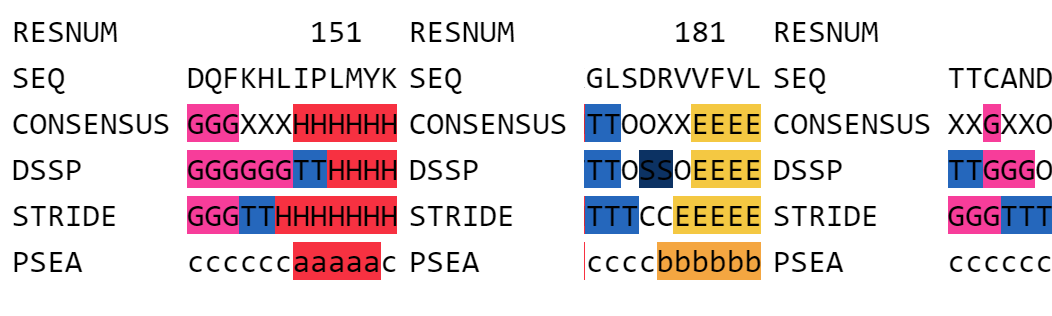
Рисунок 6.
В первом участке (рисунок 6 слева) он включил в состав альфа спирали изолейцин, который идет перед пролином. Как я уже писала выше, я считаю, что альфа-спираль начинается с пролина. Тем не менее и DSSP и PSEA включили в нее изолейцин. Возможно, это специфика разметки вторичной структуры данных алгоритмов.
На втором участке (рисунок 6 посередине), в отличие от двух других алгоритмов, PSEA включил в состав бета-листа аргинин 180. Но из рисунка 4 хорошо видно, что даже валин 181 уже не соотвествует данной вторичной структуре.
Что касается третьего участка (рисунок 6 справа), там я рассматривала 310-спираль. Поскольку PSEA выделяет только альфа-спирали и бета-листы, он определил данную вторчную структуру как "другое". Тут к нему вопросов нет.
В целом могу сказать, что выдача PSEA отличалась и от выдачи DSSP и от выдачи STRIDE. Но я не везде была согласна с его разметкой вторичной структуры.
Задание 2. Работа с разметкой вторичной структуры в автоматическом режиме
В данном задании была посчитана склонность определенных аминокислотных остатков образовывать различные вторичные структуры. Рассчеты проводились на основе 30 белковых структур. Для всех структур были сгенерированы разметки структуры с помощью dssp. Затем из полученных данных были посчитаны: количество остатков каждой аминокислоты, образующих определенный тип вторичной структруры (nik), количество остатков каждой аминокислоты в датасете (ni), количество остатков, образующих определенный тип вторичной структуры (Nk) и общее количесвто аминокислотных остатков (N). В частности в данном задании рассматривались такие типы вторичных структур, как альфа-спираль, бета-лист и петля.
Затем, на основе этих данных была посчитана propensity (склонность) каждого аминокислотного остатка к образованию определенного типа вторичной структуры. Расчеты производились с помощью python по следующей формуле: Pik = (nik/ni)/(Nk/N).
Результаты расчетов приведены в таблице 1.
| Аминокислота | Альфа-спираль | Бета-лист | Петля |
|---|---|---|---|
| Alanine (A) | 1.563 | 0.661 | 0.853 |
| Tyrosine (Y) | 0.825 | 1.773 | 0.701 |
| Methionine (M) | 0.948 | 0.971 | 1.045 |
| Serine (S) | 0.857 | 0.903 | 1.132 |
| Arginine (R) | 1.186 | 0.904 | 0.943 |
| Glutamine (Q) | 1.287 | 1.005 | 0.833 |
| Isoleucine (I) | 1.118 | 1.385 | 0.734 |
| Tryptophan (W) | 0.657 | 1.725 | 0.822 |
| Aspartic acid (D) | 0.685 | 0.371 | 1.505 |
| Threonine (T) | 0.597 | 1.398 | 1.026 |
| Glycine (G) | 0.393 | 0.489 | 1.611 |
| Lysine (K) | 1.187 | 0.947 | 0.92 |
| Histidine (H) | 0.912 | 1.062 | 1.018 |
| Proline (P) | 0.577 | 0.359 | 1.573 |
| Cysteine (C) | 0.912 | 1.181 | 0.958 |
| Leucine (L) | 1.494 | 1.125 | 0.652 |
| Asparagine (N) | 0.477 | 0.626 | 1.492 |
| Glutamic acid (E) | 1.504 | 0.668 | 0.883 |
| Valine (V) | 0.801 | 1.832 | 0.685 |
| Phenylalanine (F) | 0.766 | 1.624 | 0.812 |
В результате остатками, самыми склонными к образованию альфа-спиралей оказались аланин, глутаминовая кислота и лейцин (перечислены в порядке убывания propensity). Бета-листы более склонны образовывать валин, тирозин и триптофан. Тирозин и триптофан обладают большими радикалами, и мне кажется логичным, что они чаще всего встречаются в таких жестких структурах как бета-лист. Лидерами по склонности к образованию петель оказались глицин, пролин, аспарагиновая кислота и аспарагин (между propensity последних двух очень маленькая разница). Глицин по праву занимает первое место по склонности к образованию петель, т.к. его радикалом является водород и он очень гибкий. Второе место пролина тоже было ожидаемо: его жесткая структура упрощает поворот в петле, а в других струтурах она бы только мешала.