Задание 1. Знакомство с укладками
Для выполнения данного практикума были даны 10 структур, имеющих не более 40%
сходства по аминокислотной последовательности. Как видно на рис.1 и 2 при выравнивании девяти структур
против структуры с ID 1b4bA00 заметна схожесть их пространственной организации, однако есть и заметные отличия.
Так, явно выбивается альфа-спираль структуры с ID 2zfzD00 (с 93 по 104 позицию). Также бета-листы структур с ID
6bq9A02, 1wihA00, 3foeA02 имеют отличное от остальных структур пространственное расположение. Стоит отметить, что в структуре
3foeA02 есть неполная свободная петля и N-конец, которые не встречаются в других структурах.
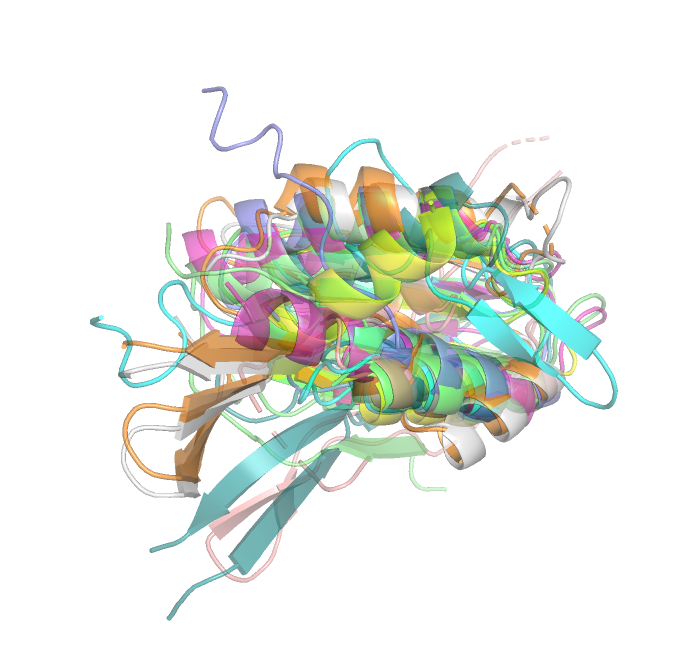
Рис.1. Выровненные структуры против структуры с ID 1b4bA00 (ракурс для сравнения прострнтсвенного расположения альфа-спиралей)
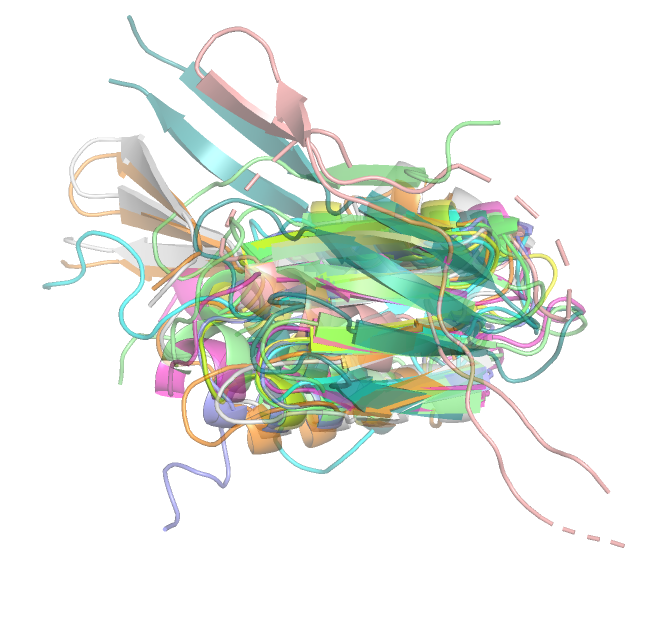
Рис.2 Выровненные структуры против структуры с ID 1b4bA00 (ракурс для сравнения прострнтсвенного расположения бета-листов)
Задание 2. Работа с разметкой вторичной структуры в ручном режиме
Для этого задания я выбрала структуры с ID 2phcB01 (розовый) и 1wihA00 (циановый). Наслоив (super) структуры друг на
друга я нашла участок, который отличается по разметке dssр: так, участок в структуре 2phcB01 с 21 по 37 аминокислотный
остаток имеет вторичную структуру альфа-спирали, а в структуре 1wihA00 с 41 по 57 участок имеет вид альфа-спирали (до 47
аминокислотного остатка) переходящей в свободную петлю (рис.3). Такое различие вполне оправдано, так как в структуре
1wihA00 пролин в позиции 44 ломает ход цепи, искривляя конец спирали.
Это сказывается на структуре, а именно в увеличении водородных связей, необходимых для образования альфа-спирали (рис.4).
Стоит упомянуть, что, по-видимому, структура 1wihA00 получена с помощью ЯМР (так как присутствуют водороды),
поэтому различия в аминокислотных последовательностях и, соответственно, вторичных структурах могут быть из-за этого.
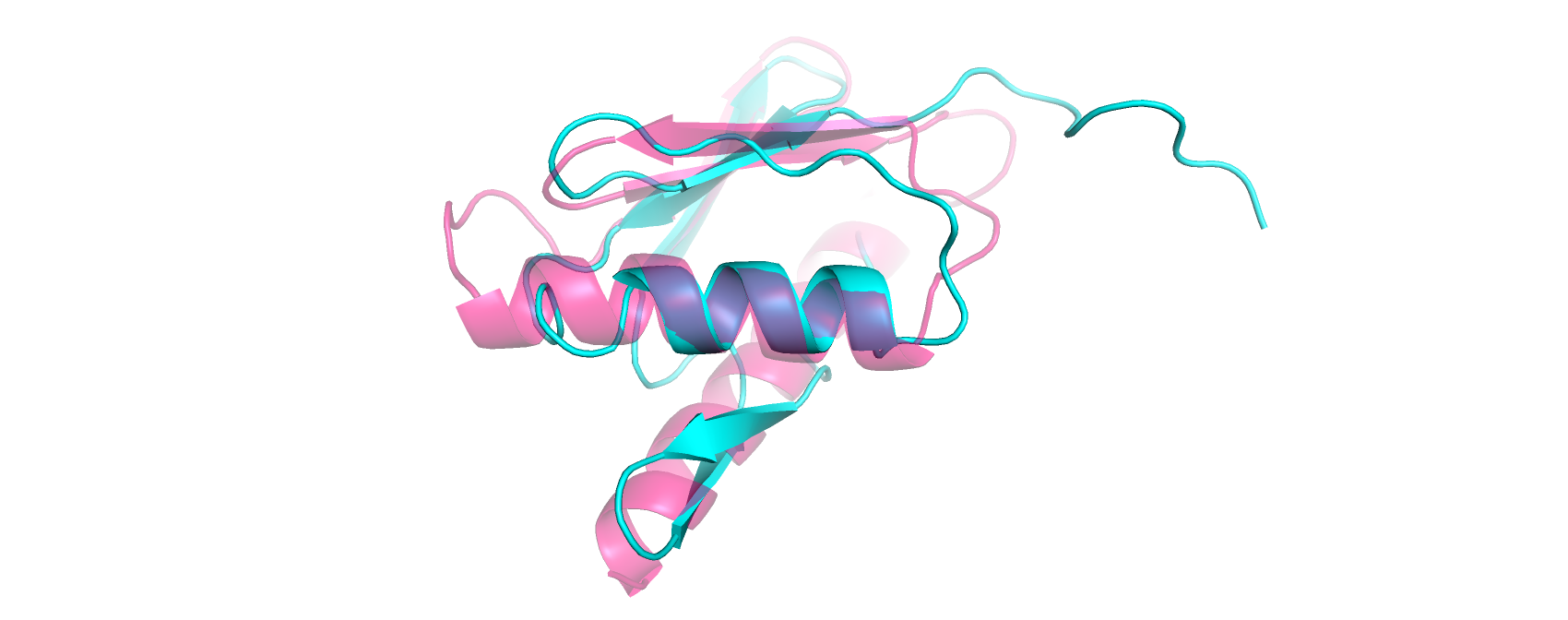
Рис.3. Структуры 2phcB01 (розовый) и 1wihA00 (циановый).
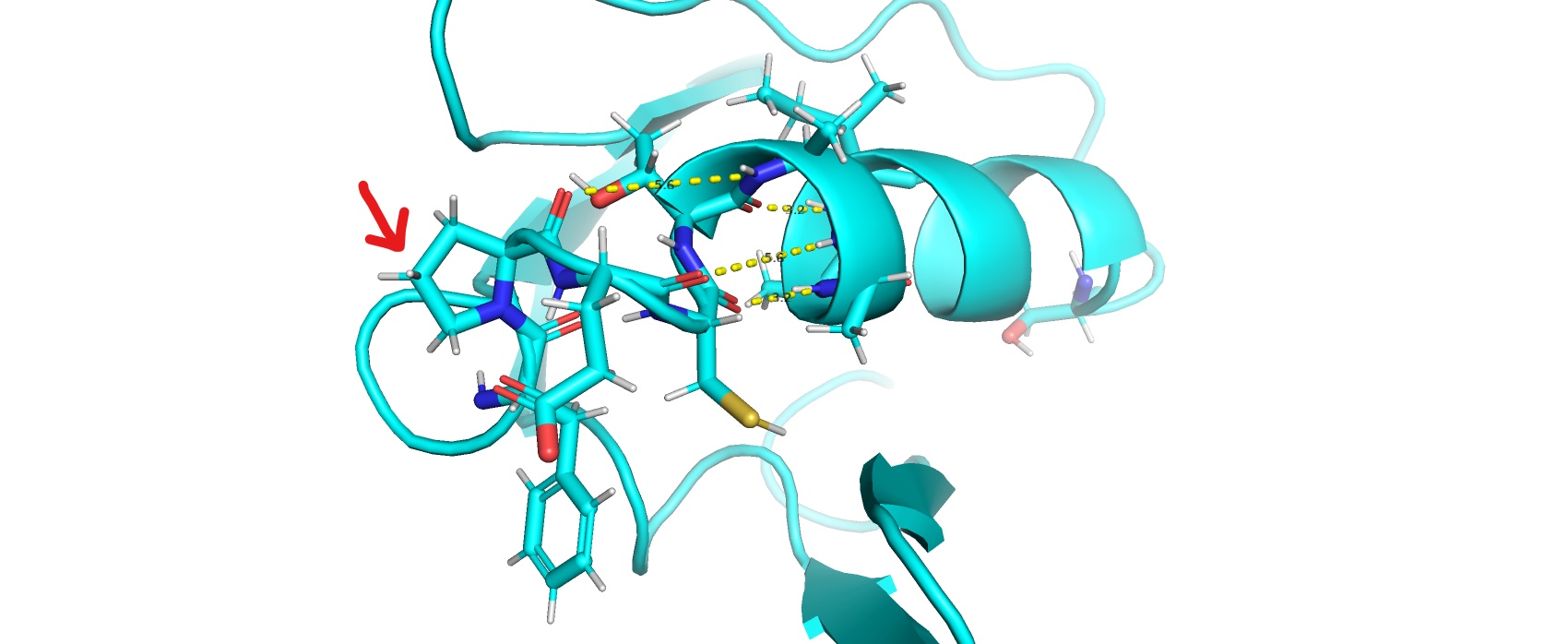
Рис.4. Участок структуры 1wihA00, из-за пролина в позиции 44 не образующий альфа-спираль
Задание 3. Работа с разметкой вторичной структуры в автоматическом режиме
Для каждого из 10 данных pdb была получена разметка вторичной структуры с помощью dssp.
Далее была рассчитана склонность каждого типа аминокислотных остатков образовывать тот
или иной тип вторичной структуры по формуле:
P_ik = (n_ik/n_i) / (N_k/N), где
P_ik это propensity аминокислотного остатка i образовывать тип вторичной структуры j
n_ik это количество остатков i в датасете, образующих тип вторичной структуры j
n_i это общее количество остатков i в датасете
N_k это общее количество остатков, образующих тип вторичной структуры j во всем датасете
N это общее количество остатков в датасете
*для расчёта псевдокаунты не добавлялись
Так, проанализировав полученную таблицу, вышло, что аланин предпочтительно участвует
в образовании альфа-спирали, чем бета-слоя или петли. Валин же больше встречается в
бета-тяжах, а глицин наиболее часто встречается в структуре петли.



