Главная страница > Третий семестр > Исследование белок-нуклеиновых контактов
Рассмотрена структура, представленая в pdb-файле 1e3m (ассиметрическая единица), и соответствующая ей биологическая единица из банка Macromolecular Structure Database EBI (единственная модель 1e3m_0). Обе структуры совпадают* (так как биологическая единица является несимметричной). Структуры содержат комплекс димера белка мисматч-репарации MutS E.coli (обе субъединицы которого идентичны) и ДНК длиной 17 н.п., содержащей мисматч GT. Субъединица A белка MutS связана с одной молекулой АДФ. Белок MutS был выделен из E.coli (для увеличения концентрации белка в клетке была внедрена плазмида, содержащая его ген). Обе цепи ДНК синтезированы искусственно. Структура получена методом рентгеноструктурного анализа с разрешением 2.2 Å.
В состав структуры вместо остатков
метионина входят остатки селенометионина (mse).
Следует отметить, что атомы селеноцистеинов описаны в полях
HETATM,
а не
ATOM, в связи с чем
селенометионины не входят в множество
protein
(команда
select protein and mse
не выделяет ни одного атома).
С помощью программы RasMol были выявлены полярные и гидрофобные контакты между белком и нуклеиновой кислотой комплекса 1e3m_0. Полярные взаимодействия были определены как взаимодействия между двумя полярными атомами (кислород, азот), находящимися на расстоянии, не превышающем 3.5 Å, друг от друга. Гидрофобные взаимодействия были определены как взаимодействия между двумя неполярными атомами (углерод и близкие к нему по электроотрицательности элементы - сера и селен), находящимися на расстоянии, не превышающем 4.0 Å друг от друга.
Текст скрипта RasMol, с помощью которого проводилось выявление белок-нуклеиновых контактов, приведен здесь (используются множества, определяемые в dna.def). Скрипт задает следующие множества:
polar_prot_drib (атомы белка, участвующие в полярных взаимодействиях с атомами кислорода остатка дезоксирибозы),
hydr_prot_drib (атомы белка, участвующие в гидрофобных взаимодействиях с атомами углерода остатка дезоксирибозы),
polar_prot_phosph (атомы белка, участвующие в полярных взаимодействиях с атомами остатка фосфорной кислоты),
polar_prot_mjg (атомы белка, участвующие в полярных взаимодействиях с атомами азотистых оснований, обращенных в большую бороздку),
hydr_prot_mjg (атомы белка, участвующие в гидрофобных взаимодействиях с атомами азотистых оснований, обращенных в большую бороздку),
polar_prot_mig (атомы белка, участвующие в полярных взаимодействиях с атомами азотистых оснований, обращенных в малую бороздку),
hydr_prot_mig (атомы белка, участвующие в гидрофобных взаимодействиях с атомами азотистых оснований, обращенных в малую бороздку),
Количество взаимодействий (количество атомов белка, участвующих во взаимодействиях) определялось путем выделения множеств, задаваемых данным скриптом (табл. 1).
* При открытии в RasMol обеих структур одновременно они полностью совпали. Кроме того, обе структуры содержат одинаковое количество атомов (количество атомов измерено с помощью команды select all).
Табл. 1. Количество атомов MutS,
участвующих в полярных и гидрофобных
взаимодействиях с различными атомами ДНК.
| Участок ДНК | Полярные взаимодействия |
|
|
Количество атомов белка, участвующих во взаимодействиях |
||
| Остаток дезоксирибозы |
|
|
| Остаток фосфорной кислоты |
|
|
| Остатки азотистых оснований, обращенные в большую бороздку |
|
|
| Остатки азотистых оснований, обращенные в малую бороздку |
|
|
Исследование комплекса 1e3m_0 показало, что белок MutS взаимодействует с малой бороздкой ДНК (количество атомов, образующих полярные контакты с атомами азотистых оснований, обращенных в большую бороздку, равно нулю). Это нехарактерно для большинства других ДНК-связывающих белков, узнающих определенные последовательности ДНК, которые, как правило, взаимодействуют с большой бороздкой ДНК (в большую бороздку обращено больше полярных атомов азотистых оснований, что упрощает узнавание последовательностей).
В гидрофобных взаимодействиях с остатками азотистых оснований участвуют два аминокислотных остатка: phe36 и mse68. Бензольное кольцо фенилаланина-36 "вклинивается" в дуплекс и располагается параллельно кольцу тимина-22 (входящего в состав мисматч-пары GT) на расстоянии около 3.8 Å от него. Вероятно, имеет место стекинг-взаимодействие между phe36 и T22. Данное взаимодействие значительно изменяет структуру дуплекса в области контакта. Фенилаланин проникает в дуплекс со стороны малой бороздки настолько глубоко, что взаимодействует и с атомами T22, обращенными в большую бороздку. Помимо атомов фенилаланина, на достаточно близком для гидрофобного взаимодействия расстоянии (3.3 Å) от тимина-22 располагается атом углерода остатка селенометионина-68 Cε.
В
неспецифических взаимодействием с остовом ДНК участвует большее количество
атомов, чем во взаимодействиях с остатками азотистых оснований. Преобладают
полярные взаимодействия с атомами кислорода фосфатов (21) и гидрофобные
взаимодействия с остатками дезоксирибозы (49). Количество взаимодействий с
кислородами дезоксирибозы значительно меньше (5). Вероятно, роль
взаимодействий с остовом ДНК заключается в фиксации молекулы и изменению ее конформации для облегчения специфического узнавания остатков азотистых
оснований.
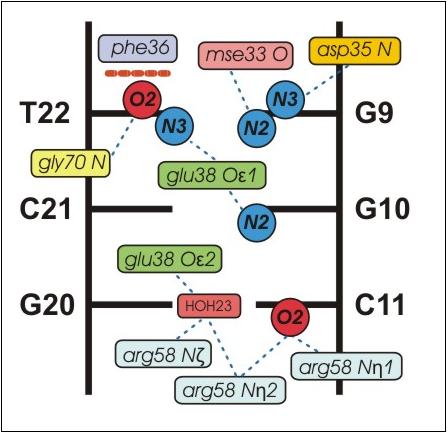
Специфичными взаимодействиями между белком и нуклеиновой кислотой считались взаимодействия, обуславливающие узнавание белком определенной последовательности ДНК. В связи с этим были рассмотрены аминокислотные остатки, образующие полярные контакты (водородные связи) с атомами остатков азотистых оснований, обращенных в малую бороздку ДНК, а также остаток фенилиланина-36. Текст скрипта, демонстрирующего данные контакты, приведен здесь (скрипт написан для pdb-файла 1e3m и использует определения из dna.def). Схема взаимодействий, приводящих к узнаванию мисматча GT белком MutS, построенная на основе изображения, генерируемого данным скриптом, приведена на рис. 1. На рис. 2 изображен специфический контакт остатка glu38 с остатком тимина мисматча и близлежащим остатком гуанина, на рис. 3 - стекинг-взаимодействие между бензольным кольцом phe36 и остатком тимина мисматча.
Представленная на рис. 1 схема специфического узнавания мисматча белком MutS согласуется с работами Natrajan et al., 2003 и Salsbury et al., 2006. В узнавании участвуют аминокислотные остатки одной из субъединиц MutS glu38, arg58, phe36, а также mse33, asp35 и gly70 (данная субъединица также взаимодействует с АДФ). Соответствующие остатки второй субъединицы во взаимодействии с ДНК участия не принимают. Во взаимодействии с белком участвуют атомы N2 и N3 гуанина мисматча, O2 и N3 тимина миматча, а также N2 и O3 соседних с мисматчем остатков G10 и C11 соответственно.
Взаимодействие с тимином мисматча осуществляется атомами glu38.Oε2 и gly70.N. Так как расположение тимина относительно гуанина в паре GT значительно отличается от расположения цитозина относительно гуанина в канонической паре GC (рис. 4), данные аминокислотные остатки могут распознавать остатки тимина мисматч пар GT. Роль стекинг-взаимодействия phe36 с тимином мисматча может заключаться в правильной ориентации тимина для взаимодействия с glu38.Oε2 и gly70.N. Взаимодействие с гуанином мисматч-пары осуществляется атомами mse33.O и asp35.N. При этом атом mse33.O образует водородную связь с аминогруппой (отсутствующей у аденина) и, возможно, распознает остаток гуанина.
Помимо специфического взаимодействия с остатками азотистых оснований мисматч-пары имеет место специфическое взаимодействие с двумя соседними остатками азотистых оснований (G10 и C11). Аминогруппа G10, как и атом N3 тимина мисматча, взаимодействует с атомом glu38.Oε2; а атом С11.O2 взаимодействует с атомами arg58.Nη1 и arg58.Nη2. При этом относительное расположение остатков glu38 и arg58 стабилизировано "водным мостиком". Возможно, при узнавании мисматча определенную роль играют и соседние нуклеотиды. В этом случае, помимо мисматча, MutS узнает прилежащую короткую последовательность 5'-GY-3' (аминогруппа N2 характерна только для гуанина, атом O2 - как для цитозина, так и для тимина). Роль специфического узнавания двух соседних с мисматчем нуклеотидов для мисматч-репарации представляется мне неясной.

Рис. 1. Схема взаимодействий, приводящих к узнаванию мисматча GT белком MutS. Атомы аминокислотных остатков, участвующие во взаимодействии, обозначены цветными прямоугольниками, взаимодействующие с ними атомы остатков азотистых оснований - кругами. Водородные связи показаны синими пунктирными линиями, стекинг-взаимодействие между phe36 и T22 - оранжевой пунктирной линией. Схема построена на основе изображения, генерируемого скриптом.
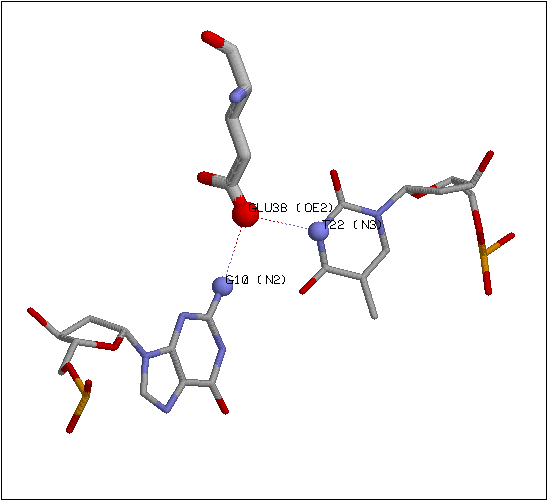
Рис. 2. Специфический контакт остатка glu38 MutS с остатком тимина мисматча и близлежащим остатком гуанина. При создании изображения использовался скрипт.
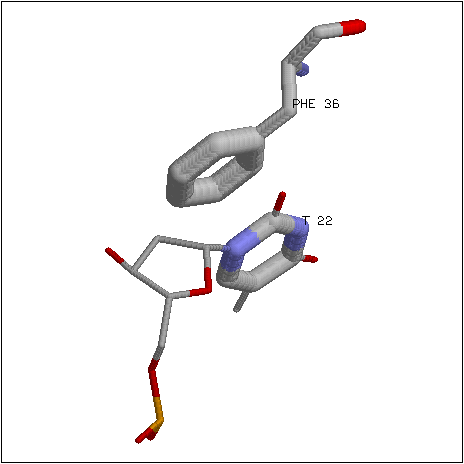
Рис. 3. Стекинг-взаимодействие между бензольным кольцом phe36 MutS и остатком тимина мисматча. При создании изображения использовался скрипт.
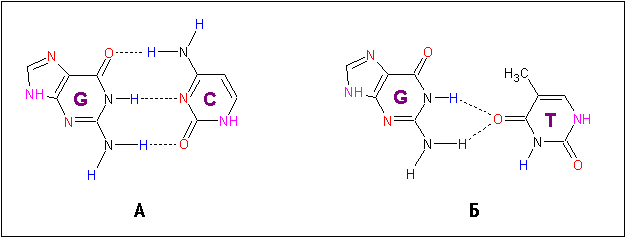
Рис. 4 (А, Б). Структуры водородных связей канонической пары GC (А) и мисматч-пары GT комплекса 1e3m (Б).
По данным документа SwissProt MUTS_ECOLI, белок MutS участвует в мисматч-репарации ДНК и осуществляет узнавание мисматчей. Кроме того, белок обладает слабой АТФазной активностью (по данным pdb-файла, одна из субъединиц MutS взаимодействует с молекулой АДФ).
По данным Pfam, белок включает в себя пять доменов PfamA (MutS_I, MutS_II, MutS_III, MutS_IV и MutS_V), причем домен MutS_IV находится внутри домена MutS_III (рис. 5). Помимо доменов PfamA в составе MutS выявлены три участка низкой сложности (low complexity), один предположительный домен PfamB и два домена SMART MutSd и MutSac, приблизительно соответствующие доменам PfamA MutS_III-MutS_IV и MutS_V. Рассмотрен домен MutS_I (номера аминокислотных остатков: 11-123), к которому принадлежат все аминокислотные остатки, участвующие в специфическом узнавании мисматча.
Домен MutS_I входит в состав белков мисматч-репарации семейства MutS (включает белки MutS прокариот и MSH эукариот), располагается вблизи N-конца и, как правило, ассоциирован с доменами MutS_II, MutS_III и MutS_IV. Множественное выравнивание Pfam 61 домена MutS_I различных белков приведено здесь (столбец выравнивания, соответствующий остатку phe36, выделен красным, столбцы выравнивания, соответствующие остаткам, взаимодействующим с ДНК боковыми группами - glu38 и arg58 - выделены зеленым, столбцы выравнивания, соответствующие остаткам, взаимодействующим с ДНК атомами остова - mse33, asp35, gly70 - выделены синим; верхняя последовательность соответствует белку MutS E.coli).
Наиболее консервативными из аминокислотных остатков, участвующих в узнавании мисматча, являются аминокислотные остатки phe36, glu38 и gly70. Остаток phe36 присутствует в 52 последовательностях из 61, еще в четырех на соответствующей позиции находятся другие остатки с ароматической боковой группой (Y, W). Остатки glu38 и gly70 консервативны в 50 последовательностях. Высокая консервативность этих трех остатков может быть объяснена тем, что они непосредственно взаимодействуют с мисматчем и, тем самым, играют решающую роль в выполнении белком его функции (белки с мутациями по этим остаткам нефункциональны, и организмы, продуцирующие такие белки, отсеиваются отбором).
Следует отметить, что глицин-70 взаимодействует с тимином мисматча атомом остова (то есть взаимодействие не связано с боковой группой остатка). Возможно, присутствие боковых групп помешало бы атому N 70-го остатка занять положение, необходимое для правильного взаимодействия с ДНК, и, тем самым, мутации по gly70 также сделали бы белок нефункциональным.
Остатки mse33 (met33) и asp35, которые также взаимодействуют с мисматчем атомами остова, менее консервативны. Например, на позиции, соответствующей 33-й позиции MutS E.coli в находятся различные остатки с длинной гидрофобной боковой цепью (M, V, L, реже K или R). Это объясняется тем, что боковая цепь этих остатков только определяет их расположение в третичной структуре белка, но не влияет на взаимодействие с ДНК.
Одним из наименее консервативных оказался остаток arg58 (36 последовательностей из 61). Как правило, он отсутствует в составе эукариотических последовательностей и присутствует в прокариотических. Так как arg58 принимает участие в специфическом взаимодействии с остатками азотистых оснований, не входящих в состав мисматча, его отсутствие в эукариотичеких гомологах MutS может быть объяснено различиями белков по выполняемым ими функцияям (скорее всего, для связывания эукариотических белков с мисматчем близлежащие аминокислотные остатки значения не имеют).
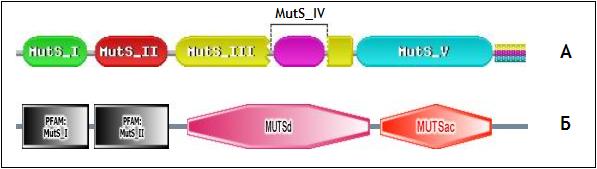
Рис. 5 (А, Б). Доменная структура MutS E.coli по данным Pfam (А) и SMART (Б).
Схема контактов между белком MutS и ДНК комплекса 1e3m_0 была построена с помощью программы nucplot. В связи с тем, что количество аминокислотных остатков в димере MutS превышает максимальное количество аминокислотных остатков, которое может обработать программа (при попытке запуска программа выдает сообщение 'too many residues'), были созданы два отдельных pdb-файла, содержащих комплексы каждой из субъединиц MutS с ДНК (использовалась команда RasMol save pdb). Для выявления контактов между A-субъединицей MutS и ДНК программа nucplot была запущена следующей командой Linux:
nucplot contA.pdb
Выдачи nucplot для субъединиц A и B приведены на рис. 6 и 7 соответственно. Количество взаимодействий, выявленных "вручную" с помощью RasMol, превышает количество взаимодействий, выявленных с помощью nucplot. Например, nucplot не выявил специфического взаимодействия акцепторного атома glu38.Oε2 с донорной аминогруппой гуанина-20 (расстояние составляет 3.1 Å, что достаточно для образования водородной связи). Возможно, это связано с особенностями алгоритма программы (атом glu38.Oε2 также образует водородную связь с тимином мисматча).
Количество выявленных с помощью nucplot полярных взаимодействий с остатками дезоксирибозы и фосфатов также значительно меньше, чем выявленных "вручную" (три вместо пяти для остатков дезоксирибозы и 12 вместо 21 для фосфатов). Это может быть связано с тем, что средствами RasMol были найдены только сближенные полярные атомы, а для образования водородной связи необходимо, чтобы один из этих атомов был донором водорода, а другой - акцептором. Однако, не были выявлены и некоторые контакты, для которых это условие соблюдается (например, между донорным атомом остова белка gly34.N и акцепторным атомом кислорода дезоксирибозы 4', расстояние между которыми составляет 3.2 Å).
В целом, специфические взаимодействия, выявленные с помощью nucplot, совпадают со специфическими взаимодействиями, выявленными "вручную" (за исключением одного контакта, см. выше). Наибольшее число взаимодействий выявлено для субъединицы A белка (в том числе все специфические взаимодействия). Субъединица B участвует в нескольких полярных взаимодействиях с кислородами фосфата. Следует отметить, что аминокислотные последовательности обеих субъединиц полностью идентичны. Таким образом, в специфическом взаимодействии с ДНК, содержащей мисматч, скорее всего, могут принимать участие обе субъединицы (выбор взаимодействующей субъединицы осуществляется случайным образом), а незадействованная субъединица при этом играет вспомогательную роль.
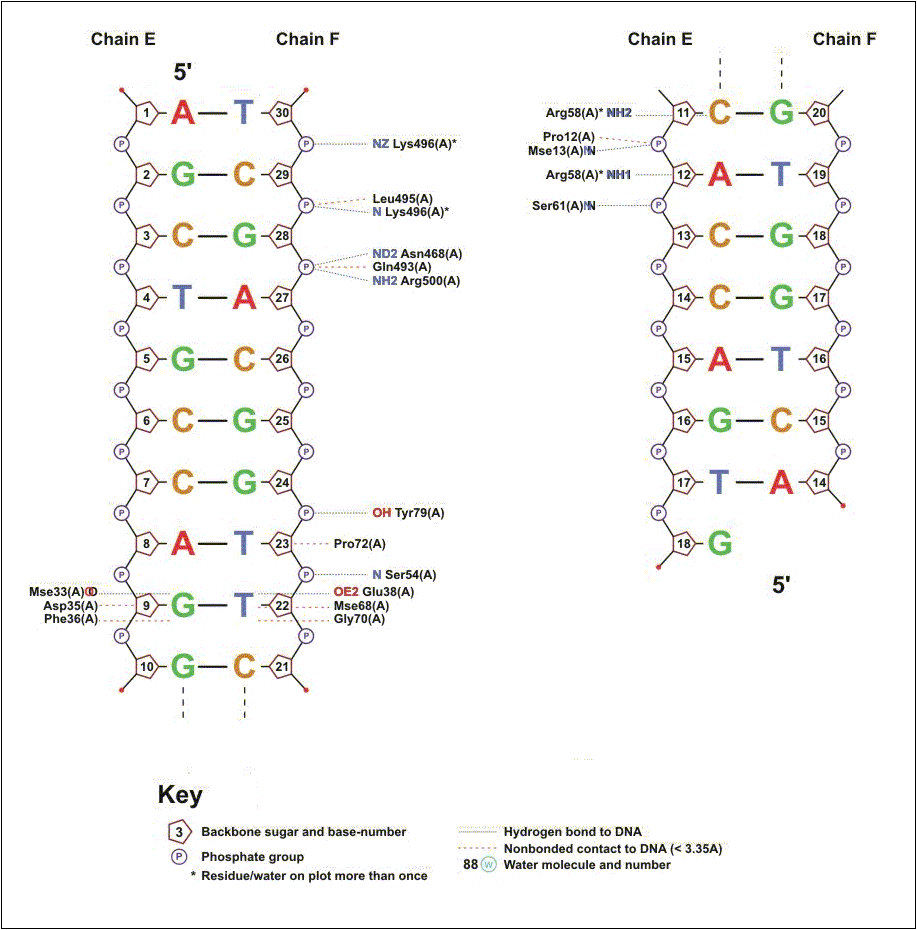
Рис. 6. Схема контактов субъединицы A белка MutS с ДНК, построенная с помощью программы nucplot.
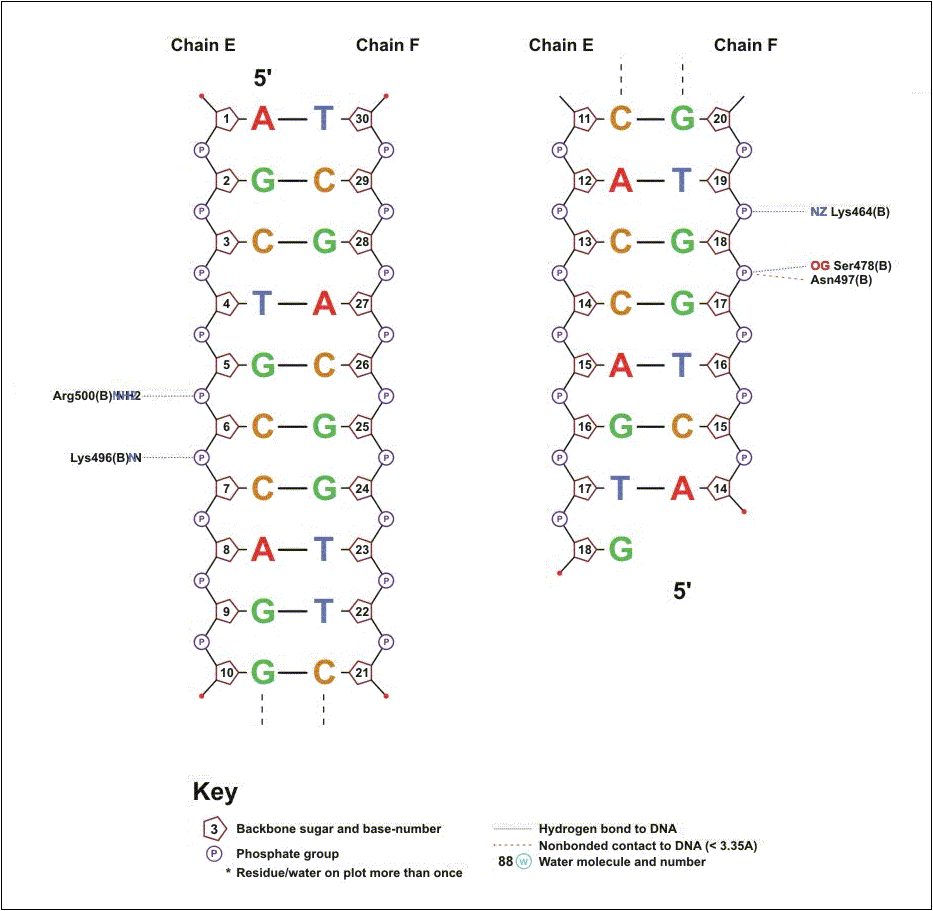
Рис. 7. Схема контактов субъединицы B белка MutS с ДНК, построенная с помощью программы nucplot.
© Куравский Михаил Львович, 2006