Практикум 8.Вторичная структура
Задание 1. Работа с разметкой вторичной структуры в ручном режиме
Для структуры PDB id 4PV0 была сгенерирована аннотация вторичной структуры с помощью сервиса 2Struc двумя алгоритмами DSSP и SFRIDE. В целом аннотации, сгенерированные этими алгоритмами, похожи. Различия в основном заключались в 1-2 остатках, которые одним алгоритмом были включены в состав вторичной структуры, а другим нет. Но я нашла 3 участка, длиной >2, имеющих различающиеся вторичные структуры согласно DSSP и SFRIDE. Рассмотрим эти участки:

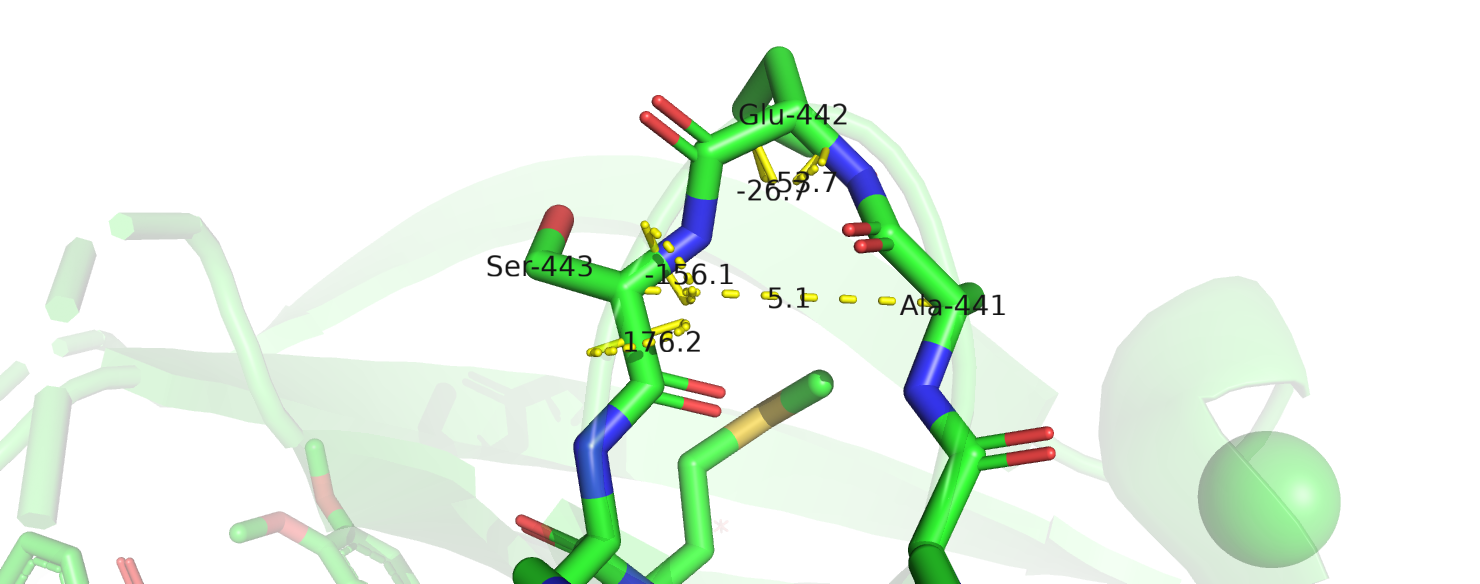
1)Позиции 441-443. Аннотации алгоритмов:
DSSP SSS
STRIDE TTT
STRIDE показал, что участок 441-443 является поворотом. Согласно [1] между –CO(i) и –NH(i+n) должна быть водородная связь,
которая здесь не образуется (рис.2). По другому определению достаточно, чтобы расстояние между Calpha атомами было меньше 7А. Оно действительно меньше,
но вот значения торсионных углов (φi+1,ψi+1,φi+2,ψi+2) не соответствует тем, которые наблюдаются в поворотах.[2]
DSSP аннотировал этот участок, как bend- изгиб. Согласно [1] в изгибе остатки не связаны водородными связями,
а угол между (Сalpha.i--- Calpha.i-2) и (Сalpha.i+2--- Calpha.i) больше 70°. В pymol можно посчитать угол между (Сalpha.i--- Calpha.i-2) и (Сalpha.i--- Calpha.i+2),
в рассматриваемом случае угол составляет 40°,
значит искомый угол (для i=442) = 140°. Т.е. участок 441-443 всё же стоит определить как изгиб.
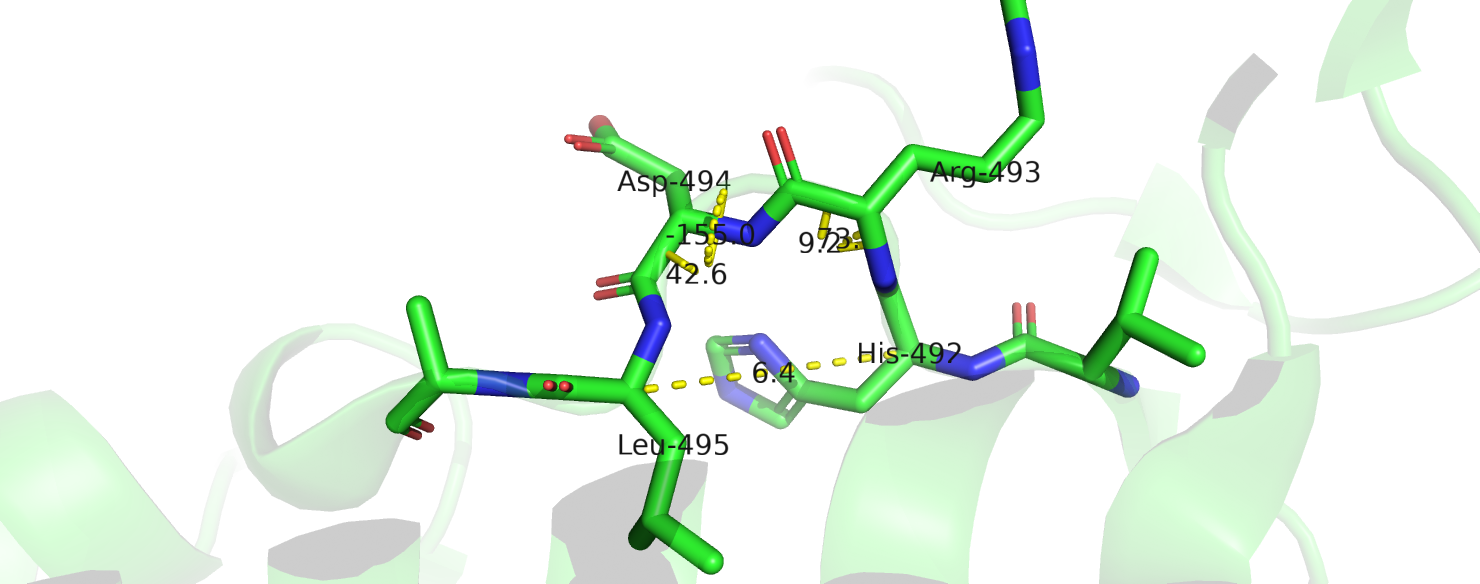
2)Позиции 492-495. Аннотации алгоритмов:
DSSP 0S00
STRIDE TTTT
На этом участке STRIDE предсказал поворот. Но водородной связи между остовом здесь не обнаружено и значения торсионных углов опять же не соответствуют наблюдаемым в поворотах.(рис.3) Угол между (Сalpha.i--- Calpha.i-2) и (Сalpha.i+2--- Calpha.i) составляет ~72°.
Поэтому в этом случае я склоняюсь к изгибу.
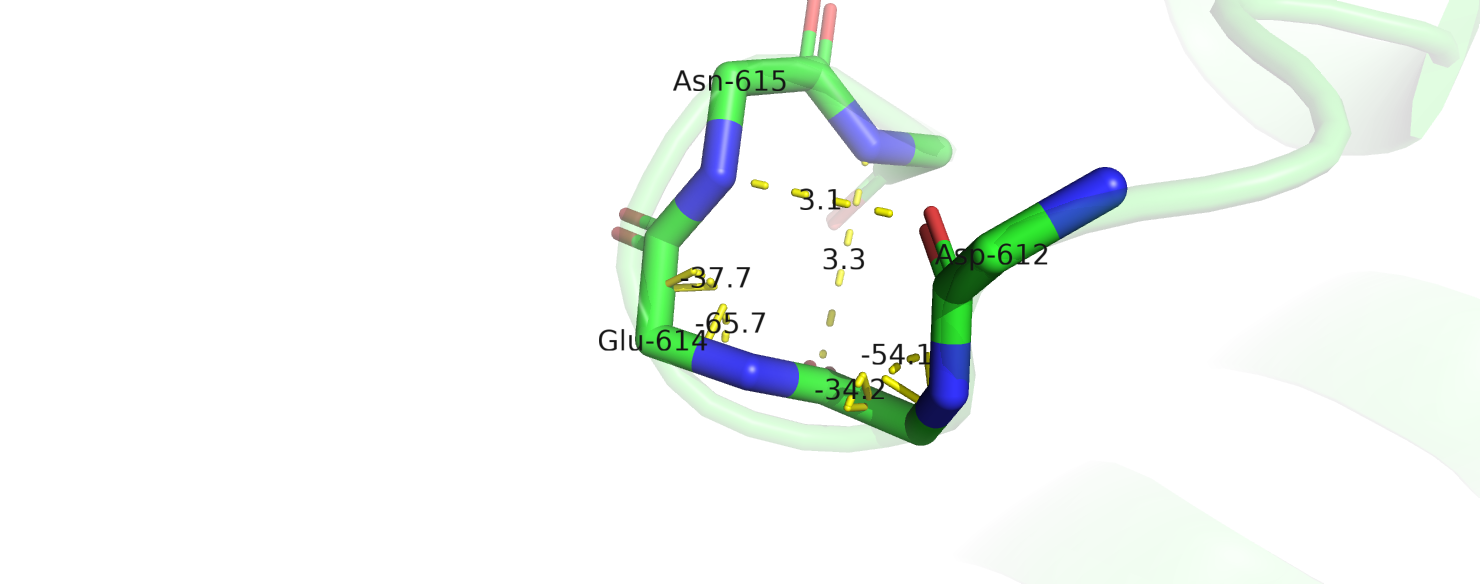
3)Позиции 613-615. Аннотации алгоритмов:
DSSP TTT
STRIDE GGG
G – 3-helix;
STRIDE разметил участок 613-615 как 3-10- спираль.(рис.4) И я соглашусь с ним, т.к. есть две водородные связи между остовом а.о. 612-615 и 613-614 и
торсионные углы похожи на характерные для 3-10-спирали.
Аннотация DSSP основывается на разметке водородных связей, в то время как STRIDE учитывает ещё и значения торсионных углов. На мой взгляд, STRIDE должен быть точнее, поскольку он использует больше данных об объекте. Так в третьем случае, DSSP аннотировал участок как поворот и оказался менее точным, поскольку не учитывал торсионные углы. В первых двух примерах DSSP аннотировал участки как изгиб, а STRIDE как поворот. Я бы объяснила это различие тем, что в STRIDE нет такой аннотации как изгиб и поворот имеет самый низкий приоритет (не считая coil/other).
Задание 2. Работа с разметкой вторичной структуры в автоматическом режиме
Для данного набора из 30 белков была проведена разметка вторичной структуры с помощью dssp. Из полученных аннотаций с помощью предложенного скрипта была выделена следующая информация о каждом остатке <номер остатка> <тип (однобуквенный)> <класс (E, H или C)>. Далее была рассчитана склонность аминокислотного остатка i образовывать тип вторичной структуры j (скрипт для рассчёта propensity здесь). В данном задании рассматривалось только 3 типа вторичных структур: бета-лист ('E'), альфа-спиралью ('H'), петля ('C'). На рис.4 приведена таблица propensity, рассчитанных по датасету из 30 белков. На рис.5 приведены барплоты propensity .
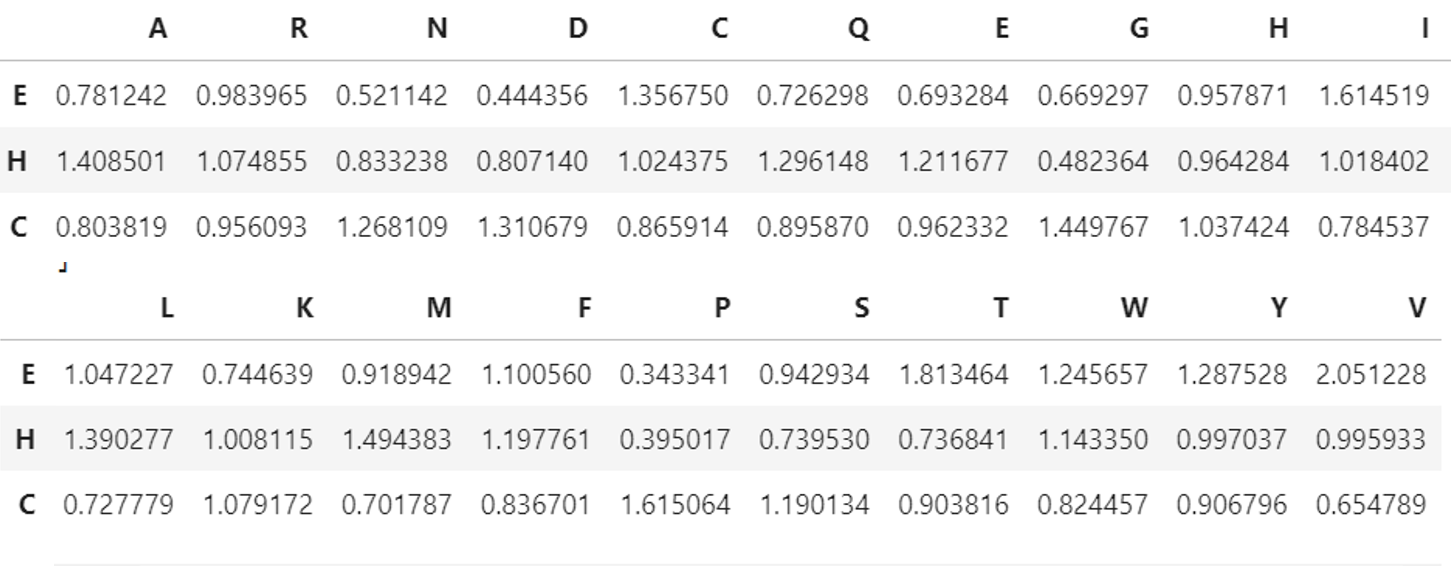
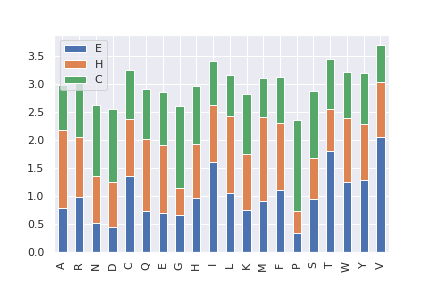
По содержанию в альфа-спирали среди аминокислот нет абсолютного лидера, в основном propensity у всех похожа, кроме пролина и глицина, у которых propensity <0.5. Валин чаще образует бета-листы, чем другие структуры. Пролин заметно чаще образует петли, чем альфа-спирали и бета-листы, т.к. его азот не образует водородную связь.


