| На главную |
|
Мои проекты | Ссылки | Обо мне | Мои заметки |
Белок MntR и его ортологи.
Описание белка MntR и его ортологов для 2х видов рода Bacillus (Bacillus thuringiensis subsp. konkukian (strain 97-27) и Bacillus cereus (strain ZK / E33L))
Ортологи — последовательности, возникшие из одного общего предшественника в процессе видообразования. Ортологи, как правило, имеют одну и ту же функцию
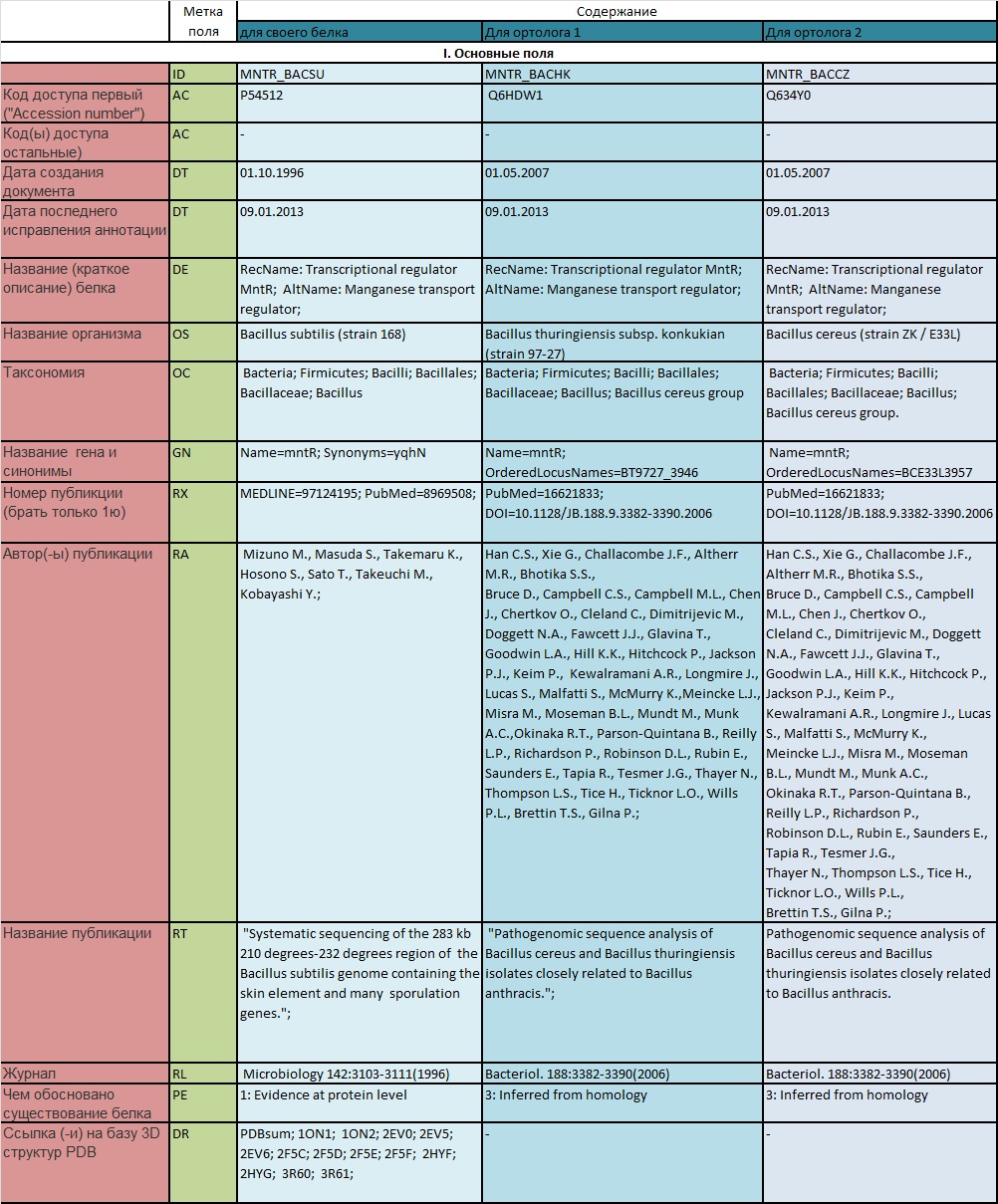
Для сравения было выбрано 2 белка-ортолога. Данные представлены в виде таблицы 1 .
Таблица 1. Сравнение белка MntR Bacillus Subtilis и двух его ортологов.
Сравнение белка и его ортологов
Оказалось, что последовательности обоих белков ортологов абсолютно идентичны. Однако, наблюдается много отличий от белка Bacillus Subtilis . На протяжении цепи есть несколько аминокислотных замен, число их учеличивается к С-концу.
Для данных белков, возможно, можно обобщить функию. Основная часть последовательности не меняется, а множественные замены на С-конце, видимо, существенно не влияют на структуру. Не происходит замены ни одной из аминокислот, учавствующих в связывании лиганда.
Данные о белке MntR Bacillus Subtilis
1. Место локализации в клетке - в цитоплазме. Чтобы белок, который синтезируется в цитоплазме, сменил свое местоположение, необходимо прицепить на него сигнальную последовательность, отвечающую за транспортировку его в назначенное место.
Например, прицепить на N-конец сигнальную последовательность для экспорта белка.
2. Чтобы повлиять на структурную целостность белка, можно внести мутацию в аминокислотные остатки, отвечающие за внутримолекулярные связи в белке. Для белка MntR Bacillus Subtilis
внутримолекулярные взаимодействия описаны Здесь . Например, заменить аминокислоты, участвующие в образовании солевых мостиков: Glu121(глутаминовая кислота)- Lys127(лизин), Glu122-Arg126(аргинин), Glu91-Arg85, Arg76-Glu7.
3. C белком связываются 2 иона Mn2+. В его связывании участвуют аминокилостные остатки гистидина (His77), глутаминовой кислоты (Glu 11 и Glu 102). Так же связываться могут ионы Cd2+[1]
[1] Статья на PubMed: "Conformational studies of the manganese transport regulator (MntR) from Bacillus subtilis using deuterium exchange mass spectrometry."