Особенности мембранных белков
В этом задании мы будете работать с отобранными мембранными белками, у которых мембранная часть представляет собой одну или несколько α-спиралей или β-баррель. Мы будем говорить о белке 3V5S. Статья о белке. PDB файл.
>3V5S:A|PDBID|CHAIN|SEQUENCE MVILGVGYFLLGLILLYYGSDWFVLGSERIARHFNVSNFVIGATVMAIGTSLPEILTSAYASYMHAPGISIGNAIGSCIC NIGLVLGLSAIISPIIVDKNLQKNILVYLLFVIFAAVIGIDGFSWIDGVVLLILFIIYLRWTVKNGSAEIEENNDKNNPS VVFSLVLLIIGLIGVLVGAELFVDGAKKIALALDISDKVIGFTLVAFGTSLPELMVSLAAAKRNLGGMVLGNVIGSNIAD IGGALAVGSLFMHLPAENVQMAVLVIMSLLLYLFAKYSKIGRWQGILFLALYIIAIASLRMGGGSLVPRGSRSHHHHHHH
Описание трансмембранных белков с известной 3D структурой
Для трех трансмембранных бета-баррелей и трех трансмембранных альфа-спиральных белков определим несколько параметров, перечисленных в Таблице 1. Будем использовать базу данных OPM или PDBTM. Толщину гидрофобной части мембраны можно измерить в Jmol (правая кнопка мыши => measure => distance). Можно использовать информацию о толщине гидрофобной части мембраны из БД OPM. Дополнительные данные об этих же белках (включая их коды TC) можно найти в базе данных TCBD.
Таблица 1. Описание трансмембранных белков с известной 3D структурой
PDB код |
Тип |
Мембрана |
Толщина гидрофобной части мембраны в ангстремах |
Медиана числа остатков в одном трансмембранном участке |
3V5S |
спираль |
Мембрана археи, Methanococcus jannaschii |
29.6 ± 1.6 A |
20 |
2WSW |
спираль |
Внутренняя мембрана, Proteus mirabilis |
29.8 ± 0.5 A |
17 |
3L1L |
спираль |
Внутренняя мембрана, Escherichia coli |
28.8 ± 1.4 A |
17 |
4EPA |
баррель |
Трансмембранный, Yersinia pestis |
23.6 ± 0.8 A |
7 |
3PIK |
баррель |
Внешняя мембрана, Escherichia coli |
24.3 ± 1.2 A |
10 |
1osm |
баррель |
Внешняя мембрана, Klebsiella pneumoniae |
24.0 ± 1.1 A |
7 |
Отбор гомологов белка 3V5S
Осуществим поиск BLAST, в качестве исходной последовательности используя структуру белка 3V5S.
При этом следует немного изменить параметры программы. Итоговый запуск:
увеличим максимальное количество хитов (max target hits), которые будет искать программа,
со стандартных 100 до 5000. В поле Organism введем название филума - Euryarchaeota, и выставим галочку напротив "Exclude",
тем самым запретим BLAST выдавать сходные белки из того же филума.
Добавим еще одно поле Organism, щелкнув на "+" справа от первого поля;
аналогичным образом исключим из поля поиска всех эукариот (Eukaryota).
Порог e-value оставим пока высоким - e-value = 9e-05. В качестве базы данных используем RefSeq -
крупную базу данных, где представлены полные геномы.
Отдельно так же запустим поиск только по филуму Eukaryota с теми же параметрами.
Результаты поиска гомологов представлены в табл.2.
Табл. 2. Организмы из разных таксонов, в которых присутствует структуру белка 3V5S или его гомологи
| Домен | Филум/Царство | Название организма | protein_id (RefSeq) |
| Archaea | •Nitrosopumilales | Nitrosopumilus sp. SJ | WP_016939661.1 |
| •Sulfolobales | Acidianus hospitalis W1 | YP_004458682.1 | |
| Bacteria | •Clostridiales | Ruminococcus lactaris | WP_023920887.1 |
| •Nitrospinales | Nitrospina gracilis | WP_005010845.1 | |
| •Spirochaetales | Leptonema illini | WP_002770140.1 | |
| •Vibrionales | Vibrio ichthyoenteri | WP_006713555.1 | |
| •Oscillatoriales | Lyngbya aestuarii | WP_023066898.1 | |
| •Actinomycetales | Nesterenkonia alba | WP_022873569.1 | |
| Eukaryotes | •Mammalia | Mus musculus | NP_444425.1 |
| •Insecta | Drosophila melanogaster | NP_001247213.1 | |
| •Eurotiale | Aspergillus oryzae RIB40 | XP_001821870.1 | |
| •Chlorophyta | Ostreococcus tauri | XP_003079066.1 | |
| •Coscinodiscophyceae | Thalassiosira pseudonana CCMP1335 | XP_002290483.1 |
FASTA-файл с последовательностями отобранных гомологов.
Анализ структуры белка 3V5S
В базе данных OPM найдем информацию о белке 3V5S. ТС-код можно найти на сайте TCBD. Полученный данные представлены в табл.3.
Таблица 3. Описание структуры трансмембранного белка Sodium/Calcium Exchanger from Methanococcus jannaschii (идентификатор PDB 3V5S, цепь A)
PDB ID |
Организм |
Тип мембраны |
ТС-код |
Угол наклона спиралей (α-тяжей) к нормали |
Количество трансмембранных спиралей |
3V5S |
Methanococcus jannaschii |
Archaebacterial membran |
2.A.19.5.3 |
1 ± 2° |
10 |
Для начала объясним, как строится TC-код:
обычно он состоит из пяти компонентов следующим образом: VWXYZ,
где V - (число)
соответствует классу транспортера;
W (БУКВА) соответствует подклассу транспортера, который в случае первичных активных
переносчиков относится к источнику энергии, используемой для управления транспортом;
X (число) соответствует семье транспортера (иногда на самом деле надсемейству);
Y (число) соответствует подсемейству, в котором находится транспортер,
а Z соответствует определенному транспортеру с определенным субстратом.
Опишем, что означают для белка 3V5S каждое из полей его TC-кода 2.A.19.5.3
2: Electrochemical Potential-driven Transporters
Вторичные переносчики операторского типа. Транспортные системы включены в данную категорию,
если они используют перевозчико-опосредованный процесс для катализа
унипорта, антипорта и / или симпорта.
2.A Porters (унипортеры, симпортеры, антипортеры)
2.A.19 The Ca2+:Cation Antiporter (CaCA) Family
Антипорт — два или более вещества транспортируются в противоположных направлениях в результате тесно
связанного процесса, который не связан напрямую ни с одной из форм энергии, кроме хемиосмотической.
Анализ множественного выравнивания трансмембранных белков
Выравним последовательности гомологов трансмембранного белка 3V5S в программе
MUSCLE и загрузим полученное выравнивание
в программу JalView (см. рис.1).
Выберем цветовую схему (в меню Colour), которая позволит визуально различать гидрофобные и
гидрофильные остатки (Hydrophobicity: гидрофобные остатки выделены красным цветом).
Порог by Conservation - 25%
(Полное изображение выравнивания доступно при клике на картинке)
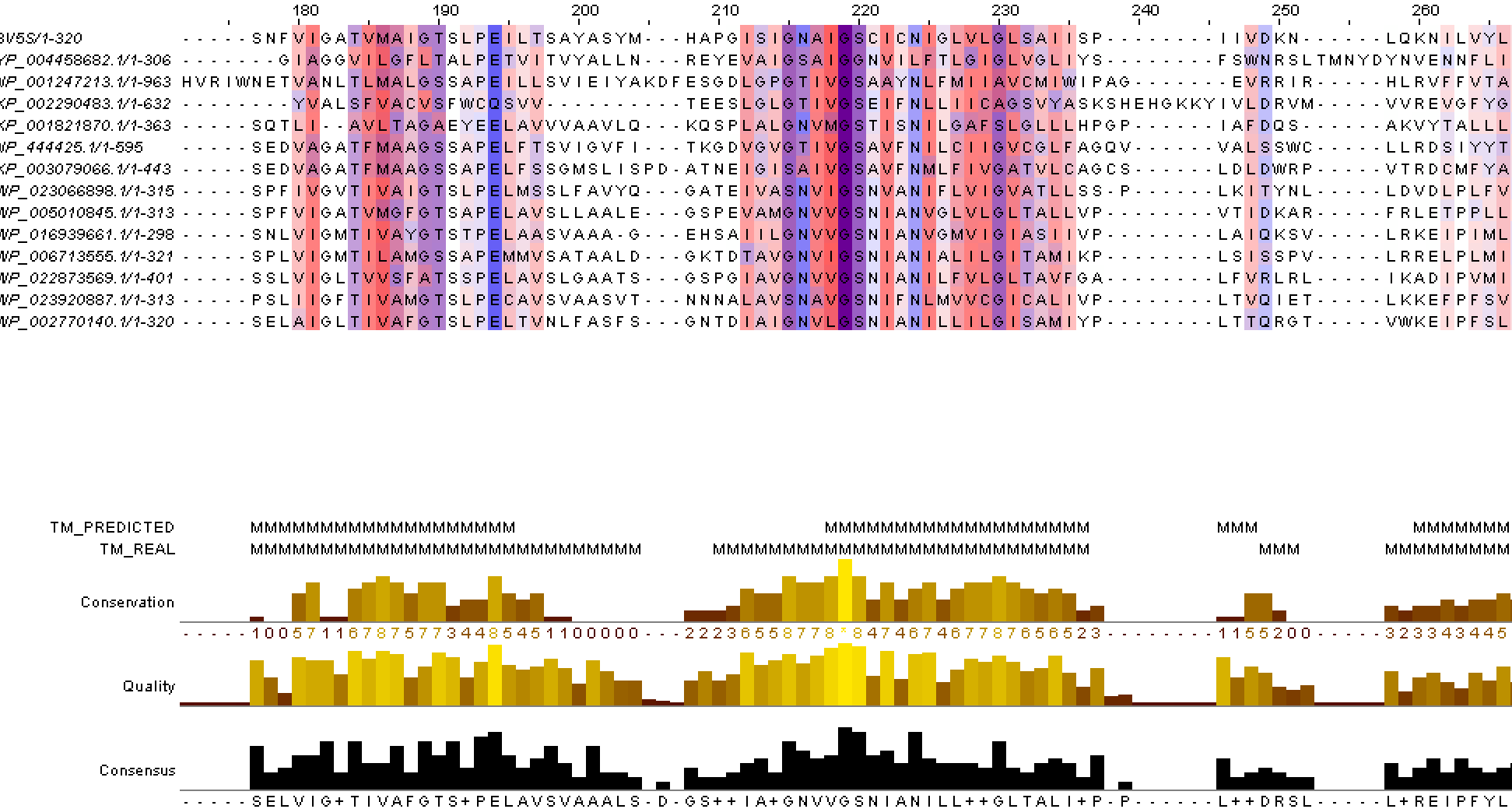
На рис.1 в строке аннотации "TM_REAL" помечены участки выравнивания, отвечающие трансмембранным спиралям в белке 3V5S буквой "М". Для последовательности гомолога WP_022873569.1 получено предсказание трансмембранных спиралей, выдаваемых программой TMHMM. В строке аннотации "TM_PREDICTED" помечены буквой "М" участки, предсказанные TMHMM.
Белок расположен так, чтобы его часть, ориентированная в n-сторону мембраны оказалась сверху, а ориентированная в p-сторону - снизу.
(Увеличенное изображение доступно при клике на картинке)
Заметим из рис.1 и рис.2, что участки, относящиеся к трансмембранным спираляи
достаточно консервативны. Чаще всего встречаются неполярные остатки. Трансмембранные участки действительно в основном из гидрофобных остатков.
Самые консервативные позиции:
- 50 Thr (Ser)
- 76 Gly, 77 Ser
- 208 Gly, 209 Thr, 210 Ser
- 212 Pro
- 235 Gly, 236 Ser, 237 Asn
- 246 позиция по 3V5S (Gly во всех, кроме 3V5S - Ala)
Критерии отбора в консервативные позиции - менее 3-ех замен в позиции, причем замены не сильно отличаются функционально. Или более 2-ух замен, но консервативны функционально (полярные/неполярные).
В то время как в участках между спиралями не наблюдается консервативности.
Посмотрим, насколько совпадают нанесения результатов программы TMHMM и реальной
структурной информации на выравнивания.
(координаты представлены по белку WP_022873569.1)
- c 27 Ala 32 Lys (не хватает части последовательности в середине трасмембранной спирали)
- 95 Leu 97 Val (лишний участок)
- 120 Ala 121 Leu (лишний участок)
- 233 Gly 234 Thr (не хвататет участка в середине трасмембранной спирали !!! Интересно, что этот участок является консервативным у всех остальных последовательностей)
- c 344 Phe 366 Tyr (лишнее предсказание)
В остальном предсказанная вторичная структура очень хорошо коррелируется с реальной.

