Внутримолекулярные взаимодействия в структуре YXIM
Общая характеристика структуры YXIM
- Идентификатор PDB: 2O14
- Название белка: гипотетический белок YXIM (hypothetical protein YXIM)
- Количество цепей: 1 (цепь А)
- Дополнительные молекулы:
- Сульфат-ион (SO42-)
- Ион марганца (Mn2+)
С помощью программы JMol я получила изображение 3D модели белка (рис.1).
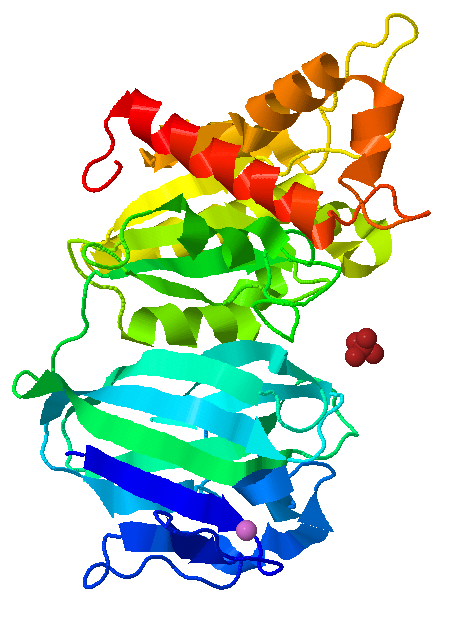
|
| Рис.1 Трёхмерная модель белка. N-конец обозначен синим цветом, C-конец - красным. Сиреневым цветом выделен ион марганца, коричневым - сульфат-ион. |
Анализ структуры α-спиралей и β-листов в цепи А белка YXIM
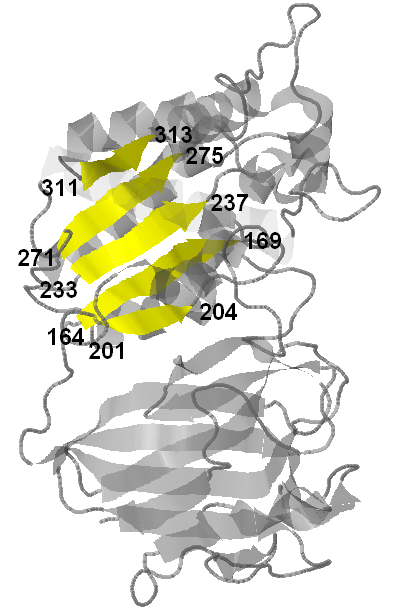
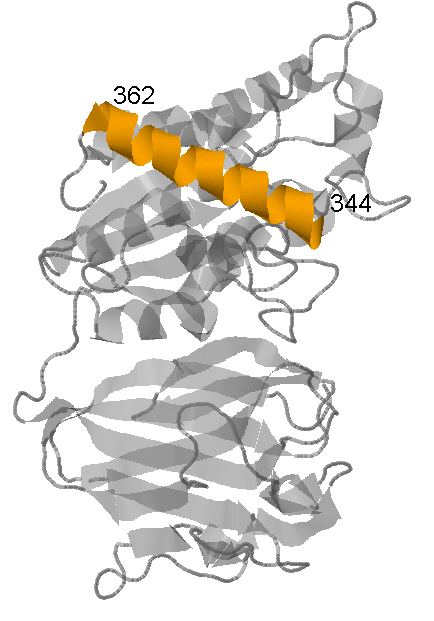
Вторичная структура белка YXIM содержит 5 β-листов и 12 α-спиралей. Для исследоваия я выбрала α-спираль, состоящую из остатков 344-362, и β-лист, состоящий из 5 тяжей (311-313, 271-275, 233-237, 164-169 и 201-204). Для удобства обе структуры отображены на трёх рисунках - обе структуры на рис.2, α-спираль в составе белка на рис.3, β-лист в составе белка на рис.4
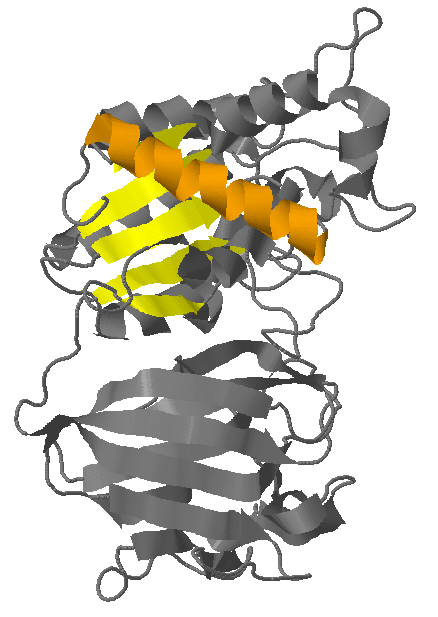
|
|
|
| Рис.2 Исследуемые структурыв составе белка YXIM. α-спираль выделена оранжевым, β-лист - жёлтым, остальная часть молекулы - серым. | Рис.3 Исследуемый β-лист. Тяжи выделены жёлтым цветом, полупрозрачным серым - остальная чать белка. Подписаны номера краевых аминокислотных остатков всех тяжей. | Рис.4 Исследуемая α-спираль (выделена оранжевым цветом). Остальная чать белка выделена полупрозрачным серым. Подписаны номера краевых аминокислотных остатков спирали. |
α-спираль
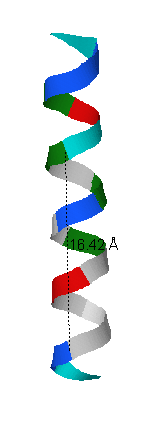
Исследуемая спираль белка YXIM начинается с аминокислотного остатка под номером 344 и заканчивается номером 362. Спираль делает 5 полных витков. 11 аминокислотных остатков составляют три полных витка (рис.5), значит, в одном витке 11/3 = 3,7 аминокислотных остатков. Чтобы измерить шаг спирали (расстояние между аминокислотными остатками, находящимся на одном уровне соседних витков спирали) измерим, на каком расстоянии расположены два аминокислотных остатка, расположенные на одном уровне в спирали в разных витках. Это расстояние составляет 16,42Å (рис.5). Так как по факту мы измерили длину трёх витков, шаг спирали составляет 16,42/3 = 5,47Å. На рис.6 показано, как расположены относительно друг друга остатки из соседних витков, соединённые водородными связями. Они расположены через 3 остатка, то есть остаток под номером n образует водородные связи с остатками под номером n-4 и n+4.
 |
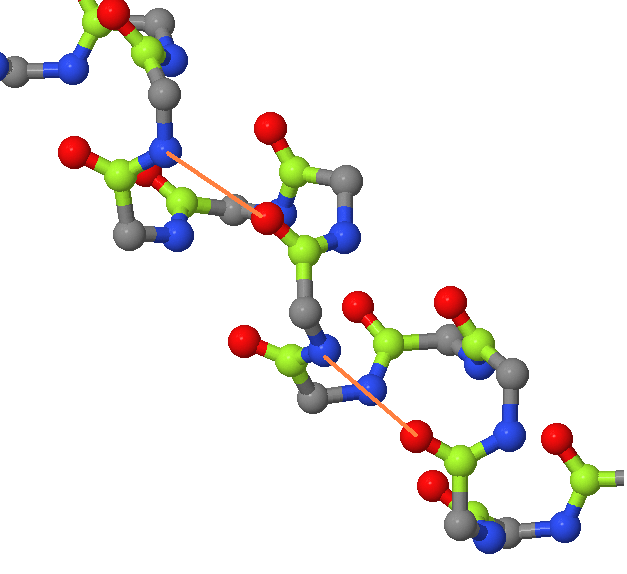 |
| Рис.5 Изображение α-спирали, разными цветами отмечены разные аминокислотные остатки (см. стандартные цвета для аминокислот в на сайте JMol), чёрной пунктирной линией обозначено расстояние между аминокислотными остатками, расположенными на одном уровне спирали. | Рис.6 Изображение α-спирали, серым цветом выделены альфа-атомы углерода, красным - кислород и зелёным углерод карбоксильных групп при альфа-атоме, синим - азот аминогрупп, образующих пептидную связь. Оранжевые лини обозначают водородные связи между атомами азота и кислорода карбоксильной группы. |
β-лист
Выделенный β-лист состоит из 5 параллельных β-тяжей. Каждый тяж листа имеет направление – от N конца к C концу.
Если лежащие в одной плоскости тяжи направлены в одну сторону – они параллельны, в разные стороны – антипараллельны.
На рисунке 7 показана параллельность тяжей исследуемого листа.
Посмотрев на лист с другого ракурса (рис.8), видим, что он образует не плоскую, а вогнутую поверхность.
 |
 |
| Рис.7 Изображение β-листа. Стрелками и переходом цвета от более холодного к более тёплому тону показано направление тяжей от N конца к C концу. | Рис.8 Изображение β-листа "с торца". |
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры YXIM
Белок YXIM содержит только один остаток цистеина (рис.9), поэтому дисульфидных мостиков в нём нет.
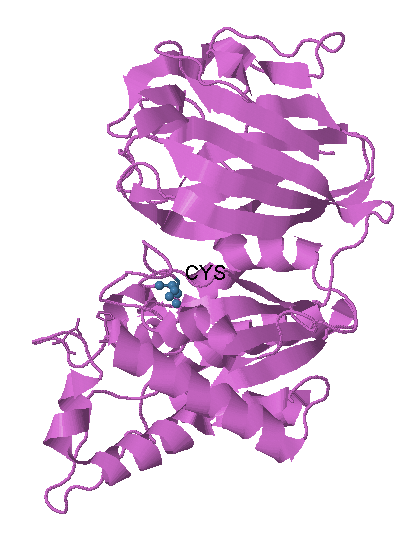 |
| Рис.9 Остаток цистеина в цепи белка YXIM. Остаток выделен голубым цветом, его атомы представлены шарообразно, остальная часть молекулы белка окрашена сиреневым цветом. |
Кроме дисульфидных мостиков между боковыми группами аминокислотных остатков могут образовываться солевые мостики. Такие связи (см. рис.10) возникают между отрицательно и положительно заряженными аминокислотными остатками (аспартат и глутамат и лизин, гистидин, аргинин соответственно). Длина солевого мостика не превышает 4Å, что позволяет найти такие связи в молекуле белка. В программе JMol я выделила атомы кислорода -OH группы боковой цепи аспартата и глутамата, расположенные не далее 4 ангстрем от атомов азота боковой цепи лизина, атомов углерода и азота кольца гистидина, атомов азота боковой цепи аргинина. Для этого была использована следующая команда:
select within (4.0, ASP.OD2 or GLU.OE2) and
(ARG.CZ or ARG.NH1 or ARG.NH2 or LYS.NZ or HIS.NE2 or HIS.ND1 or HIS.CE1 or HIS.CD2 or HIS.NG2)
Таким образом, было выделено 20 атомов. Из этого числа можно вычесть число атомов, которые расположены в одной группе одного остатка. Так как заряжена вся группа, на них приходится один солевой мостик. Всего осталось 12 атомов, то есть в молекуле белка YXIM есть 12 солевых мостиков.
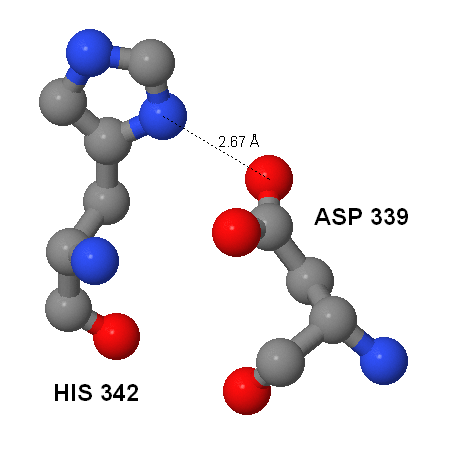 |
| Рис.10 Пример солевого мостика (обозначен пунктирной линией) между остатками аспарагина (номер 339) и гистидина (номер 342) длиной 2,67Å. Серым цветом окрашены атомы углерода, синим - азота, красным кислорода. |
| обо мне | семестры | заметки | ссылки |
| вернуться на главную | |||
