Особенности мембранных белков
α-спирали и β-баррели
Для того, чтобы можно было разместить белок в мембране, создающей гидрофобное окружение, используются два типа структур - α-спирали и β-листы, образующие циклическую структуру, или баррель. Рассмотрим несколько белков, имеющих такие структуры (см. таблицу 1). Файл с расчётом медианы - здесь.
Таблица 1.
| PDB код | Тип | Тип мембраны | Толщина гидрофобной части мембраны (Å) | Медиана длины трансмембранного участка |
| 2qpe | спираль | клеточная мембрана грамотрицательной бактерии Thermus thermophilus | 31.2 ± 1.1 | 24 |
| 7prc | спираль | клеточная мембрана грамотрицательной бактерии Blastochloris viridis | 31.8 ± 0.7 | 22 |
| 4rcr | спираль | клеточная мембрана грамотрицательной бактерии Rhodobacter sphaeroides | 31.8 ± 0.8 | 23 |
| 1bxw | баррель | наружная клеточная мембрана грамотрицательной бактерии Escherichia coli | 25.4 ± 1.9 | 9,5 |
| 7ahl | баррель | секретируется Staphylococcus aureus и встраивается в эукариотическую мембрану | 23.5 ± 0.9 | 8,5 |
| 8prn | баррель | наружная клеточная мембрана грамотрицательной бактерии Rhodobacter blasticus | 23.2 ± 0.5 | 8 |
Примечательно, что медиана числа аминокислотных остатков в трансмембранном участке у спиральных белков больше, чем у белков с баррелями. Это объясняется различиями в строении α-спиралей и β-листов, очевидно, что у первых упаковка более плотная, и на единицу длины приходится большее число остатков. Кроме того, спиральные трансмембранные белки расположены в более толстых мембранах, значит, число остатков в спиралях больше ещё и потому, что трансмембранная структура должна быть длинней.
Отбор гомологов
Для трансмембранного белка RhCG (транспортёр аммония из Homo sapiens, PDB-код 3hd6) с помощью программы blastp найдём гомологи. В параметрах поиска установим порог e-value равный 1, размер выдачи 1000. Поиск производился по базе данных RefSeq, по различным таксонам (к сожалению, функция Exlude не работала), гомологами были приняты белки с высоким покрытием. Гомологи были взяты из надтипов Viridiplantae, Alveolata, Amoebozoa, Heterolobosea, Stramenopiles и Ophisthokonta - тип Choanoflagellida и тип Metazoa (классы Ascidiacea, Actinopterygii, Amphibia, Aves, Insecta, Nematoda). Последовательности 11 отобранных гомологов были сохранены в fasta-файл.
Описание белка
В базе данных ОРМ можно найти информацию об изучаемом белке, на сайте TCBD - ТС-код белка. Полученные данные приведены в таблице 2.
Таблица 2.
| PDB ID | Организм | Тип мембраны | TC-код | Угол наклона спиралей к нормали | Количество трансмембранных спиралей |
| 3hd6 | Homo sapiens | наружная мембрана клетки | 1.A.11.4.1 | 0 ± 0° | 36 |
Расшифровка ТС-кода:
- 1 - Channels/Pores - класс каналов/пор
- 1.A - α-Type Channels - подкласс каналов из α-спиралей
- 1.A.11 - The Ammonia Channel Transporter (Amt) Family - семейство каналов, транспортирующих аммоний
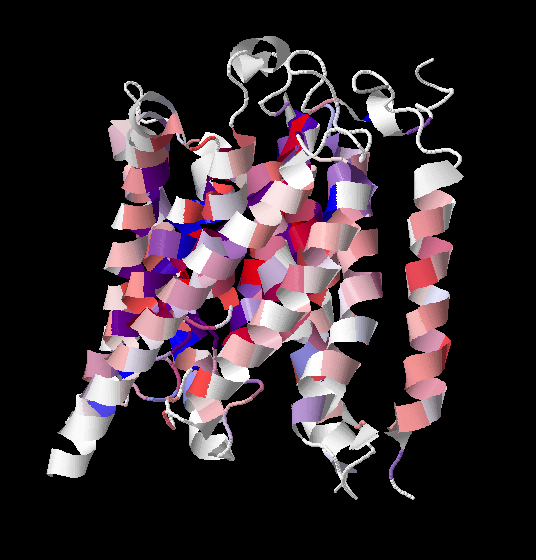
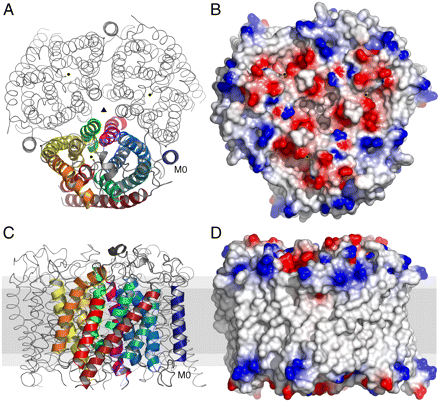
В статье Function of human Rh based on structure of RhCG at 2.1 Å, F. Gruswitz et al (PMID: 20457942) была описана трёхмерная структура белка (см. рис. 1). Белок является гомотримером.
|
Рис. 1. Структура молекулы белка RhCG. А - вид со стороны цитоплазмы, треугольником обозначена ось симметрии, точкой - расположение канала в каждом мономере. В - поверхность белка со стороны цитоплазмы с окраской по заряду. С и D - то же, что А и В, но с поворотом на 90° и с пересечением с мембраной, которая показана серым. |
Анализ множественного выравнивания трансмембранных белков
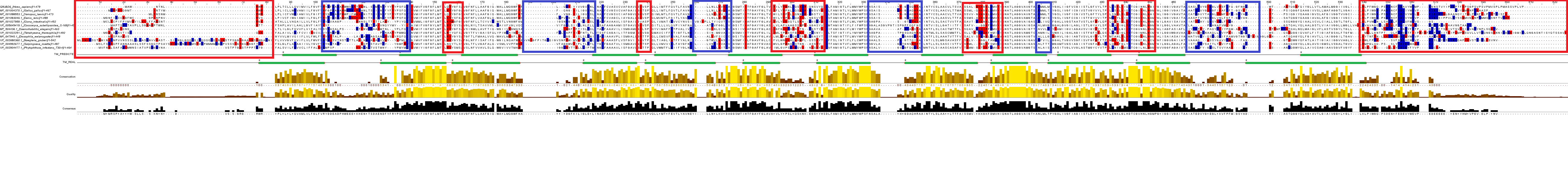
Полученные последовательности ортологов были выровнены с помощью программы Мuscle (см. рис. 2). Затем структура белка RhCG была привязана к его последовательности, и в новой строке описания были размечены все α-спирали.
С помощью программы TMHMM было получено предсказанное расположение трансмембранных участков в гомологе из Caenorhabditis elegans (см. рис. 3), эти участки были так же отмечены на выравнивании.
Трансмембранные участки, предсказанные программой ТМНММ, достаточно сильно совпадают с трансмембранными участками из RhCG. Оценить точность предсказания сложно, так как гомологи вполне могут иметь небольшие различия. И настоящие, и предсказанные участки в основном совпадают с консервативными участками выравнивания. Логично, что участки, важные для функционирования белка, то есть его размещения в мембране, сохраняются в ходе эволюции. Межспиральные участки выровнены хуже и малоконсервативны, как и концевые. Они не имеют большой функциональной значимости. Исключение составляют несколько выско консервативных позиций (D431, T432, D545), вероятно, соответствующих остаткам, задействованным в активности белка - транспортировке субстрата.
Большая часть аминокислотных остатков в консервативных блоках, совпадающих с трансмембранными участками, - гидрофобные. Во всех участках встречаются V, I, L, А, периодически попадаются F, M, T. Кроме того, встречаются и полярные аминокислоты - Q, D, H, N. На изображении структуры белка видно, что они обычно обращены внутрь белка, а не в сторону контакта с мембраной. Вероятно, положение таких аминокислотных остатков стабилизровано водородными связями, что энергетически выгодно. На выравнии можно увидеть, что они очень консервативны (H270, D304, N379, H439, например). Они могут также участвовать в транспортировке субстрата - ионов аммония.
Сравнение размеров
Представим себе кишечную палочку размером с дыню, сохранив пропорциональность компонентов клетки. Так как диаметр E. coli в среднем равен 0,6 мкм, толщина её внешней мембраны 25 ангстремам (по данным нулевого задания, см. таблицу 1), а диаметр дыни - 20 см, можем рассчитать толщину мембраны увеличенной бактерии:
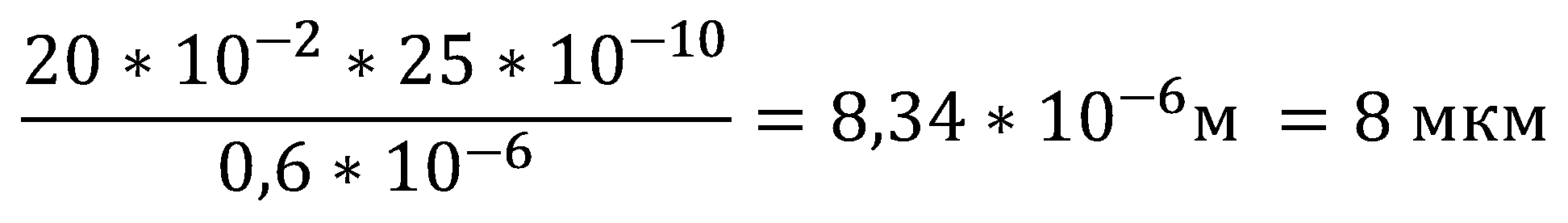
Полученная величина сравнима с размером эукариотической клетки, то есть можно сравнить мембрану с поверхностным слоем клеток на дыне. Невооружённый человеческий глаз даже не сможет различить этот слой на срезе. Трансмембранные белки по размеру сопоставимы с толщиной мембраны. Мысленно увеличив клетку до размеров дыни, мы можем лучше представить себе, какое огромное количество различных рецепторов и транспортёров клетка может уместить на своей поверхности.
Правило "positive inside"
Данное правило заключается в том, что обращённая внутрь клетки часть трансмембранного белка содержит больше положительно заряженных аминокислотных остатков. Проверим это правило на нашей выборке гомологов. На полученном выравнивании лизин, гистидин и аргинин были покрашены красным цветом, аспартат и глутамат - синим. На сайте PDB можно посмотреть, какие межспиральные участки с какой стороны от мембраны расположены. Это было так же отмечено на выравнивании (см. рис. 5) с ориентировкой на ранее размеченные трансмембранные участки.
На полученной картинке наглядно прослеживается описанная закономерность. В красных рамках больше красных аминокислот, то есть во внутриклеточных частях белка действительно больше положительно заряженных остатков. Исключением явлется, например, позиция D442. Но этот остаток очень консервативен, возможно, он просто задействован в транспортной активности белка.