Совмещение структур
Для анализа был выбран белок CypA человека - пептидил-пролил цис-транс изомераза, называемая циклофилин А (PDB код 2CPL). С помощью сервиса PDBeFOLD были найдены структурные гомологи белка. Из них были выбраны четыре:
- 2ose - циклофилин мимивируса (Q-score 0.57, %seq 27)
- 2nul - пептидил-пролил изомераза кишечной палочки (Q-score 0.6, %seq 30)
- 4r3e - сплайсосомная пептидил-пролил цис-транс изомераза человека (Q-score 0.68, %seq 36)
- 1a58 - циклофилин нематоды Brugia malayi (Q-score 0.57, %seq 100)
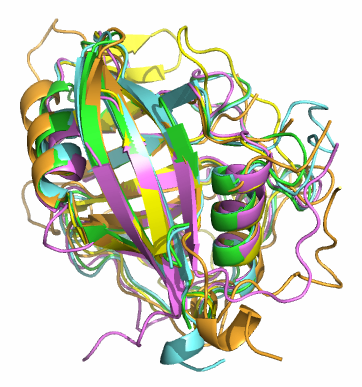
Было сделано множественное выравнивание всех пяти структур. Изображение структурного совмещения приведено на рис. 1, выравнивание последовательностей по структурному совмещению - на рис. 2.
|

|
| Рис. 1. Совмещение структур пяти гомологов, визуализированное с помощью PyMOL. Зелёным цветом - циклофилин человека, голубым - циклофилин нематоды, розовым - сплайсосомная изомераза человека, жёлтым - изомераза кишечной палочки, оранжевым - циклофилин мимивируса. | |

|
|
| Рис. 2. Выравнивание последовательностей выбранных гомологов, сделанное на основе структурного совмещения. Крупный масштаб - по клику на изображении. | |
Затем были получены последовательности гомологов и сделано их выравнивание с помощью программы MUSCLE (рис. 3).

|
|
| Рис. 3. Выравнивание последовательностей выбранных гомологов, сделанное MUSCLE. Крупный масштаб - по клику на изображении. | |
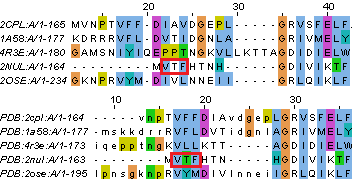
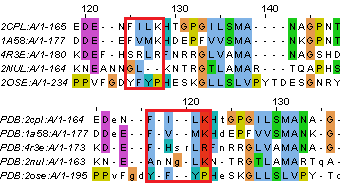
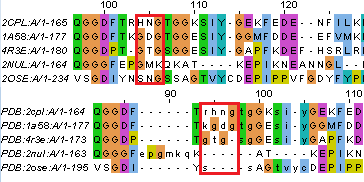
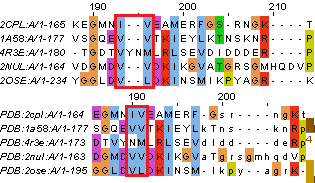
В целом выравнивания похожи, но существует достаточно большое количество мелких отличий. Некоторые из них приеведены на рисунках 4 и 5.
|
|
| Рис. 4. Случаи несовпадений в двух выравниваниях, когда остатки лучше выровнялись по структурному совмещению. Выравнивание сверху - полученное MUSCLE, снизу - по структурному совмещению. | |
|
|
| Рис. 5. Случаи несовпадений в двух выравниваниях, когда остатки не выровнялись по структурному совмещению, но выровнялись MUSCLE. Выравнивание сверху - полученное MUSCLE, снизу - по структурному совмещению. | |
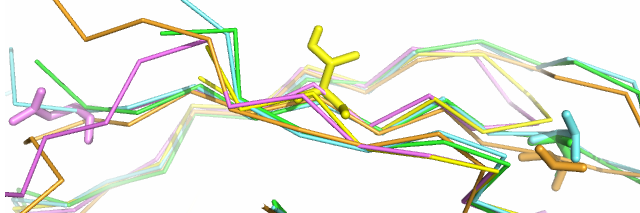
Первый случай с рис. 1 был рассмотрен подробнее. Три аминокислотных остатка белка кишечной палочки (Val2, Thr3 и Phe4) по последовательности выровнялись в столбец 22-24, а по совмещению структур - в столбец 17-19. С первого взгляда второй вариант кажется более правильным. Если рассмотреть положение остатков в пространстве (рис. 6 и 7), то это подтверждается. Остатки из столбца 18 выравнивания по структурному совмещению расположены рядом, а из столбца 23 выравнивания по последовательностям - не все. СВ пользу выравнивания по совмещению говорит и то, что Thr3 расположен в одном из β-тяжей, которые являются более консервативными структурами.
|
| Рис. 6. Пространственное положение остатков, выровненных по последовательности. Покраска та же. |

|
| Рис. 7. Пространственное положение остатков, выровненных по совмещению структур. Покраска та же. |
Таким образом, в данном случае выравнивание, полученное по структурному совмещению, скорее всего является более правильным.
Поиск по сходству структур
С помощью сервиса PDBeFOLD был осуществлен поиск одного из доменов структуры 1cii (284-384 остатки цепи А) с исходными параметрами. Выдача была отсортирована по RMSD, но большого значения это не имело, так как результат был только один - структура 2hdi:В. То есть исходная структура найдена не была. Этот факт нетрудно объяснить: в параметрах по умолчанию указан наименьший процент сходства 70%, но домен составляет не такую большую долю от белка, чтобы сходство было таким высоким. Если снизить наименьший процент сходства до 15, то количество находок увеличивается до 75 и на первом месте стоит исходная структура.
Совмещение по заданному выравниванию
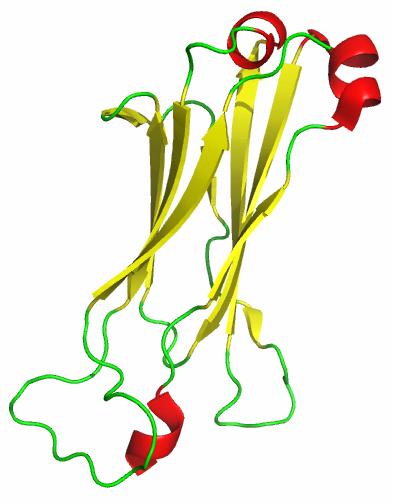
Из SCOP была выбрана структура 1KGC, для которй были получены PDB-файлы с доменами из альфа (цепь d:118-206) и из бета цепи (цепь e:119-247).

|
|
| Рис. 8. Структура домена Т-клеточного рецептора из цепи альфа. | Рис. 9. Структура домена Т-клеточного рецептора из цепи бета. |
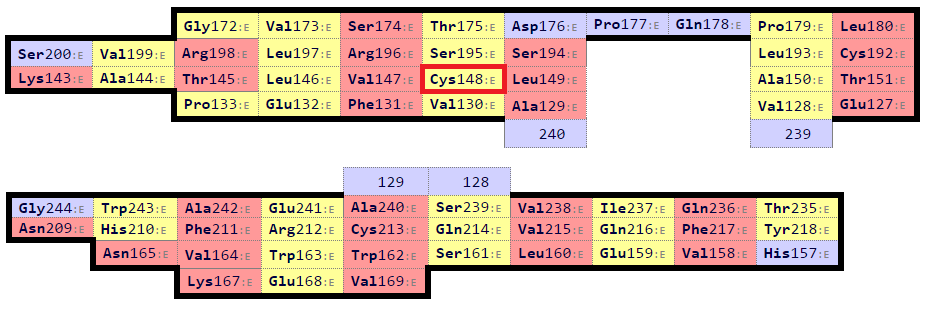
Для обеих структур с помощью программы SheeP были построены карты β-листов (рис. 10 и 11). Верхняя из двух карт для цепи бета отображает β-лист, соответствующий листу из цепи альфа. Во-первых, их карты более похожи по форме. Во-вторых, остаток цистеина в них имеет одинаковых соседей - валин и лейцин. В-третьих, после выравнивания структур в PyMOL командой align именно эти листы совместились. Консервативный цистеин был определён по образованию дисульфидной связи.
|
| Рис. 10. Карта β-листа из цепи альфа, полученная Sheep и повёрнутая в ориентации, соответствующей листу из цепи бета. Выделен консервативный остаток цистеина. |
|
| Рис. 11. Карты β-листов из цепи бета, полученные Sheep. Выделен консервативный остаток цистеина в листе, соответствующем листу из цепи альфа. |
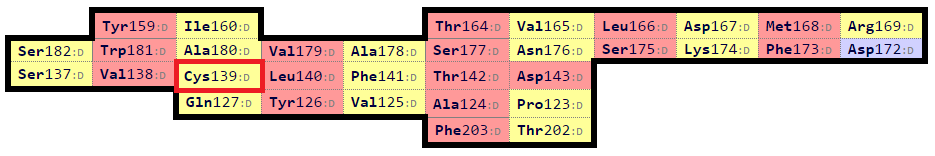
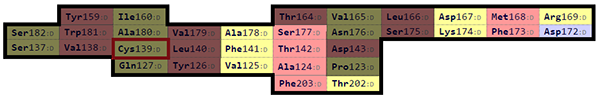
Чтобы построить выравнивание, карты были совмещены по консервативным цистеинам, после чего были отобраны остатки, попавшие на пересечение карт. Всего получилось 19 остатков. Выбранные для выравнивания остатки можно увидеть на рис. 12.
|

|
| Рис. 12. Карты β-листов из цепи альфа (сверху) и бета (снизу). Отобранные для выравнивания остатки затемнены. |
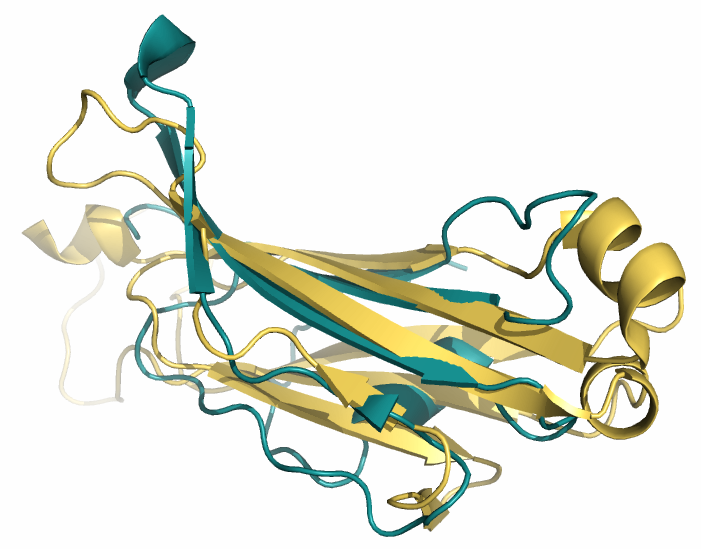
Совмещение структур в PyMOL, сохраненное в файле и показанное на рисунке 13, проводилось с помощью следующих команд:
select s1, chain d and resi 159-160+164-166+179-182+175-176+137-140+143+126-127+124 and name ca select s2, chain e and resi 174-175+178-180+194-197+192-193+146-149+150+128+129-130 and name ca pair_fit s1, s2
|
| Рис. 13. Изображение совмещённых структур. Зелёным выделен домен из цепи альфа, жёлтым - из цепи бета. |
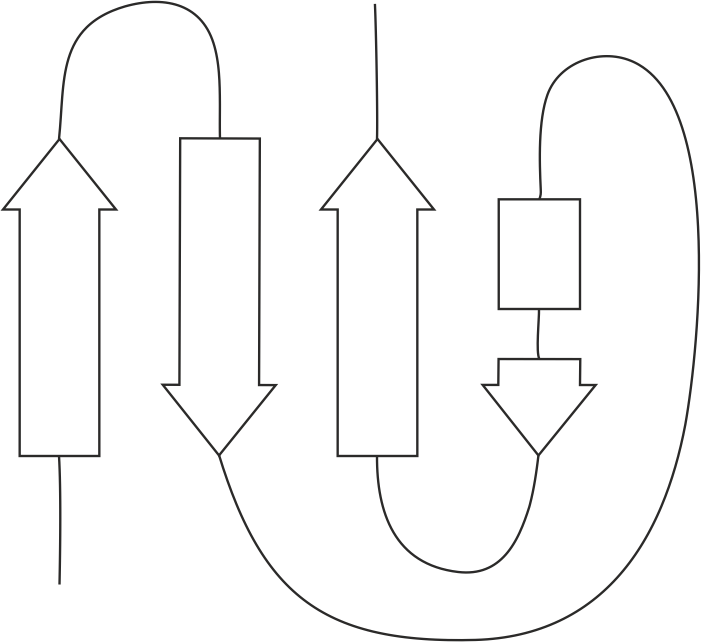
Хотя положение петель двух листов не очень совпадает, если проследить ход цепи по обоим листам, то можно увидеть, что топология листов одинаковая (напоминает греческий ключ, рис. 14).
|
| Рис. 14. Схема топологии исследуемых β-листов. |