Вторичная структура UVRB_BACSU
Вторичной структурой белка называется пространственная организация белковой молекулы, обусловленная водородными связями между кето- и аминогруппами пептидного остова. Благодаря водородным связям возникают регулярные структуры белка: α-спирали и β-листы.
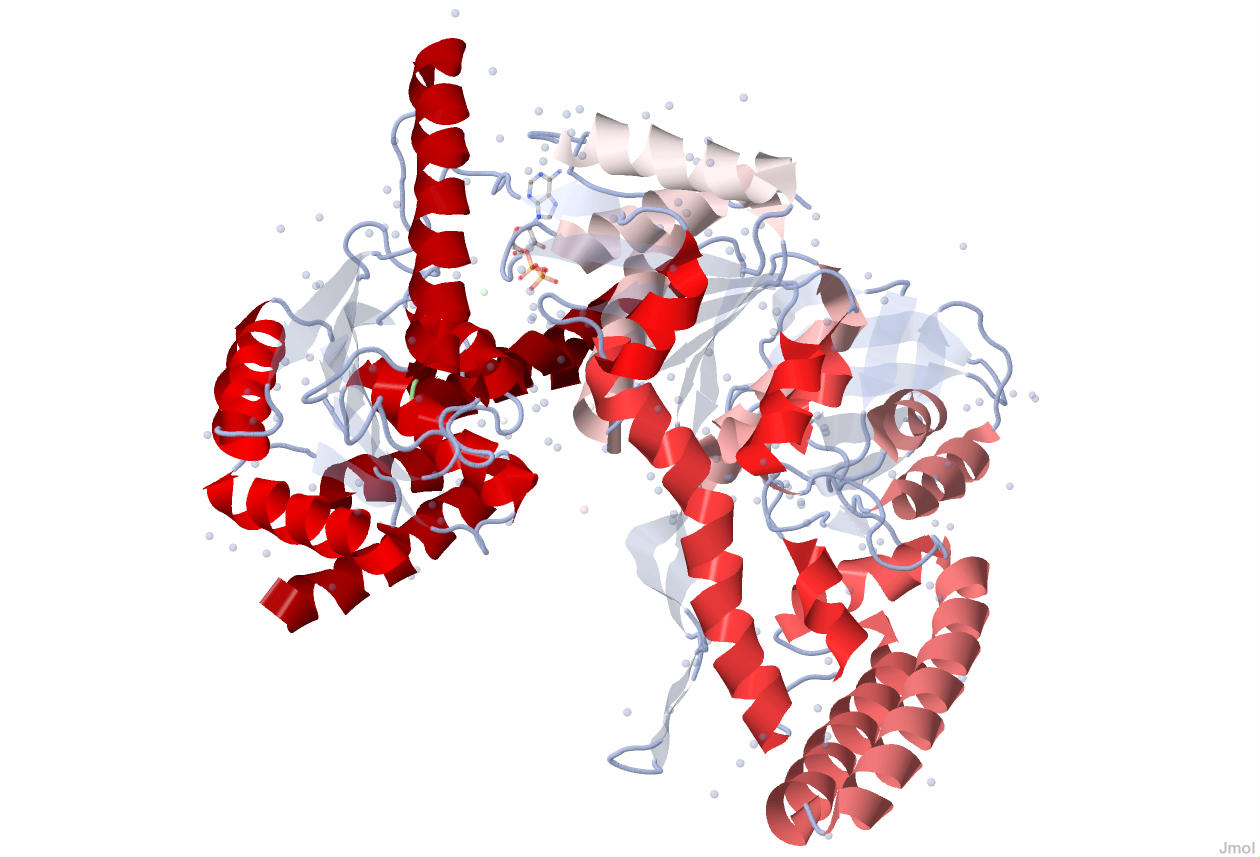
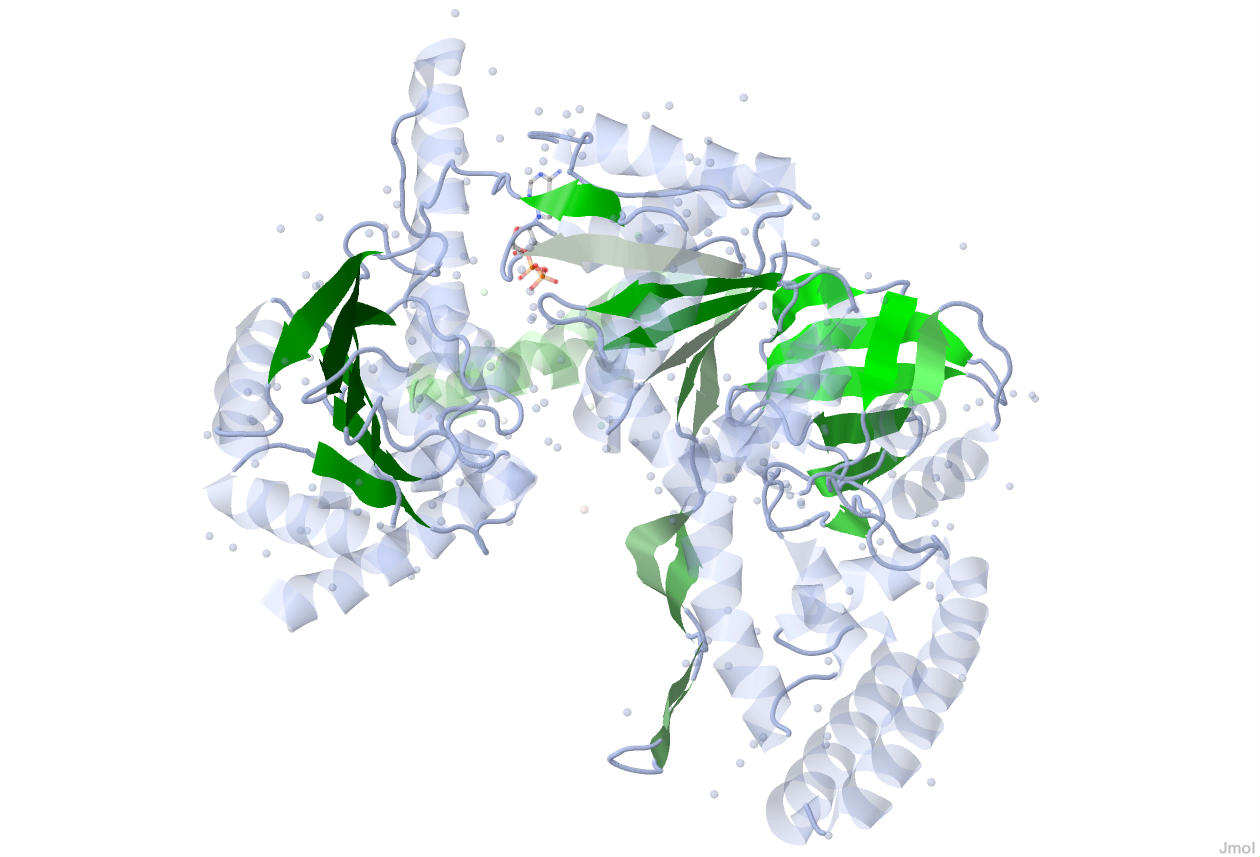
Рисунок 1. Оттенками красного цвета показаны α-спирали в структуре UVRB_BACSU.
Более светлые оттенки соответствуют начальным отделам цепи A, а более тёмные оттенки соответствуют её концевым отделам.
α-спирали цепи В показаны наиболее тёмным цветом.
Рисунок 2. Оттенками зелёного цвета показаны β-листы в структуре UVRB_BACSU.
Более светлые оттенки соответствуют начальным отделам цепи A, а более тёмные оттенки соответствуют её концевым отделам.
Цепь В не содержит β-листов, она выделена светло-зелёным полупрозрачным цветом.
Одна из α-спиралей UVRB_BACSU
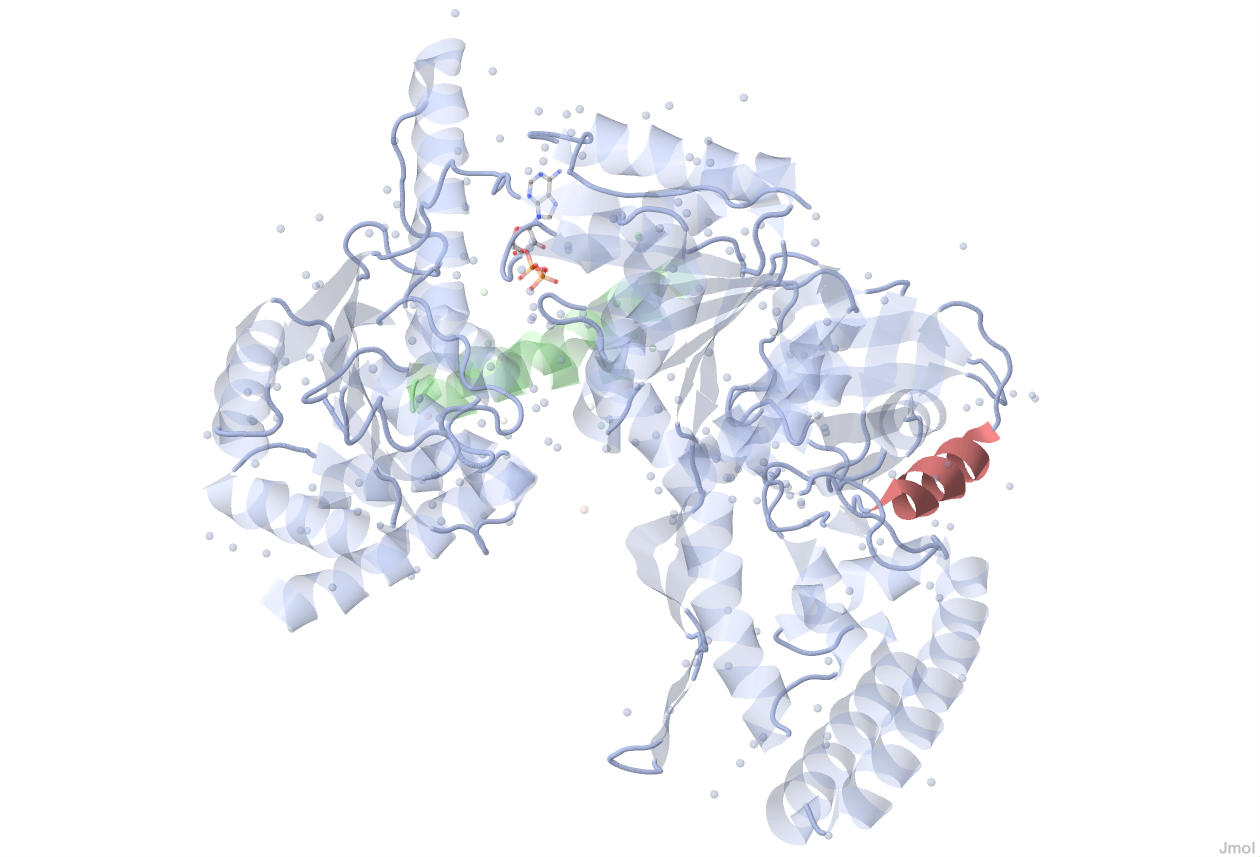

Рисунок 3. Расположение одной из α-спиралей цепи А в структуре UVRB_BACSU.
Рисунок 4. Одна из α-спиралей цепи А UVRB_BACSU.
Стрелкой показано направление α-спирали.
Подписаны номера первого и последнего аминокислотных остатков α-спирали.
Соответственно, α-спираль состоит из 12 аминокислотных остатков.
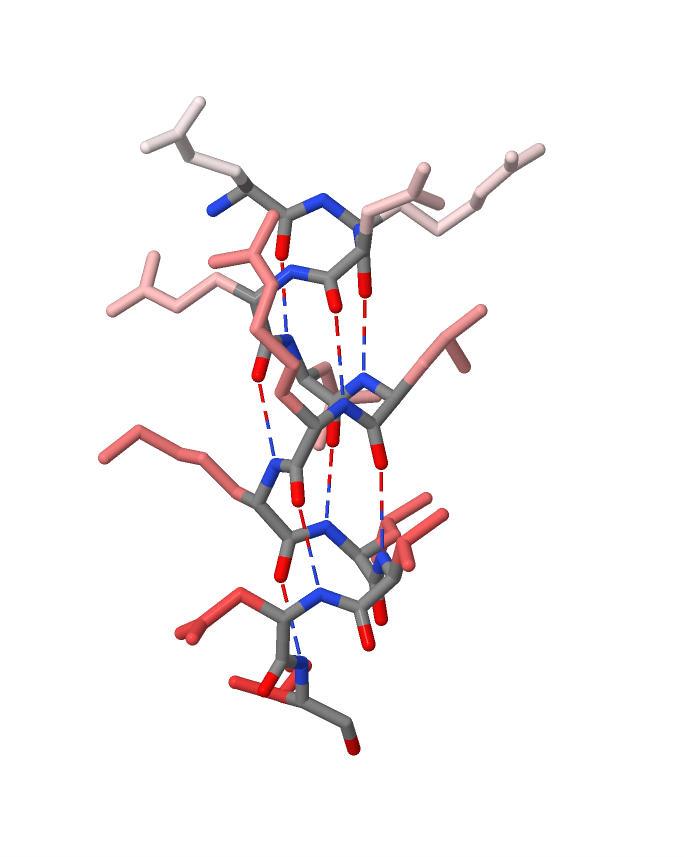
Рисунок 5. Образование α-спирали благодаря водородным связям.
Оттенками красного цвета показаны радикалы аминокислотных остатков α-спирали.
Наиболее светлый оттенок соответствует первому аминокислотному остатку α-спирали, а наиболее тёмный оттенок соответствует её последнему аминокислотному остатку.
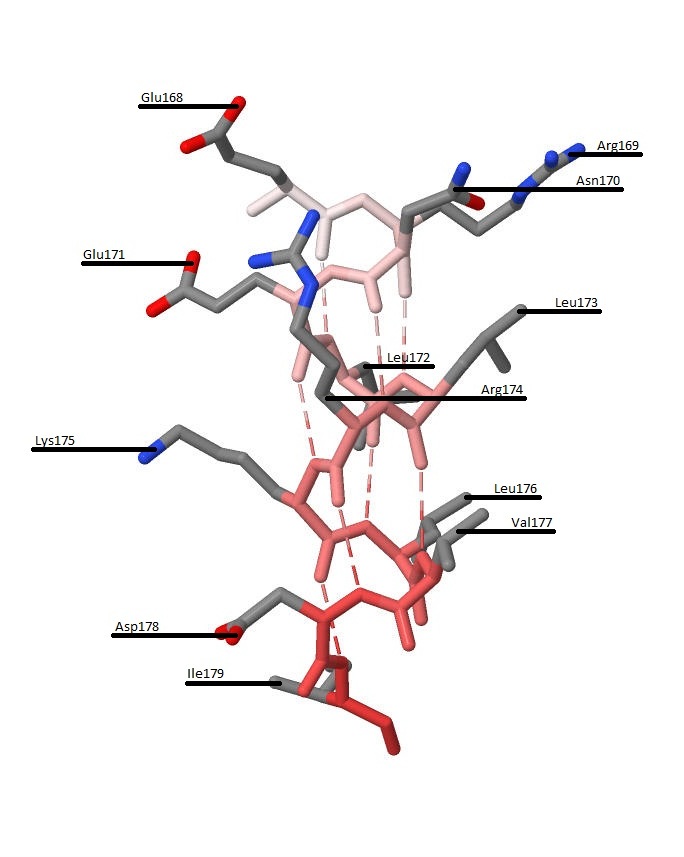
Рисунок 6. Радикалы аминокислотных остатков α-спирали.
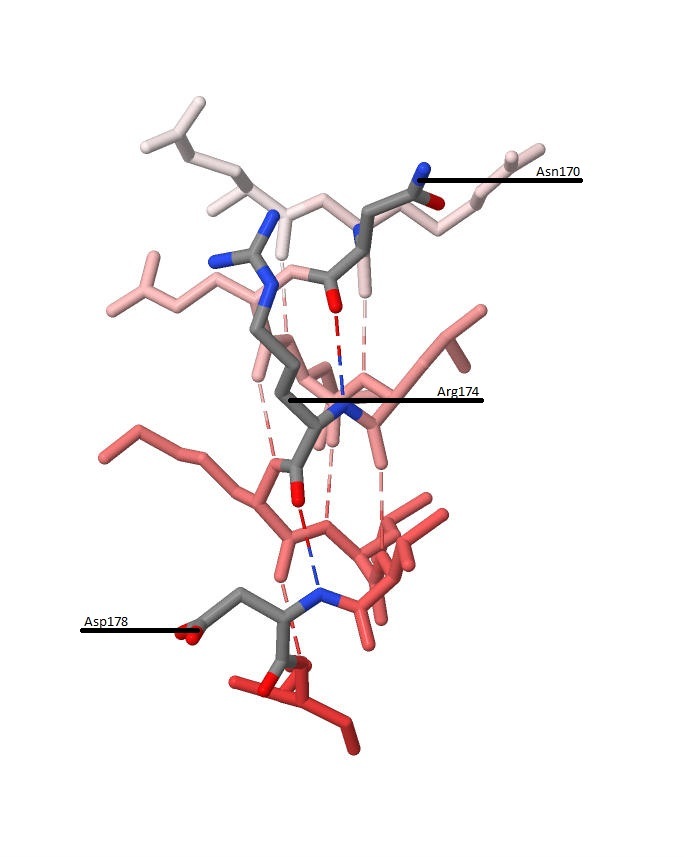
Рисунок 7. Образование водородных связей между каждым четвёртым аминокислотным остатком α-спирали.
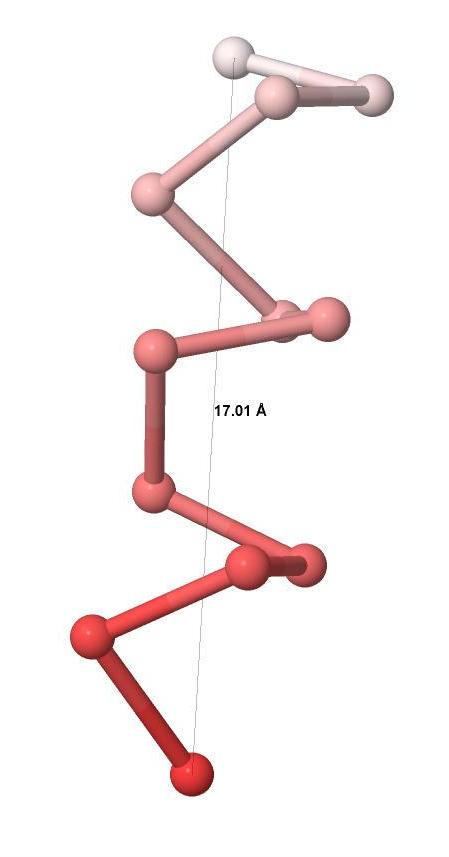
Рисунок 8. Модель остова α-спирали. Cα-атомы показаны шариками.
Из рисунка 8 видно, что α-спираль состоит из трёх витков и имеет длину 17.01 Å. Соответственно, шаг α-спирали равен 17.01 / 3 = 5,67 Å.
Ранее мы выяснили, что α-спираль состоит из 12 аминокислотных остатков. Соответственно, один виток α-спирали состоит из 12 / 3 = 4 аминокислотных остатков.
Один из бета-листов UVRB_BACSU
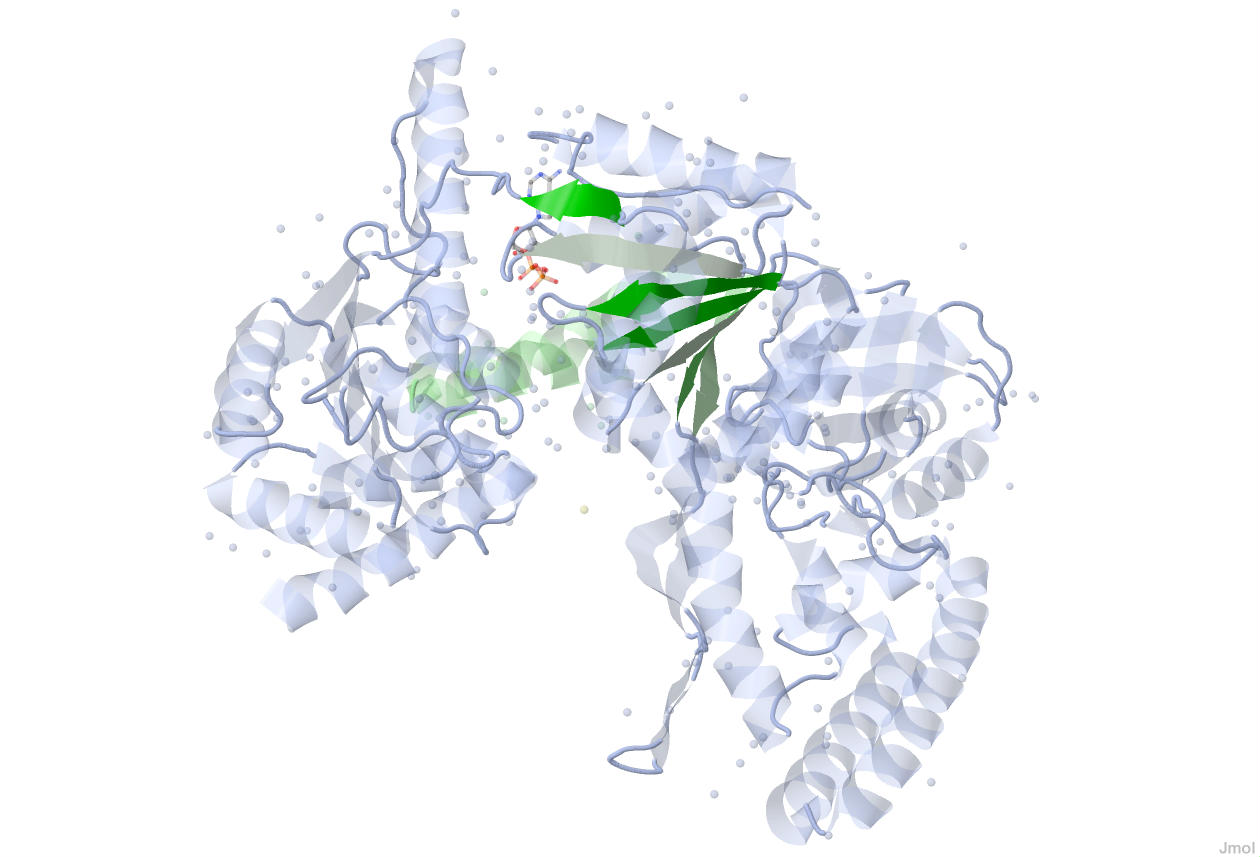
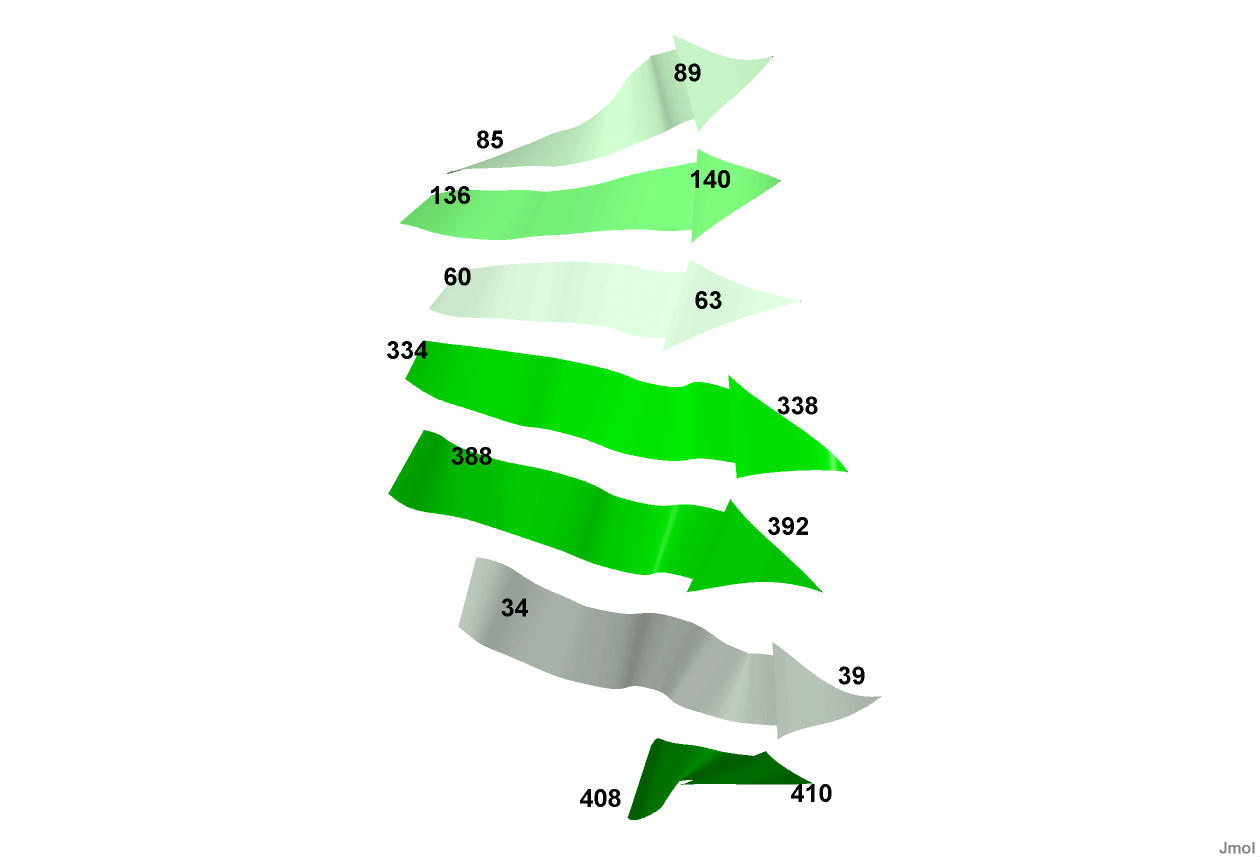
Рисунок 9. Расположение одного из β-листов цепи А в структуре UVRB_BACSU.
Рисунок 10. Один из β-листов цепи А UVRB_BACSU.
Этот β-лист состоит из семи β-тяжей.
Стрелками показано направление β-тяжей.
Все они параллельны, т.е. первый аминокислотный остаток каждого β-тяжа соответствует первому аминокислотному остатку соседнего β-тяжа
(у антипараллельных β-тяжей первый аминокислотный остаток каждого β-тяжа соответствует последнему аминокислотному остатку соседнего β-тяжа).
Номера первого и последнего аминокислотных остатков каждого β-тяжа подписаны.
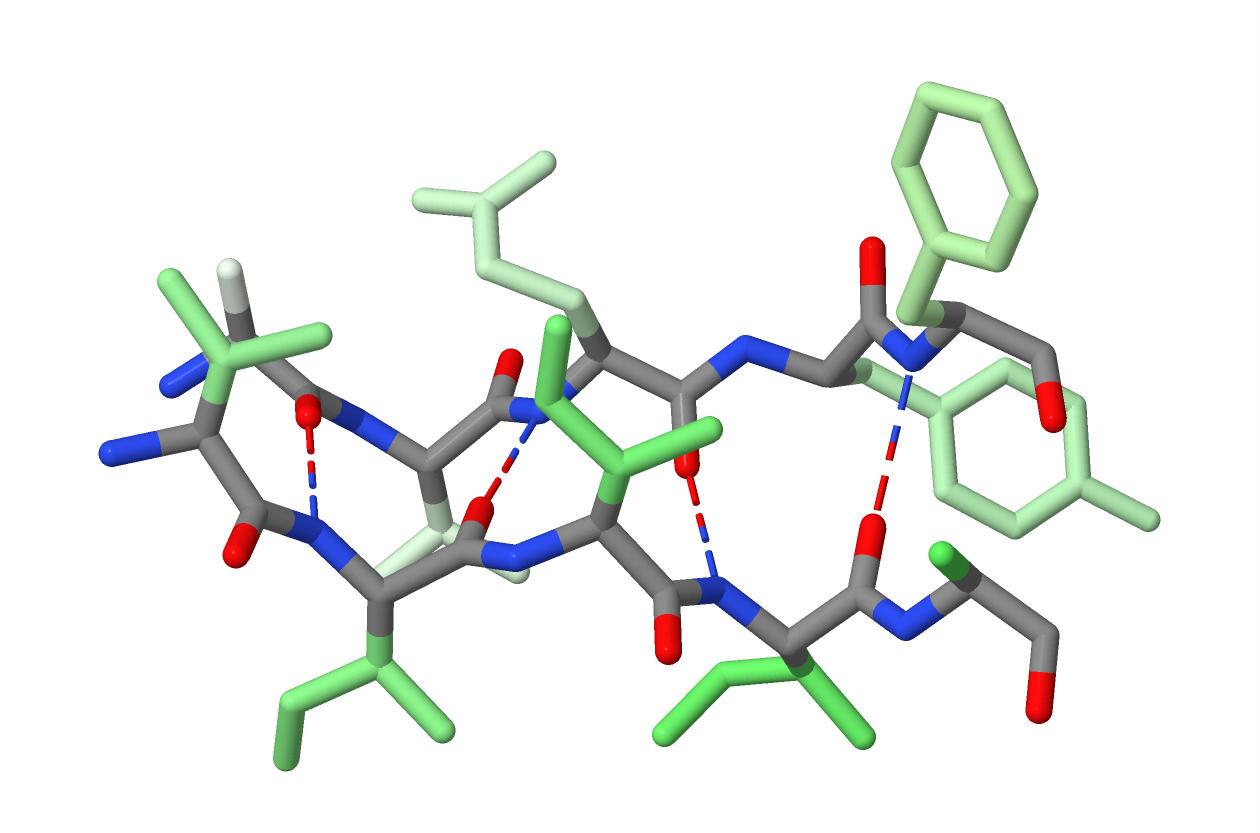
Рисунок 11. Образование водородных связей между двумя параллельными β-тяжами.
Оттенками зелёного цвета показаны радикалы аминокислотных остатков β-тяжей.
Наиболее светлый оттенок соответствует первому аминокислотному остатку β-тяжа, а наиболее тёмный оттенок соответствует его последнему аминокислотному остатку.
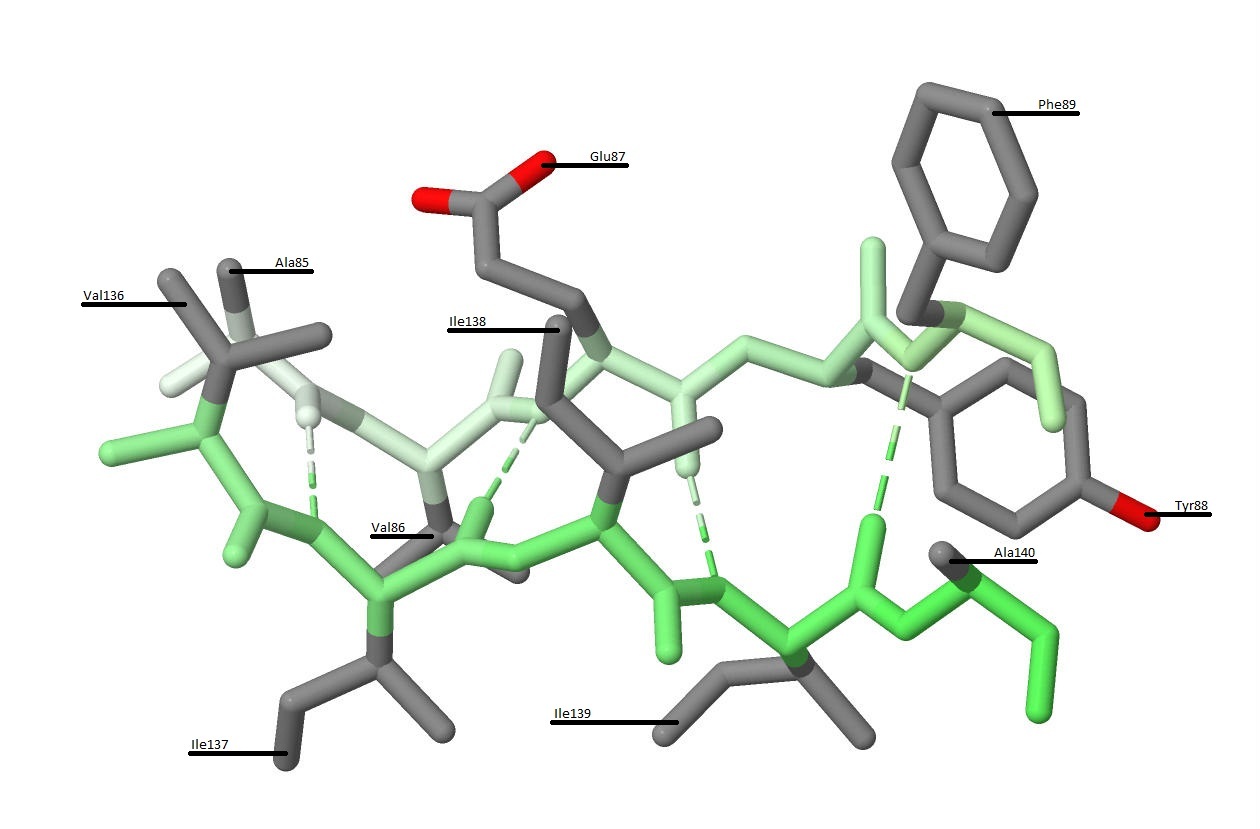
Рисунок 12. Радикалы аминокислотных остатков β-тяжей.
Литература:
 О вторичной структуре белка в WikipediA
Наверх
О вторичной структуре белка в WikipediA
Наверх