Третичная структура UVRB_BACSU
Третичной структурой белка называется пространственная организация белковой молекулы, обусловленная взаимодействиями между радикалами аминокислотных остатков, в т.ч. гидрофобными взаимодействиями, дисульфидными и солевыми мостиками.
Гидрофобные взаимодействия в структуре UVRB_BACSU
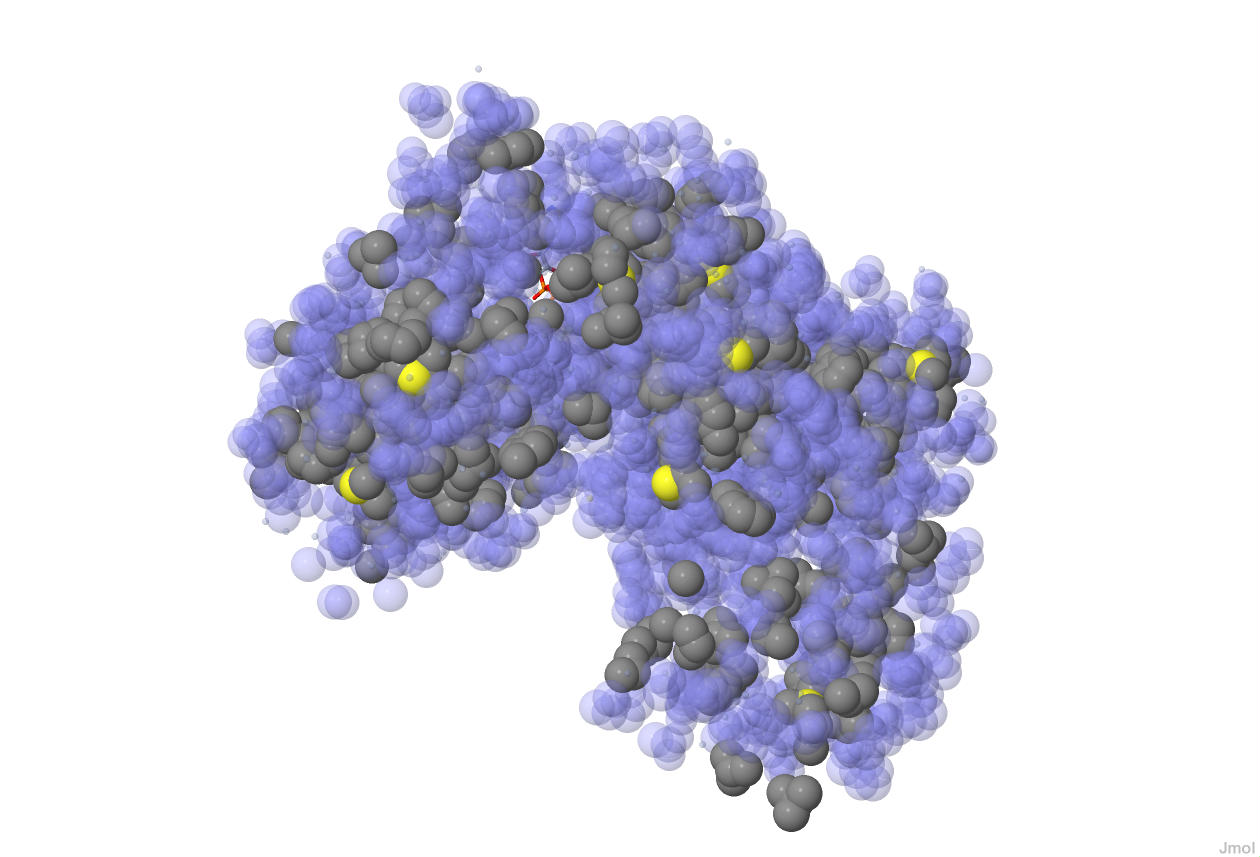
Гидрофобные взаимодействия в молекуле белка возникают между неполярными радикалами аминокислотных остатков глицина, аланина, валина, лейцина, изолейцина, пролина, метионина, фенилаланина и триптофана. В результате в молекуле белка образуются гидрофобные ядра, окружённые гидрофильными аминокислотными остатками.
Лейциновая "молния" UVRB_BACSU
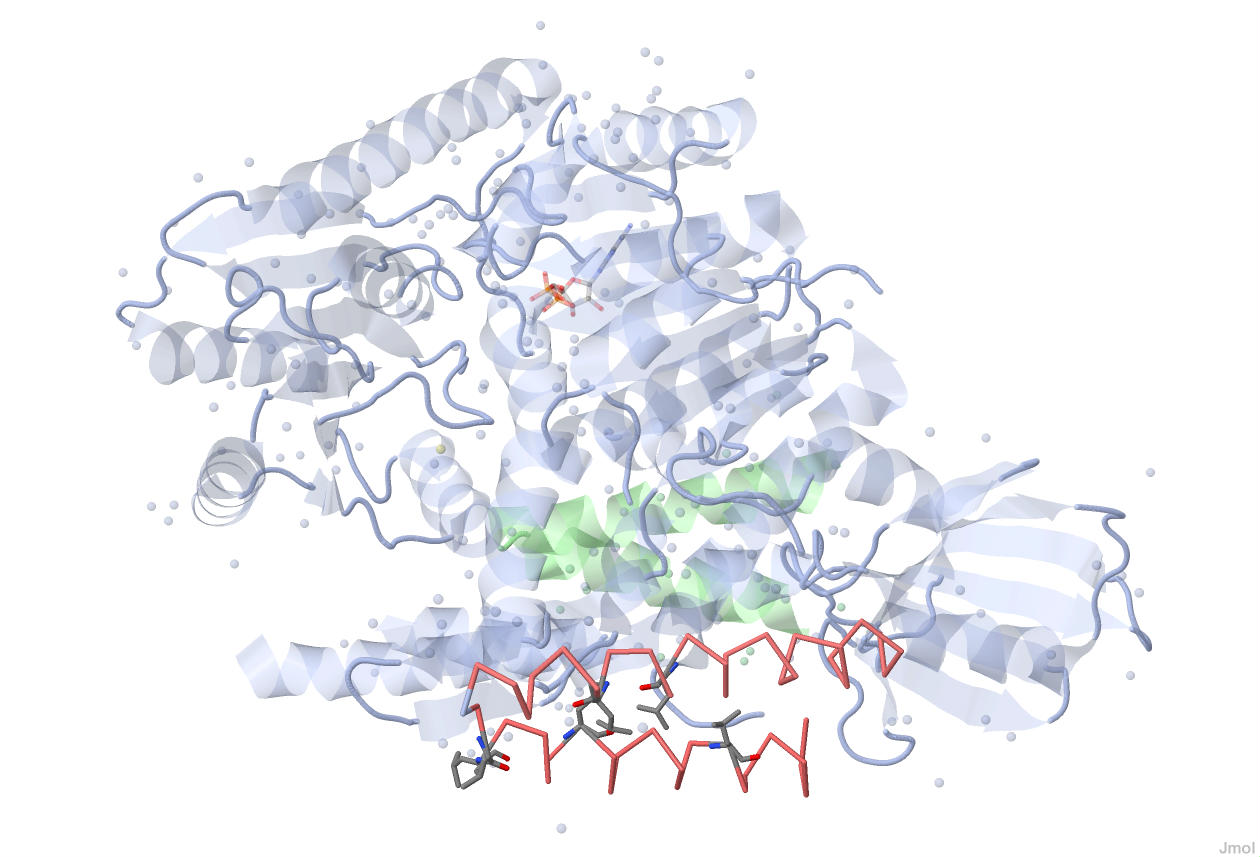
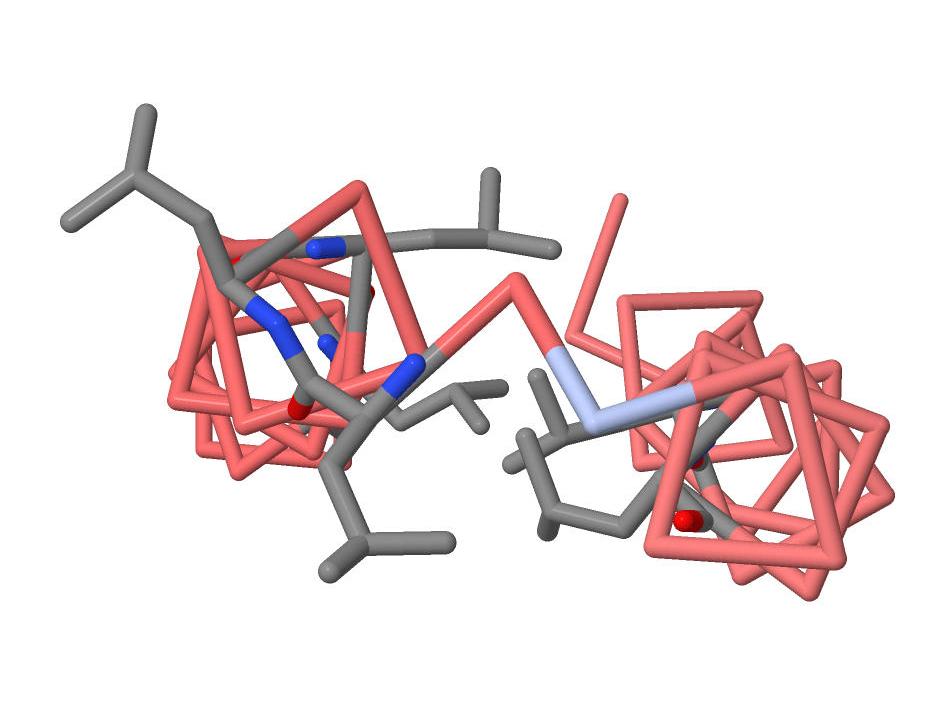
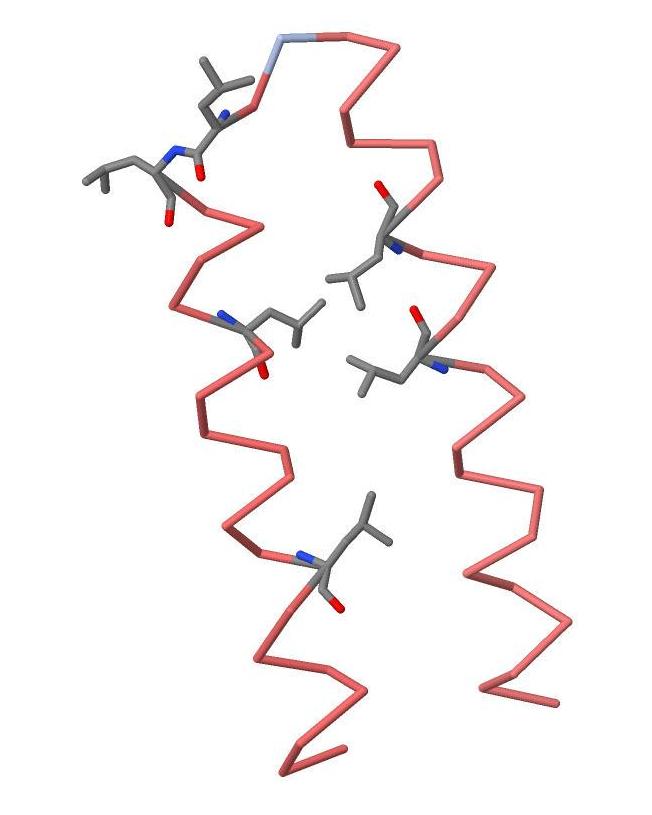
"молнии" в
структуре UVRB_BACSU.
Но по-видимому, функциональную значимость имеют лишь четыре из них.
Лейциновые "молнии" в молекуле белка образуются благодаря гидрофобным взаимодействиям между радикалами лейциновых аминокислотных остатков.
Цистеиновые аминокислотные остатки UVRB_BACSU
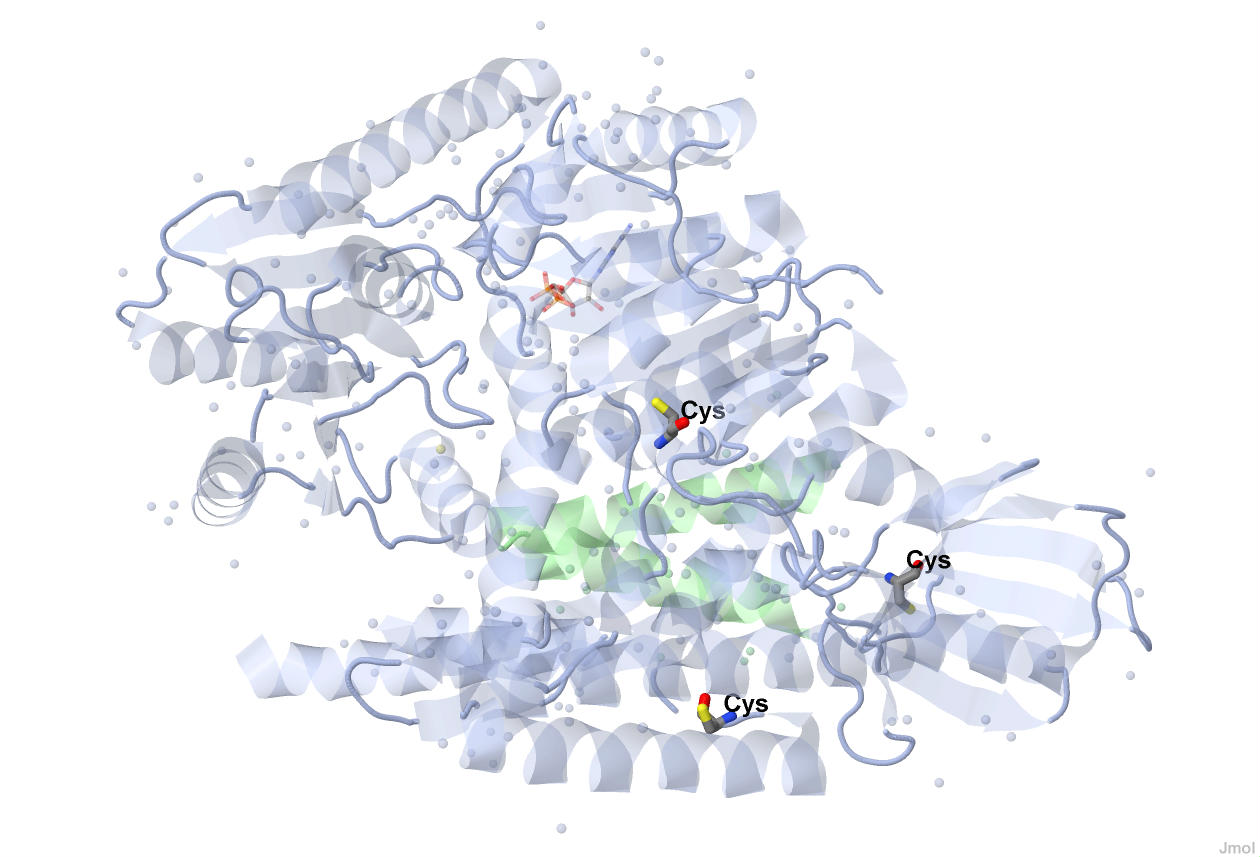
Дисульфидные мостики в молекуле белка образуются благодаря ковалентным связям между радикалами цистеиновых аминокислотных остатков. У UVRB_BACSU не обнаружено дисульфидных мостиков.
Солевые мостики UVRB_BACSU
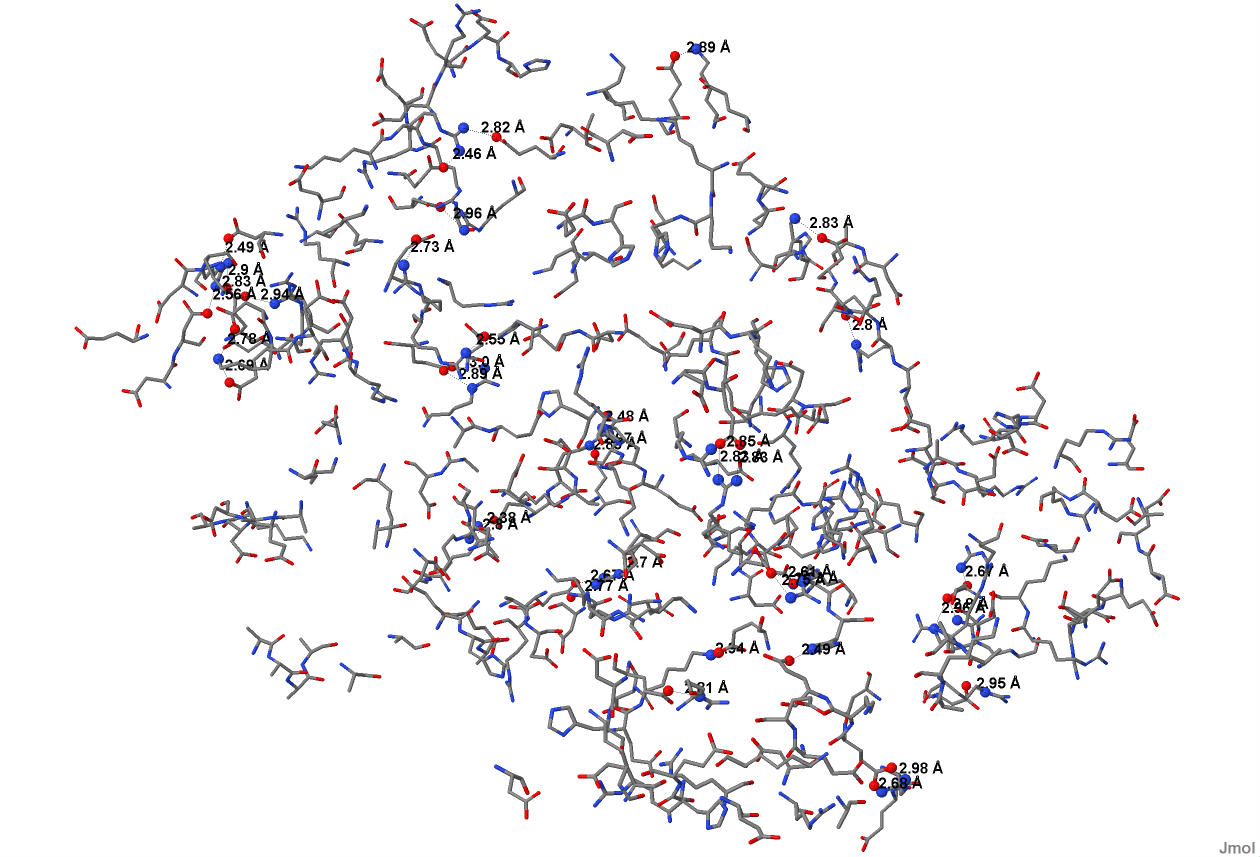
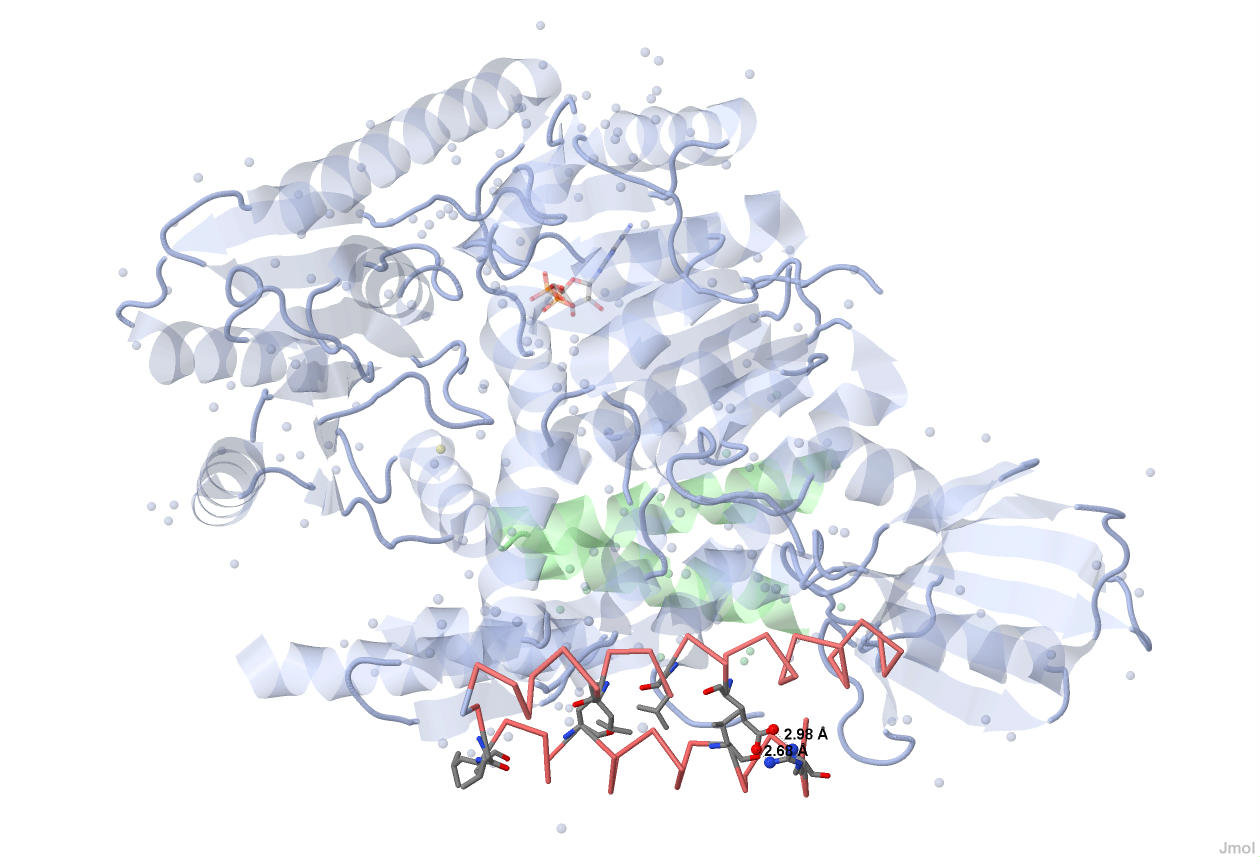
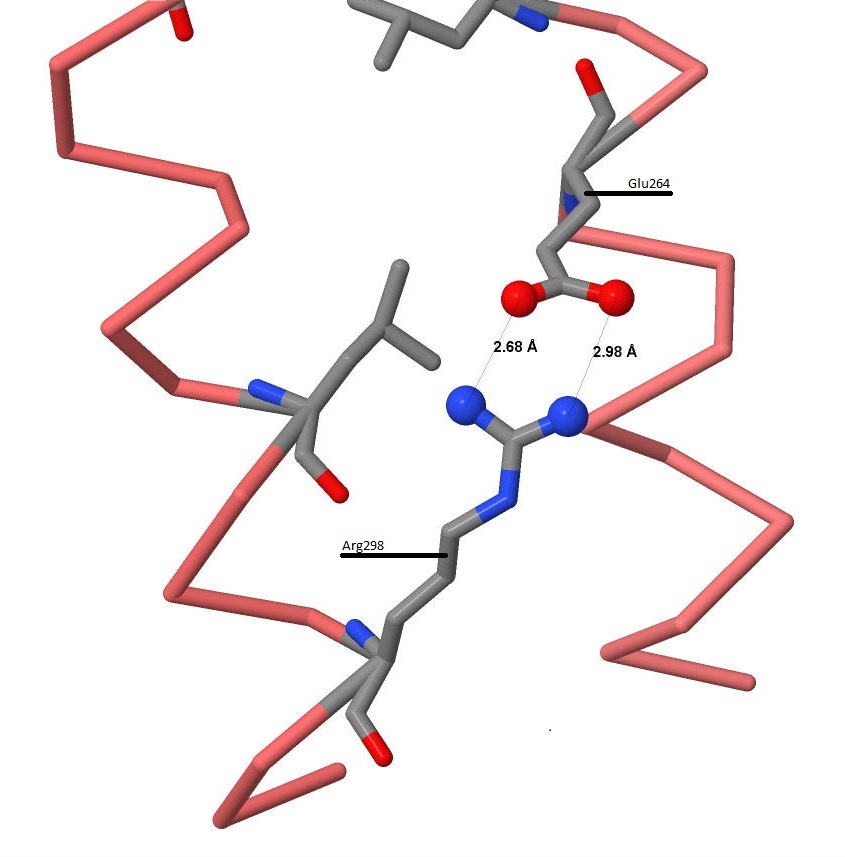
Солевые мостики в молекуле белка образуются благодаря ионным связям между радикалами отрицательно заряженных аминокислотных остатков (аспарагиновой и глутаминовой кислот) и радикалами положительно заряженных аминокислотных остатков (лизина, аргинина и гистидина).
Литература:
 О третичной структуре белка в WikipediA
О третичной структуре белка в WikipediA Об аминокислотах в WikipediA
Наверх
Об аминокислотах в WikipediA
Наверх