PubMed
| Поиск статей о Raf-1 в PubMed | ||||
| Запрос | Search details | Общее количество находок | Количество находок в открытом доступе | Количество обзоров |
| (raf-1[ti] or c-raf[ti]) and (function[ti]) | (raf-1[ti] OR c-raf[ti]) AND function[ti] | 12 | 10 | 1 |
| (raf-1[ti] or c-raf[ti]) and (cascade[ti]) | (raf-1[ti] OR c-raf[ti]) AND cascade[ti] | 37 | 20 | 1 |
| (raf-1[ti] or c-raf[ti]) and (nature[ta]) | (raf-1[ti] OR c-raf[ti]) AND "Nature"[Journal] | 11 | 0 | 0 |
| (raf-1[ti] or c-raf[ti]) and (2012[dp]) | (raf-1[ti] OR c-raf[ti]) AND 2012[dp] | 34 | 8 | 0 |
|
Related citations for "Raf-1 kinase inhibitor protein: structure, function, regulation of cell signaling, and pivotal role in apoptosis." |
242 | 101 | 42 | |
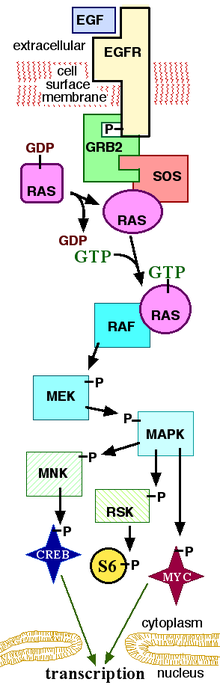
эпидермальный фактор роста (epidermal growth factor, EGF) связывается с внеклеточной частью своего рецептора (epidermal growth factor receptor, EGFR), вследствие чего цитоплазматическая часть EGFR фосфорилируется и взаимодействует с -SH2 группой связанного с ней белка (growth factor receptor bound protein 2, GRB2). Затем GRB2 связывается с SOS-фактором G-белка Ras, после чего SOS-фактор способен активировать Ras (связанный с Ras ГДФ заменяется на ГТФ). Активированный Ras фосфорилирует Raf-1 (mitogen-activated protein kinase kinase kinase, MAP3K), затем Raf-1 фосфорилирует MEK (mitogen-activated protein kinase kinase, MAP2K), затем MEK фосфорилирует MAPK (mitogen-activated protein kinase). Фосфорилированная MAPK активирует транскрибционный фактор Myc и другие белки.
О Raf-1 в статье "Angiogenic Sprouting Requires the Fine Tuning of Endothelial Cell Cohesion by the Raf-1/Rok-α Complex"
В статье описана роль Raf-1 в ангиогенезе.
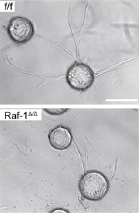
клеток дикого типа (сверху)
и мутантных клеток (снизу). Микробусины с нанесённой культурой в фибриновом геле.
Для изучения роли Raf-1 в ангиогенезе были получены мутантные мыши, у которых был удалён ген, кодирующий Raf-1. Отсутствие Raf-1 у мышей было подтверждено с помощью ПЦР (полимеразной цепной реакции), проведённой для ДНК, выделенной из клеток первичных микрососудов лёгких, с использованием праймеров к гену, кодирующему Raf-1. У мутантных мышей на шестые сутки после рождения была зафиксирована задержка развития сосудистой оболочки глаз. И, хотя в 2D-культуре мутантных клеток митотический и апоптотический индексы, а также способность клеток к миграции были не ниже, чем в культуре клеток дикого типа, культура мутантных клеток, нанесённая на микробусины и погружённая в фибриновый гель (3D-культура), оказалась практически неспособной к "прорастанию" - делению, линейной миграции и формированию сосудов, - а формировала подобие мезенхимы вокруг микробусин и имела повышенный апоптотический индекс. Аналогичная 3D-культура клеток дикого типа за трое суток образовала сосудистую сеть (см. рисунок 2).
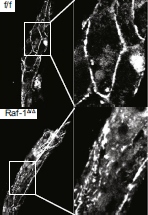
клеток дикого типа (сверху)
и мутантных клеток (снизу). Распределение VEC в клетках.
Известно, что для нормального формирования сосудов необходимо наличие VEC (VE-cadherin) в области межклеточных контактов, что и наблюдалось в 3D-культуре клеток дикого типа. В 3D-культуре мутантных клеток VEC был распределён диффузно (см. рисунок 3). Сходство 2D-культур клеток дикого типа и мутантных клеток можно объяснить одинаковым распределением в них VEC.
Известно, что VEC, содержащийся в области межклеточных контактов в нормально формирующихся сосудах, соединяется с актомиозиновой системой клетки посредством активного миозина II. В культуре клеток дикого типа была фосфорилирована MLC2 (myosin light chain 2). В культуре мутантных клеток количество фосфорилированной MLC2 в области межклеточных контактов было значительно меньше, чем в культуре клеток дикого типа, хотя в остальных частях мутантных клеток количество фосфорилированной MLC2 было таким же, как в клетках дикого типа. Известно, что степень фосфорилирования MLC2 в области межклеточных контактов обусловлена активностью Rok-α.
При выделении VEC из культур клеток дикого типа и мутантных клеток методом иммунопреципитации было обнаружено, что в клетках дикого типа VEC образует комплекс с Rok-α и с Raf-1, а в мутантных клетках VEC не образует комплекс даже с Rok-α, из чего можно сделать вывод, что Raf-1 необходим для образования комплекса VEC с Rok-α, который обеспечивает локализацию VEC в области межклеточных контактов, что необходимо для связывания VEC с фосфорилированной MLC2 и нормального формирования сосудов.
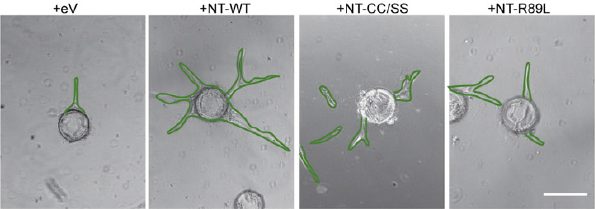
• в культуру мутантных клеток введён вектор, экспрессирующий GFP
• в культуру мутантных клеток введён вектор, экспрессирующий Raf-1, связанный с GFP
• в культуру мутантных клеток введён вектор, экспрессирующий мутантный Raf-1, связанный с GFP
(Raf-1 имеет мутацию в цистеин-богатом домене, что не позволяет Raf-1 способствовать образованию комплекса VEC с Rok-α)
• в культуру мутантных клеток введён вектор, экспрессирующий мутантный Raf-1, связанный с GFP
(Raf-1 имеет мутацию в N-концевом домене, что не позволяет Ras фосфорилировать Raf-1)
Литература:
 О Raf-1 в статье "Angiogenic Sprouting Requires the Fine Tuning of Endothelial Cell Cohesion by the Raf-1/Rok-α Complex"
Наверх
О Raf-1 в статье "Angiogenic Sprouting Requires the Fine Tuning of Endothelial Cell Cohesion by the Raf-1/Rok-α Complex"
Наверх