| Название по IUPAC | Acetylvalylvalyl-4-amino-3-hydroxy-6-methylheptanoylalanyl-4-amino-3-hydroxyl-6-methylheptanoic acid | |||
| Химическая формула | Ac-Val-Val-Sta-Ala-Sta | 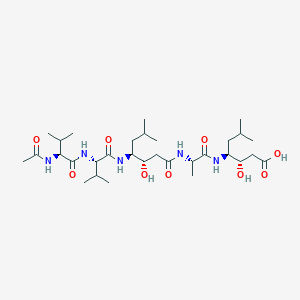 |
||
| Брутто-формула | C31H57N5O9 | |||
| Молярная масса | 643.823 г/моль | |||
| Ссылка на идентификатор в базе данных PubChem | 5481345 |
 |
Межмолекулярные взаимодействия
Межмолекулярные взаимодействия данного комплекса были изучены с помощью визуализатора Jmol. Между цепями в структуре 5HVP возможны следующие взаимодействия:
- Водородные связи
- Солевые мостики
- Гидрофобные контакты.
Водородные связи
Водородной связью называется электростатическое взаимодействие атома водорода, связанного с сильно электроотрицательным элементом, с другими атомами.
Водородные связи образует атом водорода, связанный с атомом кислорода или азота.
Данные о межцепочечных водородных связях комплекса 5HVP представлены в таблице 1.
| Всего | Между А и В | Между А и С | Между В и С | |
| Количество | 13 | 11 | 2 | 0 |
| Средняя длина | 2,91Å | 2,96Å | 2,85Å |
Как видно из этой таблицы, большинство межцепочечных водородных связей образуются между субъединицами протеазы, т.е. цепями А и В.
Молекула лиганда образует всего две водородных связи с цепью А. Кроме того, средняя длина водородных связей между лигандом и белком немного меньше, чем между цепями протеазы.
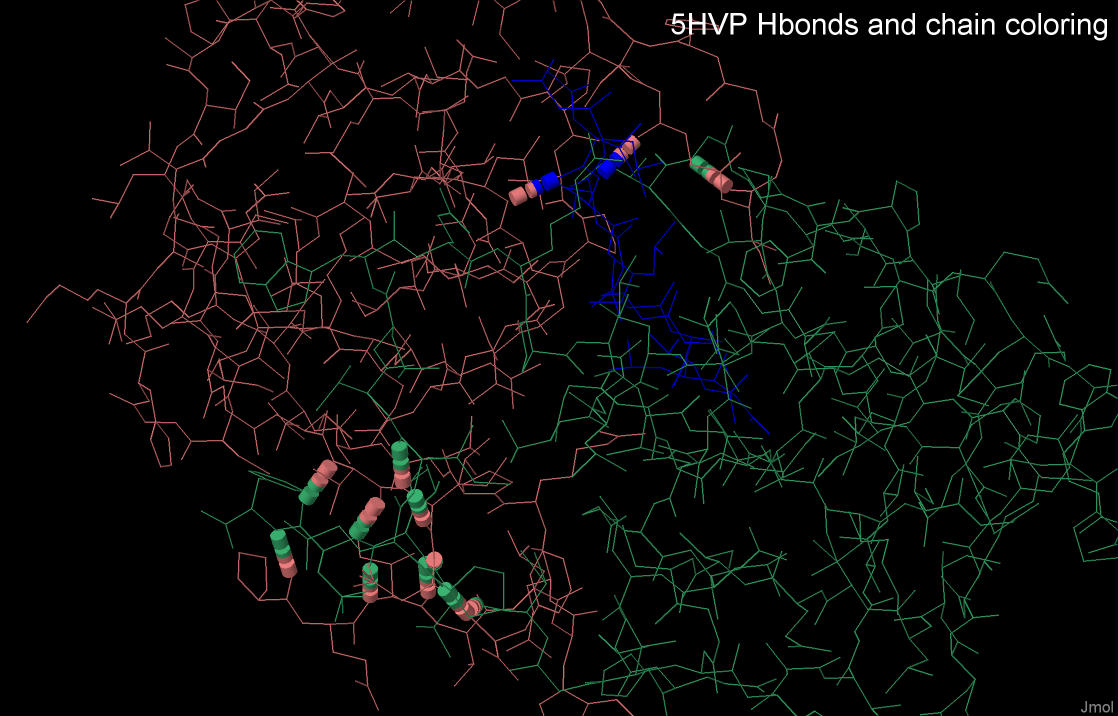
Гидрофобные контакты в структуре белка.
С помощью сервиса CLuD [4] была определена структура гидрофобных кластеров белка.
Стоит выделить единственное оформленное гидрофобное ядро комплекса, состоящее из большинства гидрофобных остатков изучаемого белка.
На модели белка можно заметить, что структура гидрофобного ядра пронизывает обе субъединицы белка, так что можно предположить, что гидрофобные контакты играют важную роль в поддержании третичной структуры ВИЧ-протеазы 5HVP.
Плотность упаковки атомов в гидрофобном ядре.
В качестве гидрофобного остатка для исследования плотности упаковки атомов в гидрофобном ядре был выбран 259-ый остаток бета-цепи, тирозин ([TYR]259:B), ввиду крупного размера его структуры. Для работы с гидрофобным ядром остаток был определён в сценарии как MyResidue.
По визуализации ван-дер-ваальсовых радиусов окружения остатка в JMol видно, что на расстоянии 5 ангстрем происходит покрытие атомов остатка атомами окружения, что говорит о плотной упаковке атомов гидрофобного ядра.
Путём ручных измерений расстояний между не связанными ковалентными связями атомами в модели комплекса было установлено приблизительное среднее расстояние - 3.75 ангстрем.
Для ответа на вопрос, возможно ли помещение еще одного атома между соседними, не связанными ковалентно атомами белка, следует определить ван-дер-ваальсовы радиусы атомов.
В данной работе воспользуемся данными по Полингу: углерод - 1.85 ангстрема, азот - 1.54 ангстрема, кислород - 1.4 ангстрема, сера - 1.85 ангстрема [5]. Возьмём за помещаемый атом молекулу воды, так как можно принять её за атом кислорода, пренебрегая атомами водорода.
В таком случае, учитывая диаметр кислорода, равный 2.8 ангстремам, и вычисленное выше среднее расстояние между не связанными ковалентными связями атомами, 3.75 ангстрем, помещение молекулы воды между соседними атомами не представляется возможным.
Солевые мостики
Солевой мостик в биохимии белков — относительно слабая ионная связь между положительно и отрицательно заряженными боковыми
радикалами аминокислотных остатков в белке,
это взаимодействие относится к электростатическим. Ионные связи добавляют стабильности структуре белков. Расстояние между атомами - не более 4 Å.
Аминокислотные остатки, которые могут образовывать солевые мостики: Asp и Glu (т.к. несут в боковом радикале отрицательно
заряженные карбоксильные группы);
Arg, Lys и His (т.к. несут в боковом радикале положительно заряженные атомы). Данные взаимодействия подчиняются закону Кулона.
Свободная энергия
образования солевых мостиков зависит от среды, в которой они локализованы.
Во внутренней неполярной области белка данная величина составляет порядка –
5 ккал/моль, а в
приповерхностных слоях белка – в 10-20 раз меньше.
Также при помощи визуализатора Jmol было получено изображение солевых мостиков белка 5HVP.
Кроме того, используя визуализатор Jmol, было подсчитано количество ионных связей в комплексе 5HVP:
13 солевых мостиков между аминокислотами внутри цепей и 2 солевых мостика между цепями А и В.
Авторский вклад
Проект выполнен командой первоклассных первокурсных биоинформатиков, в числе которых Орлов Артём, Сидлярчук Вадим и Щигал Ольга.
ОЩ изучала водородные связи и создала html страницу, АО работал над гидрофобными взаимодействиями и плотностью упаковки в гидрофобном ядре.
ОЩ и АО совместно настраивали JSMol апплеты. ВС обратил внимание на особенность данной биомолекулы, взял на себя поиск информации об отличительных свойствах и функциях, а так же изучил ионные взаимодействия.