Моделирование поведения пептида в формамиде
Шестой семестр
Подготовка системы и проведение молекулярной динамике
Система:
- Пептид: 15 остатков, 243 атома- Формамид: 901 остаток, 5406 атомов
- Йоны: 1 Na+
Всего: 917 остатков, 5650 атомов

Параметры молекулярной динамики:
Силовое поле используемое при построении топологии топологии: AMBER99SBЗаряд системы: 0, т.к. в системе 2 аспартата, 1 аргинин и 1 Na+
Размер и форма ячейки: прараллелепипед, 4nmx4nmx5nm
Минимизация энергии:
Алогритм минимизации энергии: l-bfgs
Алгоритм расчёта электростатики и Ван-дер-Ваальсовых взаимодействий: Cut-off
Модель растворителя: TIP3P
Утряска растворителя:
Для биополимеров, укажите параметр который обуславливает неподвижность биополимера: constraints = all-bonds
Число шагов: 10000
Длина шага: 0.001 ps
Алгоритм расчёта электростатики: PME
Алгоритм расчёта Ван-дер-Ваальсовых взаимодействий: Cut-off
Алгоритм термостата: V-rescale
Алгоритм баростата: no
Основной расчёт МД:
Время моделирования, количество процессоров, эффективность маштабирования: 10 ч, 16 процессоров
Длину траектории: 20 ns
Число шагов: 10000000
Длина шага: 0.002 ps
Алгоритм интегратора: md
Алгоритм расчёта электростатики: PME
Алгоритм расчёта Ван-дер-Ваальсовых взаимодействий: Cut-off
Алгоритм термостата: V-rescale
Алгоритм баростата: Berendsen
Визуальный анализ поведения системы
 |
 |
 |
 |
| t=0 ns | t=4.2 ns | t=7.4 ns | t=16.2 ns |
α-спираль ни разу не расплавляется до конца. Большую часть времени расплетаетен один виток (t=4.2), сильнее всего α-спираль расплетается в моменты t=7.4 ns и t=16.2 ns, однако после этого она практически полностью восстанавливается.
Определение средне-квадратичного отколнения
Средне-квадратичное отколнение относительно стартовой структуры.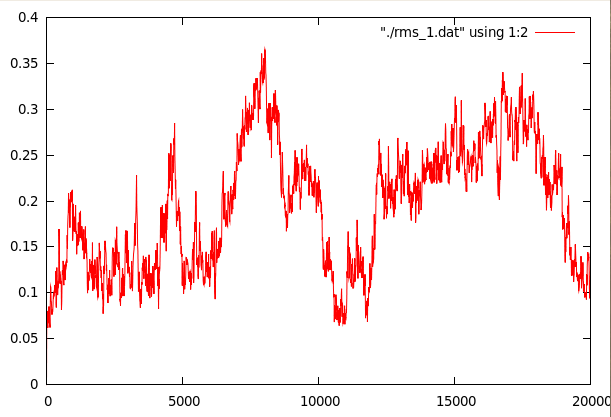
Средне-квадратичное отколнение с шагом в 400 фреймов.
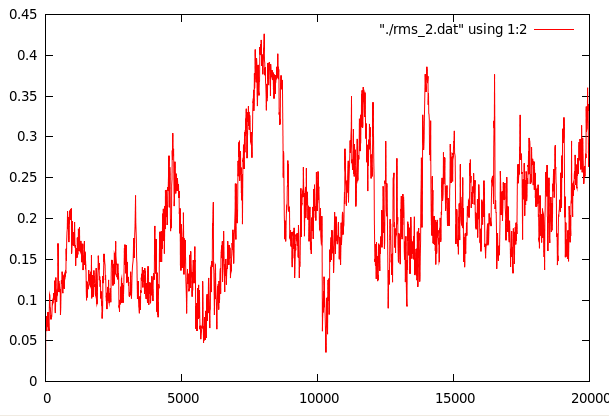
На первом графике видно 2 пика, соответствующих сильному плавлению спирали на 7 и 15 ns. Хотя второй график и выглядит чуть более сглаженым, нельзя сказать, что конформационные переходы закончились.
Определение изменения гидрофобной и гидрофильной поверхности в ходе конформационного перехода
Изменение гидрофобной и гидрофильной поверхностей, доступных растворителю от времени (красный - гидрофобная, зеленый - гидрофильная):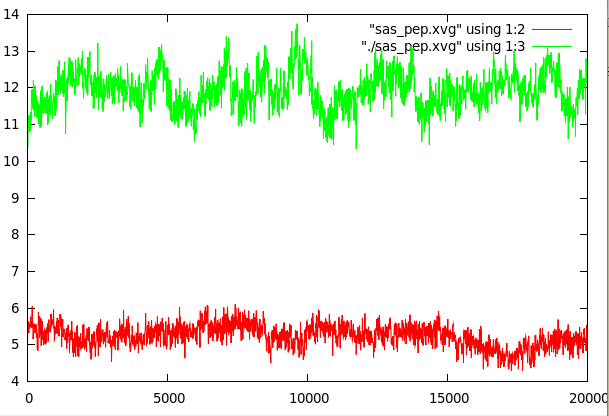
Определение количества вдородных связей
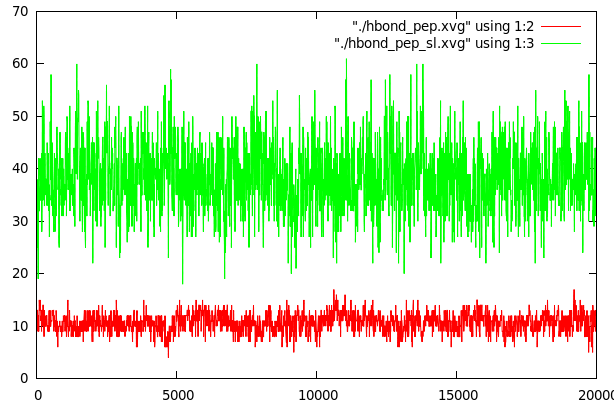
Водородные связи внутри пептида (красный) и между пептидом и формамидом: