Описание области контакта c лигандом Ca+2(1275 ) в структуре белка β-порфириназа из бактерии Zobellia galactanivorans
Ca+2 в структуре белка β-порфириназа A (идентификатор PDB 4ATE).
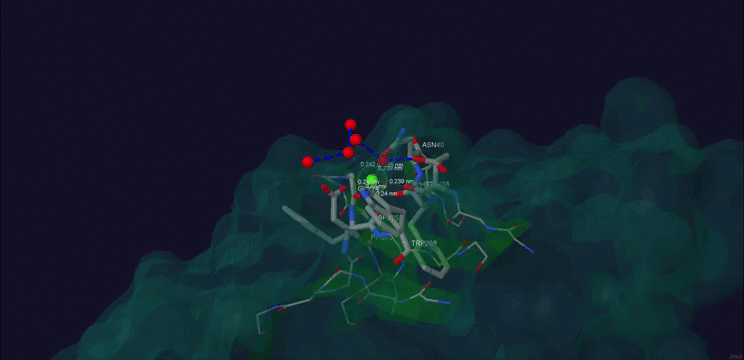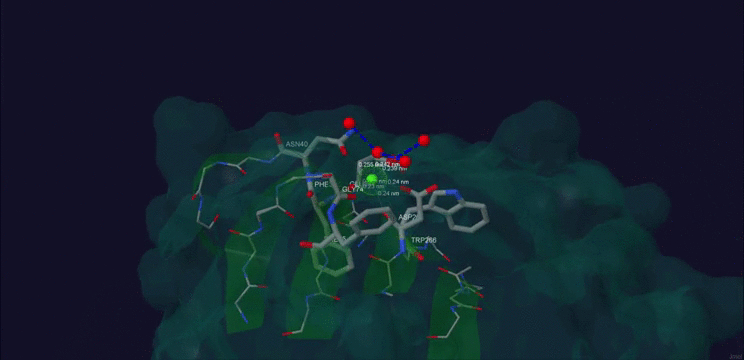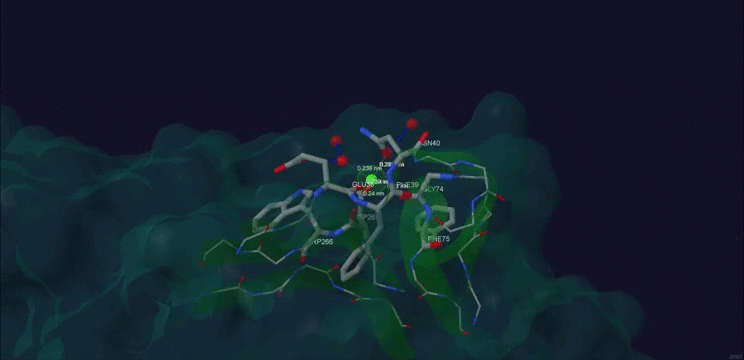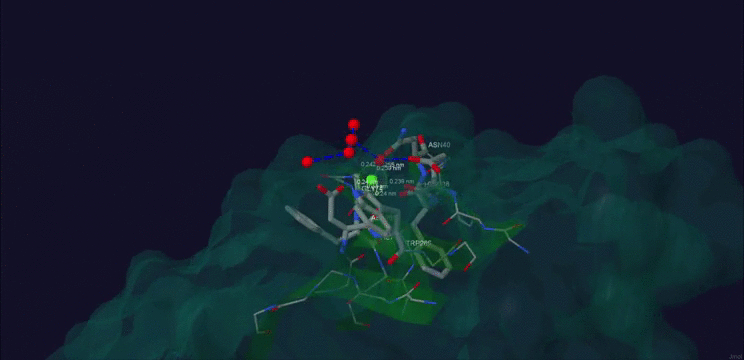
Рис. 1. Ca+2 в структуре белка β-порфириназа A из бактерии Zobellia galactanivorans.
Таб. 1.Некоторая информация о Ca+2 в структуре белка β-порфириназа A из бактерии Zobellia galactanivorans.
| Русское название | Ион Ca+2 < |
| Английское название | Mol_id: 1; |
| название в файле PDB | 1275(CA) |
Область контакта c лигандом Ca+2 в структуре белка β-порфириназа A из бактерии Zobellia galactanivorans (идентификатор PDB 4ATE)
На рис.1 и рис.2 приведено изображение области контакта лиганда и белка. Рис. 1 получен с помощью этого скрипта.
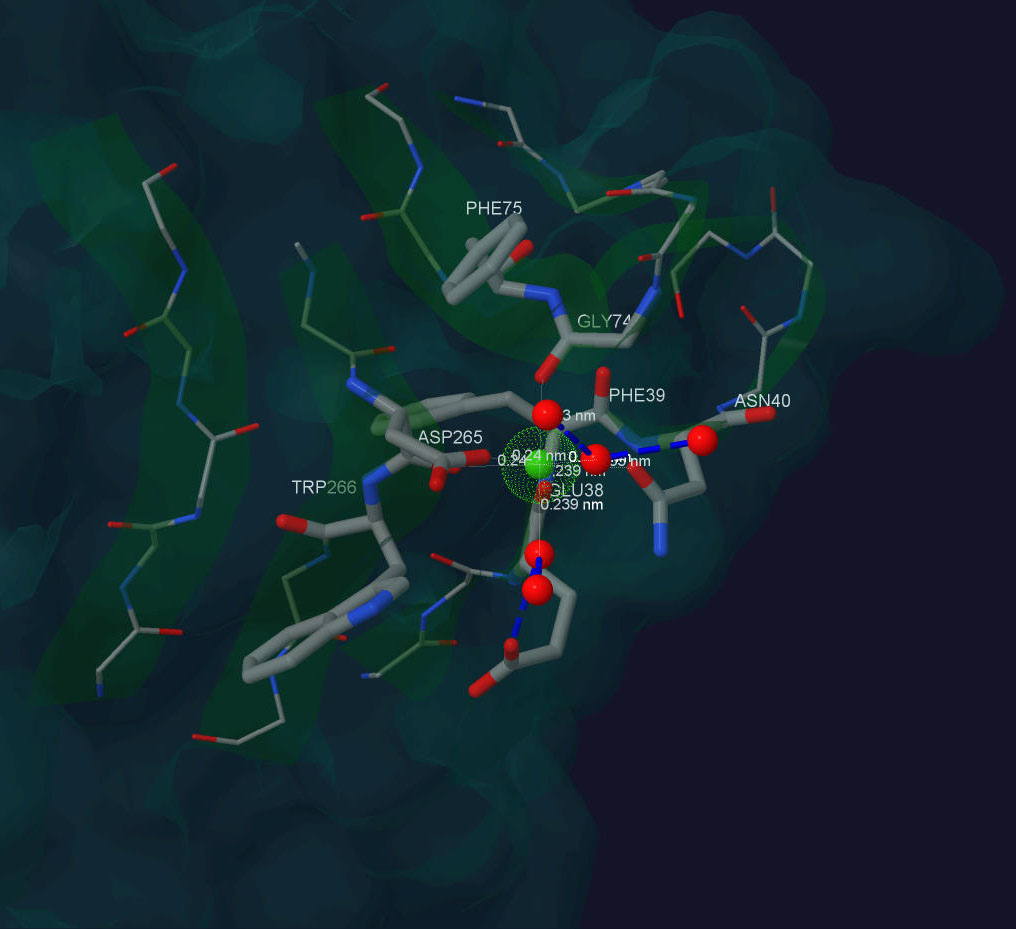
Рис. 2. Ca+2 в структуре белка β-порфириназа A из бактерии Zobellia galactanivorans.
Проект генно-инженерного эксперимента с β-порфириназа A из бактерии Zobellia galactanivorans (идентификатор PDB 4ATE)
Для того, чтобы предположить, какая аминокислотная замена в центре связывания лиганда приведет к изменению способности белка связывать его, а какая - нет, можно обратиться к схеме, отображающей относительную оценка подобия аминокислот http://molbiol.ru/appendix/02_01.html.
Из нее видно, что если, к примеру, заменить Asp265 на глутаминовую кислоту, то, скорее всего, ничего не изменится. Хотя та же таблица утверждает, что и при замене ее на аргинин ничего не изменится, но, скорее всего, здесь не учитывается то, что Ca+2 удерживается ионными взаимодействиями, чего аспарагин дать не сможет.
При замене же, к примеру, на её на пролин, белок, скорее всего, потеряет способность связывать лиганд, так пролин вызовет очень сильные искажение в его[белка] структуре.
После этих предположений я решил проверить догадки с помощью SWISS-Model(спасибо Дарье Дибровой за указание на этот ресурс). В результате оказалось, что при замене Asp265 на Glu способность белка связывать Ca+2 не уменьшается, а даже увеличивается. Изображение модифиципрованного белка рис.3.
В случае с заменой на пролин белок не потерял способность к связыванию иона кальция, но она существенно ослабла. Результат можно увидеть на рис. 4 Добиться же полной неспособности не получается, так SWISS-Model не способен к настолько точному докингу белка.
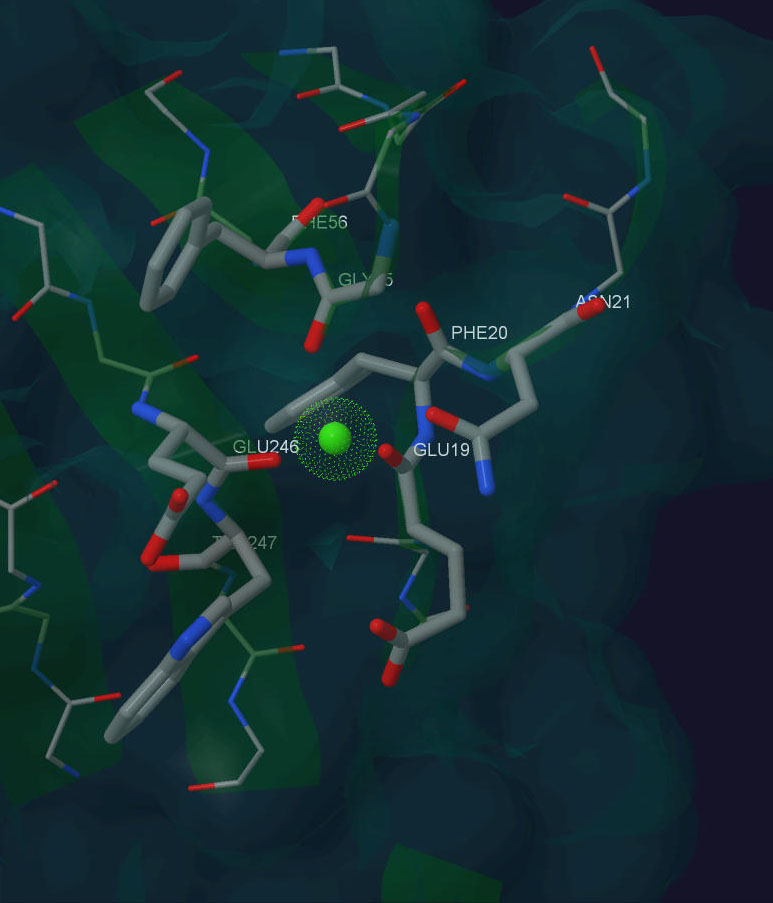
Рис. 3. Ca+2 в структуре мутантного белка β-порфириназа A Asp265-Glu из бактерии Zobellia galactanivorans.
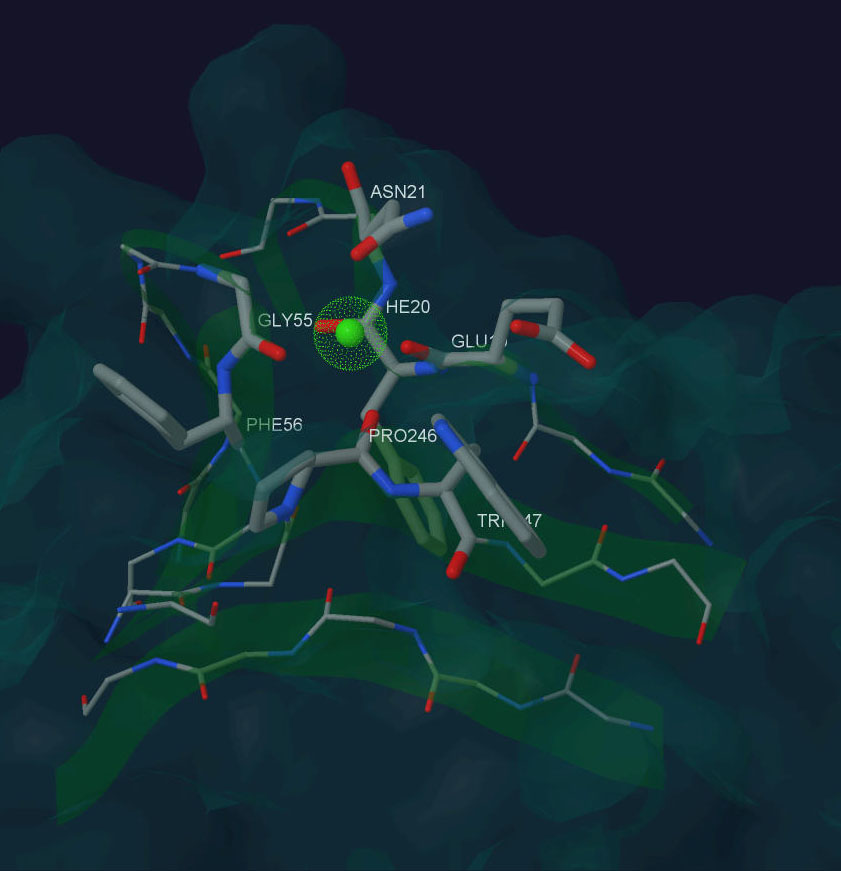
Рис. 4. Ca+2 в структуре мутантного белка β-порфириназа A Asp265-Pro из бактерии Zobellia galactanivorans.
