Лиганды в структуре 2Z3B
В 12-и цепочном белке ClpQ находятся в качестве лигандов 12 ионов натрия, в каждой цепи по одному иону (Рис. 1).
Сравнение размеров белка и лигандов.
Условная длина белка 157 Å (15.7 нм или 15.7 * 10−9 м), ширина 104 Å (10.4 нм или 10.4 * 10−9 м), а выстоа 66 Å
(6.6 нм или 6.6 * 10−9 м). Радиус иона натрия, судя по таблице радиусов атомов, 1.9 Å (0.19 нм или 0.19 * 10−9 м)
Функция лигандов белка ClpQ
Поскольку белок ClpQ является субъединицей пептидазы, то его основной целью является разрушение пептидного субстрата. Делает он это, катализируя
гидролиз ковалентных связей. На основании этого можно предположить, что положительно заряженные ионы натрия будут оказывать воздействие на субстрат,
создавая полярность, приводящую к нарушению стабильности ковалентной связи с её полседующим гидролизом.
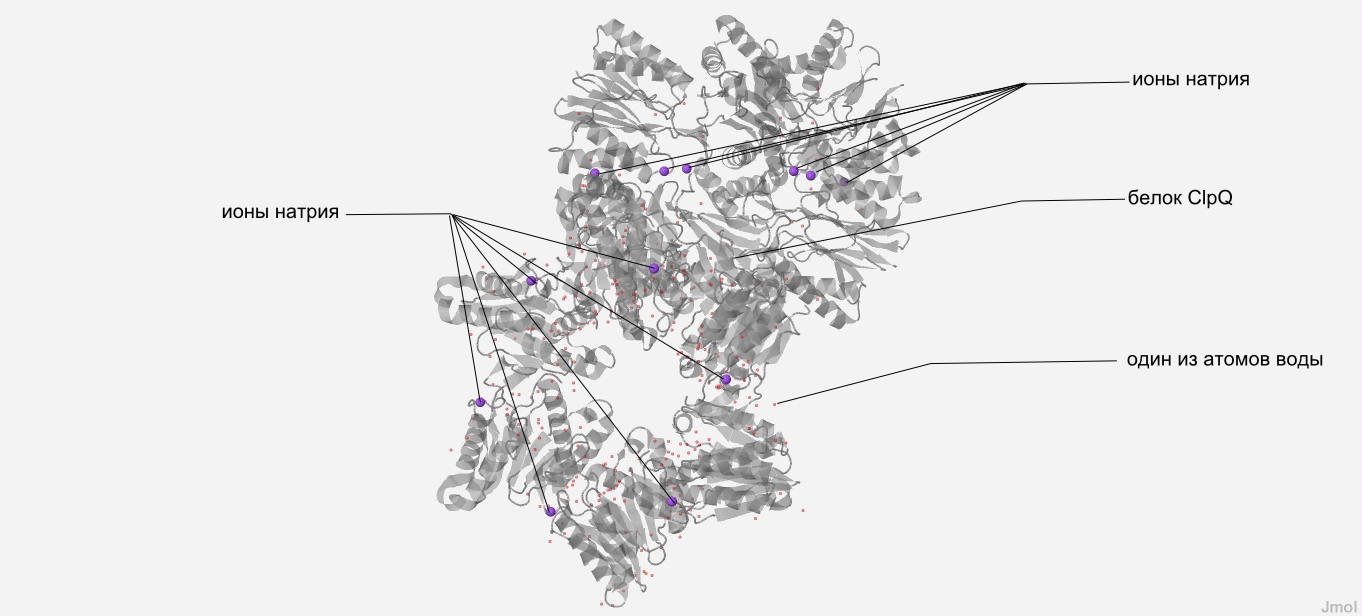 |
| Рис. 1 На структуре белка ClpQ, показаной полупрозрачно, отмечены: красными точками-вода; серым-остальные структуры, кроме лигандов (ионов натрия), которые обозначены фиолетовыми сферами. |
Анализ области контакта белка из структуры PDB 2Z3B и иона натрия (англ. Sodium ion).
Для анализа области контакта белка ClpQ и его лиганда (иона натрия) выбрана область, находящаяся в цепи А.
Ион натрия изображается в виде фиолетовой сферы (Рис. 2).
Судя по Рис. 2 ион натрия удерживается ионным взаимодействием с карбонильными группами остатков Gly 164,Thr 170 и Cys 167, т.к. расстояния между ними и ионом натрия сравнительно небольшие.
Иллюстрация химического взаимодействия представлена на Рис. 3
Для создания Рис. 1 и Рис. 2 был использован этот скрипт, написанный на языке Jmol.
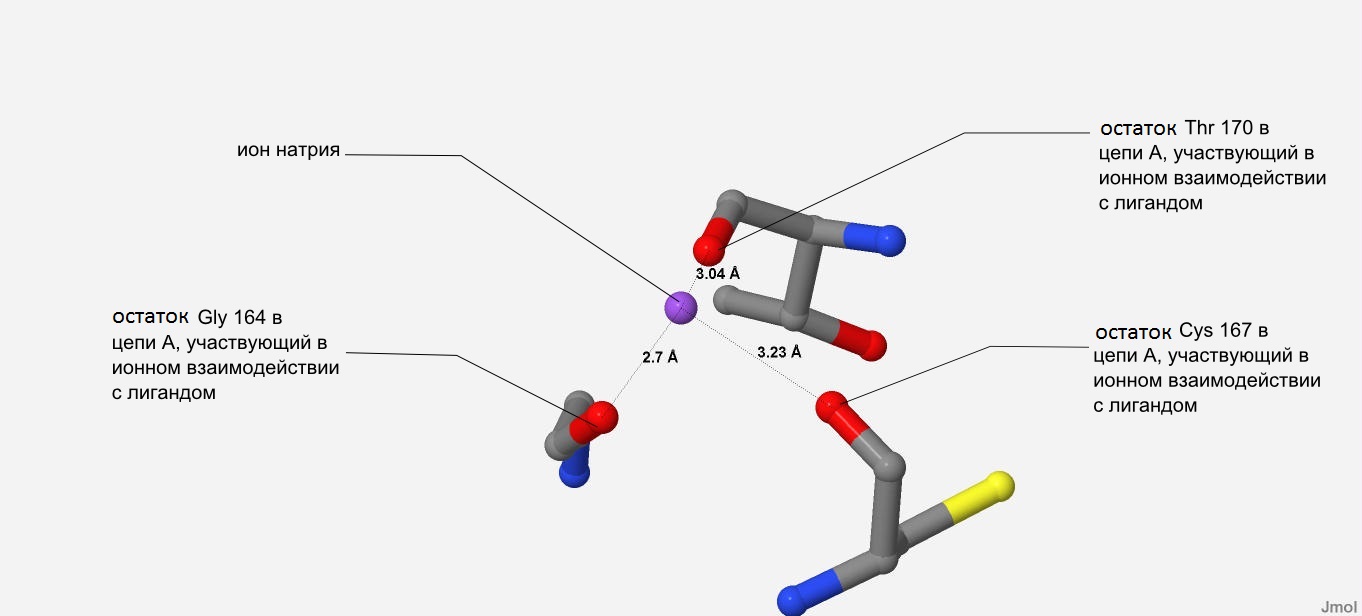 |
| Рис. 2 Область контакта белка ClpQ и его лиганда (иона натрия), находящаяся в цепи А. Ион натрия показан фиолетовой сферой. Он окружен остатками Gly 164,Thr 170 и Cys 167. Их карбонильные группы обозначены красным цветом, а имино группы - синим. Пунктирной линией с соответствующими подписями обозначены расстояния от иона натрия до карбонильных групп Gly 164,Thr 170 и Cys 167. |
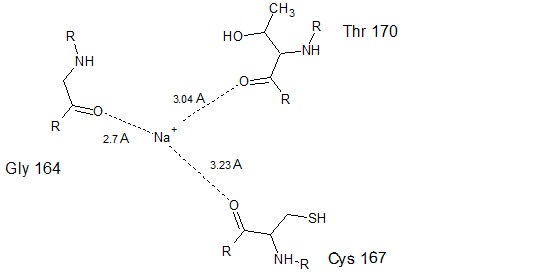 |
| Рис. 3 Схема химического взаимодействия иона натрия и карбонильных Gly 164,Thr 170 и Cys 167 в цепи А белка ClpQ. Пунктирной линией показаны ионные взаимодействия. Символом R обозначены продолжения белковой цепи. |
Проект генно-инженерного эксперимента с белком из структуры 2Z3B
Предположим, что нам нужно, что бы белок потерял возможность связывать лиганд.
Тогда мы должны внести деструктивный фактор в область контакта белка. Идеальным деструктивным фактором будет замена одного из остатков незаряженных Gly 164,Thr 170 и Cys 167 либо на остаток отрицательно заряженный (Asp или Glu), что приведет к чрезмерному связыванию иона натрия; либо на остаток положительно заряженный (Arg или Lys),что приведет к нарушению ионного взаимодействия и, как результат, "выталкиванию" иона натрия из его прежнего положения.
Предположим, что нам нужно, что бы белок сохранил возможность связывать лиганд.
Тогда мы должны изменить какой-либо из незаряженных остатков (Gly 164,Thr 170 и Cys 167), на незаряженый (Ala, Val, Leu, Ile, Met, Pro) или на нейтрально заряженый (Asn или Gln), при допущении, что гидрофильность\гидрофобность влияет незначительно.
