- Идентификатор белка в БД PDB: 2Z3B
- Название белка на русском языке: ClpQ-субъединица двухкомпонентной АТФ-зависимой протеазы
(ATP-dependent protease subunit ClpQ) - В PDB файле представлено 12 цепей белка.
- В белке находится дополнительно 12 атомов иона натрия, в каждой цепи по одному иону.
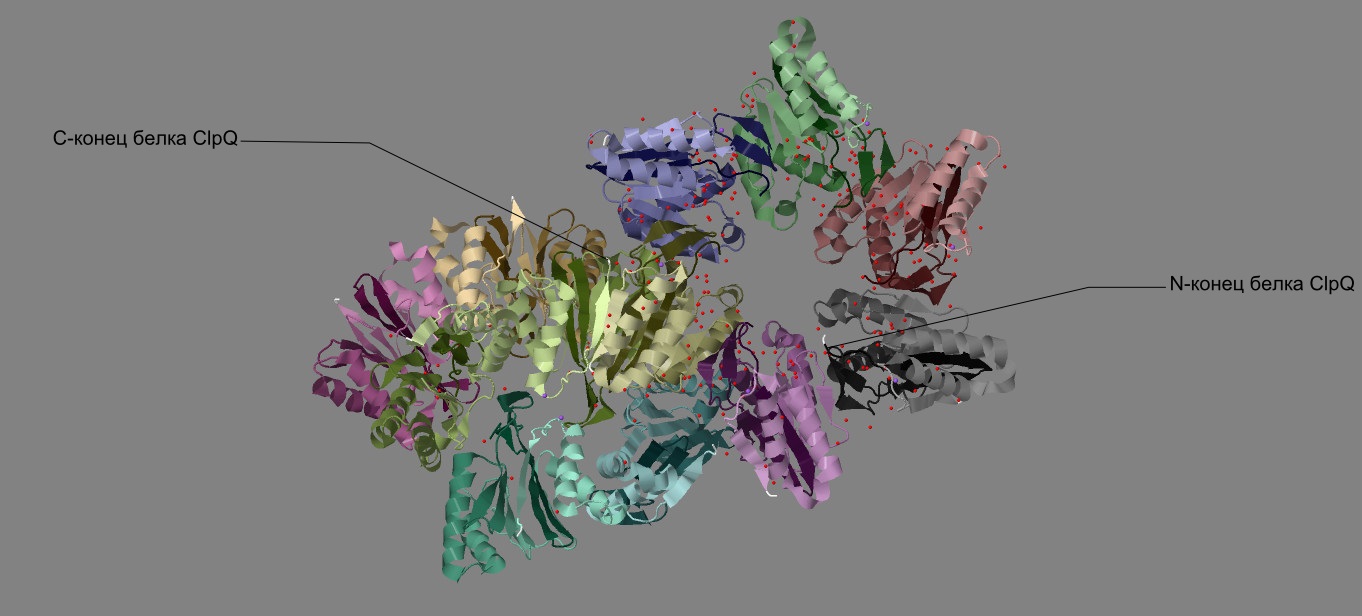 |
| Рис. 1 Структура белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы, вид прямо.
Каждая из двенадцати цепей раскрашена градиентом от темного (от начала) к светлому (к концу) индивидуальным оттенком цвета. |
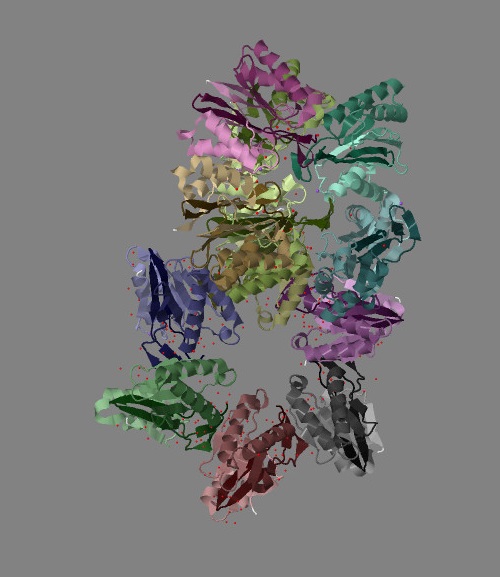 |
| Рис. 2 Структура белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы, вид слева.
Каждая из двенадцати цепей раскрашена градиентом от темного (от начала) к светлому (к концу) индивидуальным оттенком цвета. |
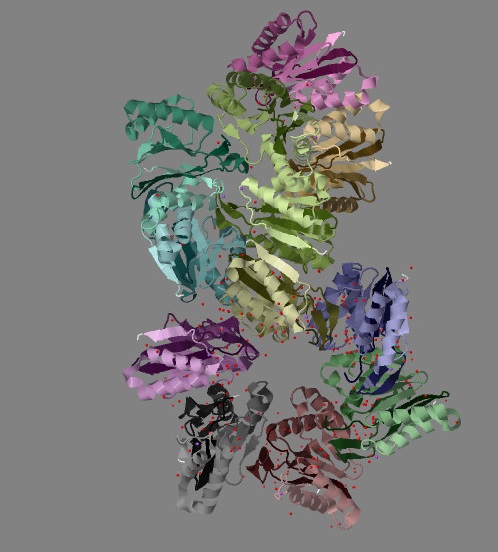 |
| Рис. 3 Структура белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы, вид справа.
Каждая из двенадцати цепей раскрашена градиентом от темного (от начала) к светлому (к концу) индивидуальным оттенком цвета. |
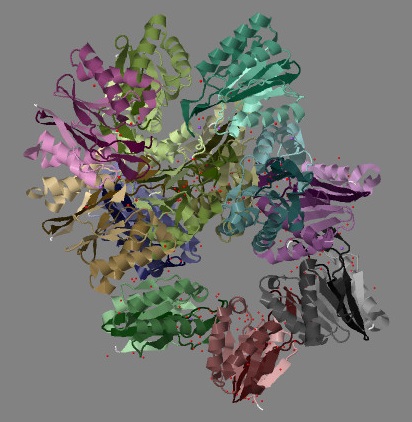 |
| Рис. 4 Структура белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы, вид сверху.
Каждая из двенадцати цепей раскрашена градиентом от темного (от начала) к светлому (к концу) индивидуальным оттенком цвета. |
Анализ структуры альфа-спиралей и бета-листов в цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы.
Цепь А белка содержит 6 α-спиралей(Рис. 5) и 3 β-листа (Рис. 6) (с 4-я, 2-я и 5-ю β-тяжами соответственно).
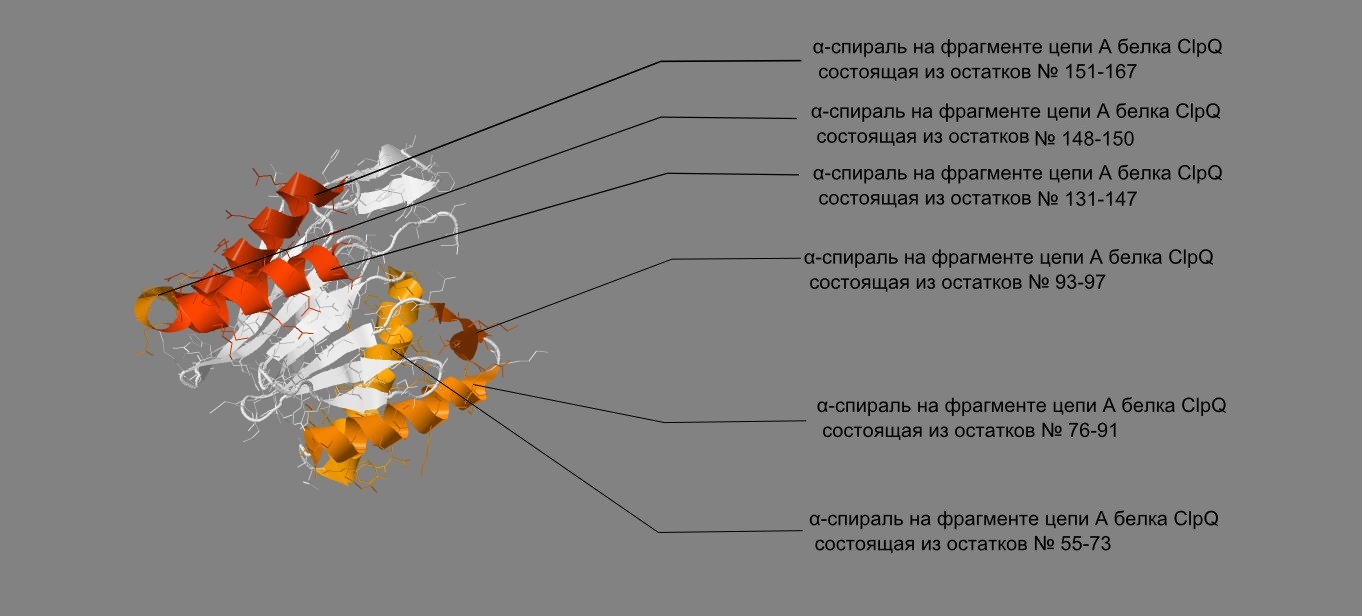 |
| Рис. 5 Различными оттенками оранжевого представлены 6 различных α-спиралей на фрагменте цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы. |
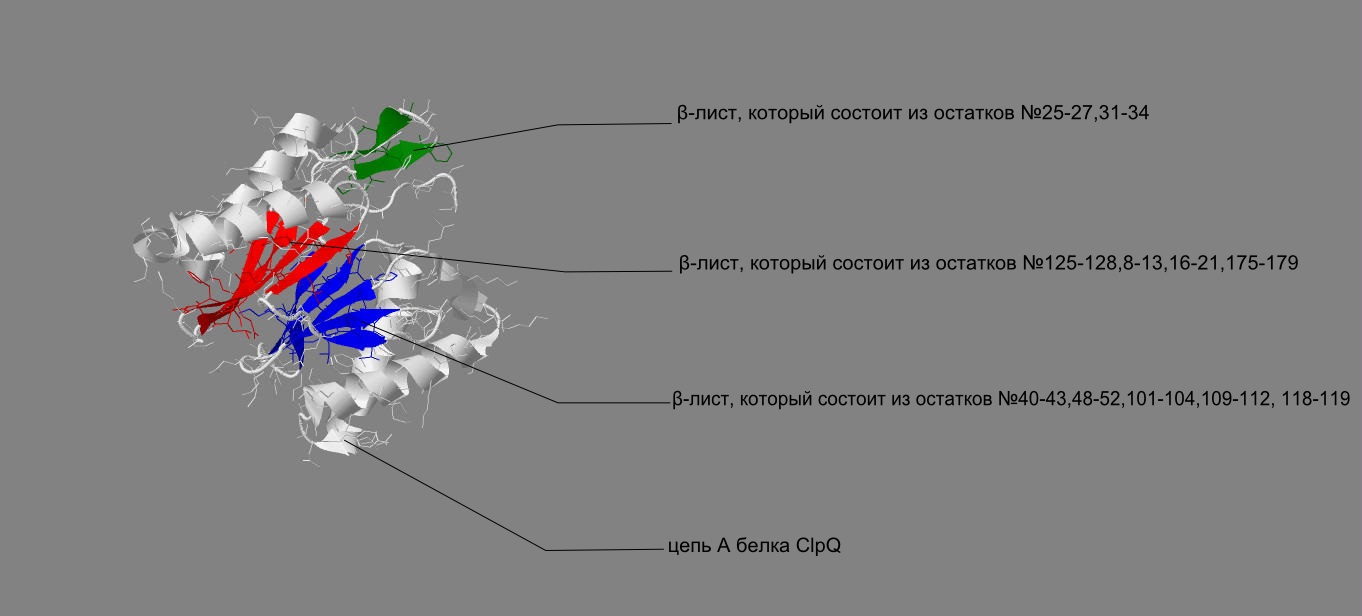 |
| Рис. 6 Красным, зеленым и синим изображены 3 β-листа, представленные на фрагменте цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы. |
c α-спиралью, состоящей из остатков с номерами 55-73. (на рис. 5 отмечена цветом охры).
Рассмотрим α-спираль, состоящую из остатков с номерами 55-73.
| Количество целых витков | 5 |
| Остатков аминокислот на виток | 4 (примерно) |
| Длина спирали | 27Å |
| Шаг спирали | Если брать длину и делить на к-во витков, то 5,4 Å. Если брать среднее значение из 4-х измерений, то 5.5 Å. |
Остаток с номером n, если он в середине цепи, образует водородные связи с остатками n+4 и n-4 , т.к.
остатков на виток 4, а остаток n образует водородную связь своей аминогруппой с
карбоксильной группой n-4 -го остатка и образует водородную связь своей карбоксильной группой с
аминогруппой n+4 -го остатка. Строение спирали, для которой это применимо, показано на рис. 7.
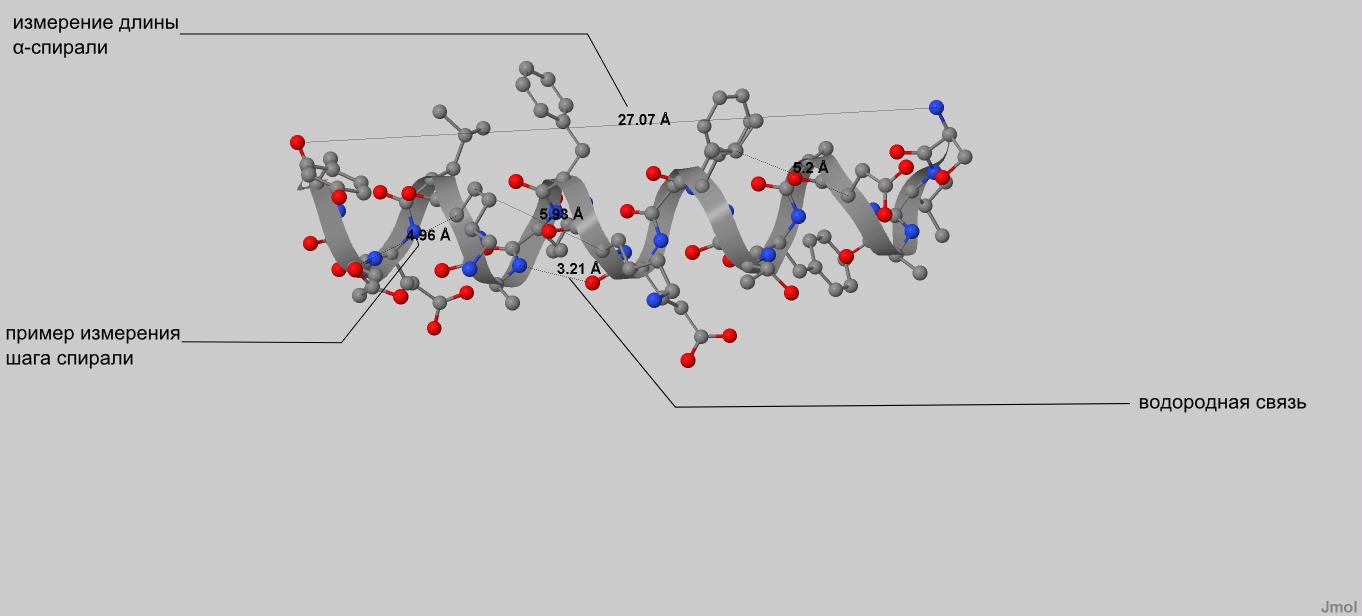 |
| Рис. 7 α-спираль, состоящая из остатков с номерами 55-73. |
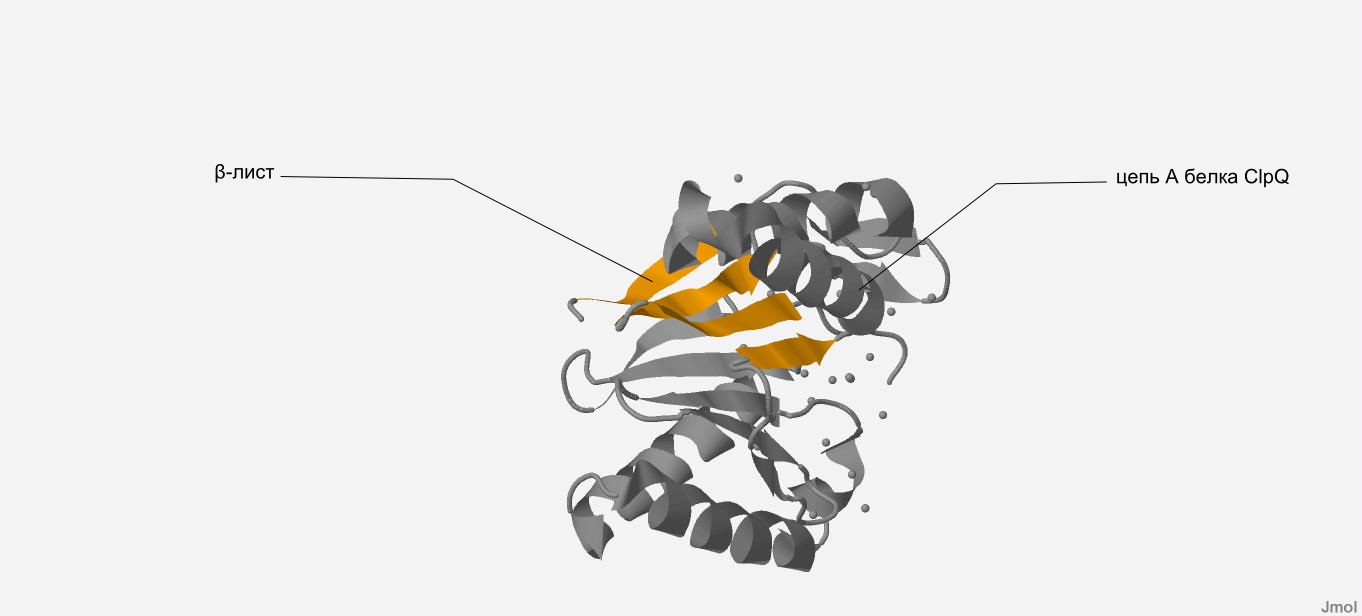
Мы рассмотрим β-лист, который состоит из остатков №125-128,8-13,16-21,175-179.
В данном β-листе наблюдается наличие антипараллельных тяжей, т.к. два последовательно взятых тяжа противоположно направленны. (рис. 8, рис. 9) Кроме того, этот β-лист имеет плоскую форму с небольшим изгибом.
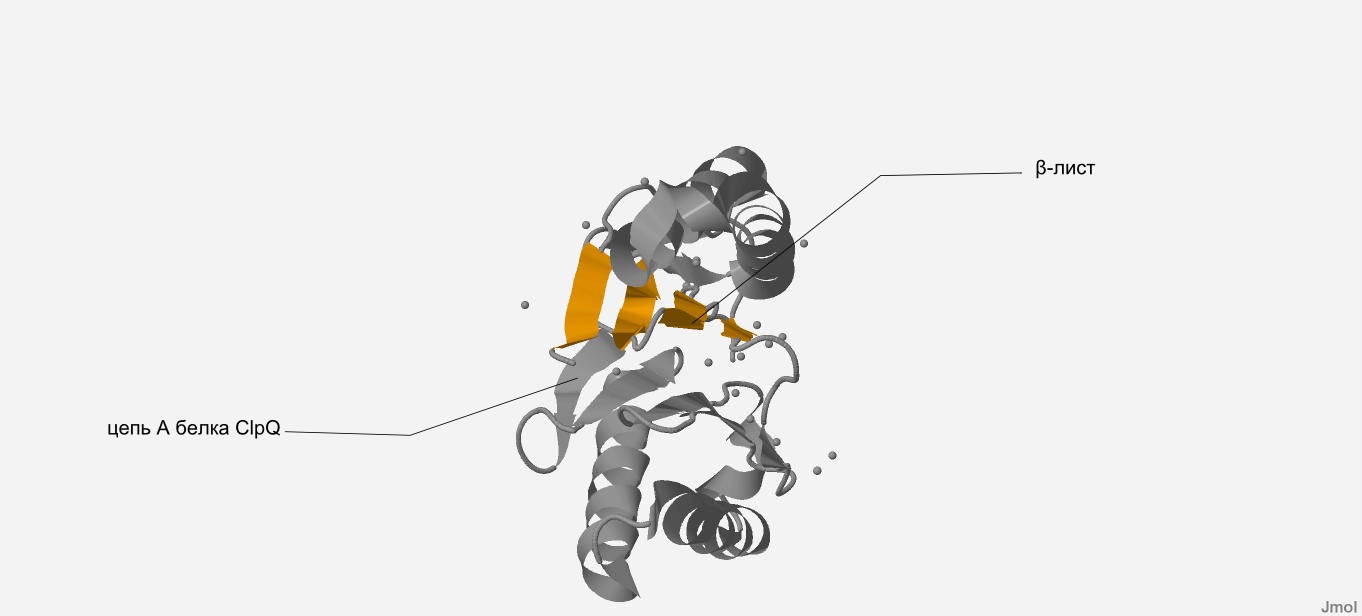 |
| Рис. 8 В цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы желтым показан β-лист, который
состоит из остатков №125-128,8-13,16-21,175-179 (вид прямо). |
 |
| Рис. 9 В цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы желтым показан β-лист, который состоит из остатков №125-128,8-13,16-21,175-179 (вид сбоку). |
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры белка 2Z3B
На основе данных pdb файла, в белке находится 12 остатков цистеина, по одному на каждую цепь,
но они слишком далеко друг от друга, что бы образовывать дисульфидные связи (Рис. 10).
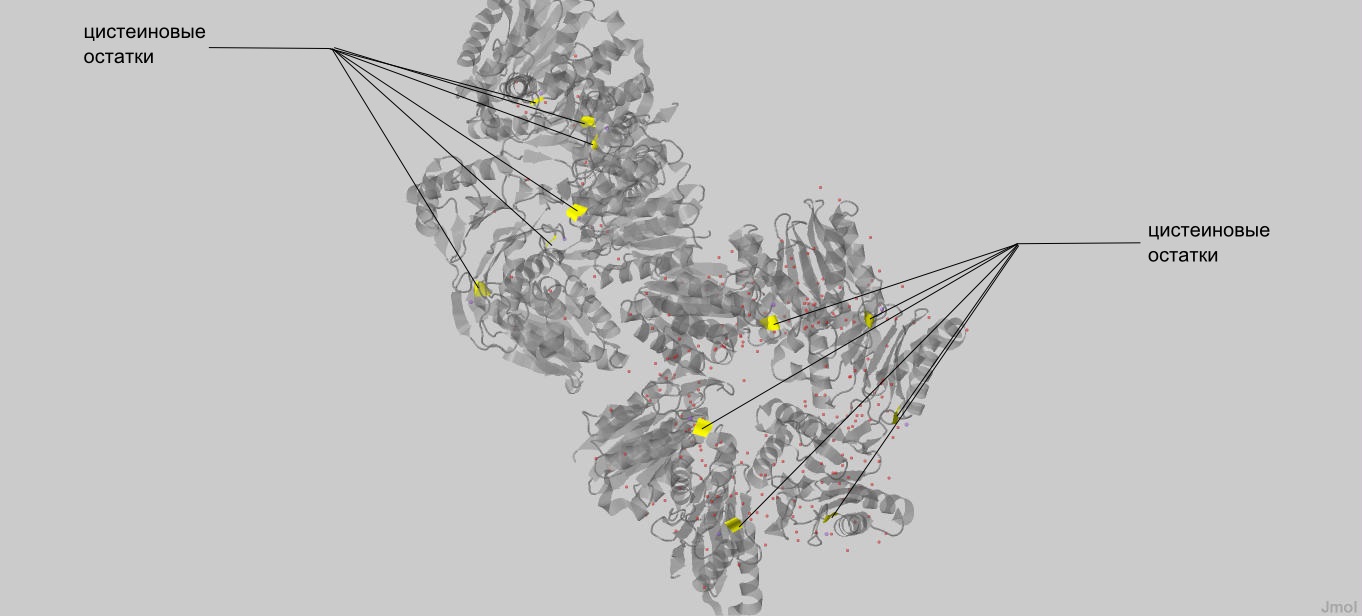 |
| Рис. 10 На сером фоне в структуре белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы желтым обозначены остатки цистеина. |
Солевые мостики (ионная связь) может образовываться между положительно заряженными
остатками (аргинин, лизин, гистидин) и отрицательно заряженными (аспарагиновая кислота и глутаминовая кислота).
Длина такой связи не больше 4 Å, соляные мостики присутствующие в структуре 2Z3B представлены на рис. 11, рис. 12 и рис. 13.
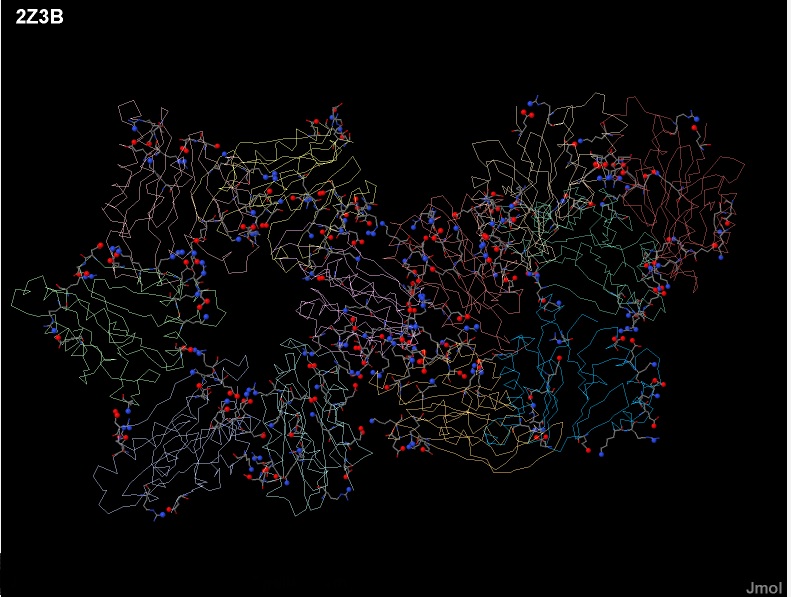 |
| Рис. 11 В белке ClpQ-субъединице двухкомпонентной АТФ-зависимой протеазы показаны все соляные мостики.
Атомы участвующие в образовании соляного мостика обозначены более крупными сферами, положительно заряженные обозначены синим цветом,а отрицательно-красным. |
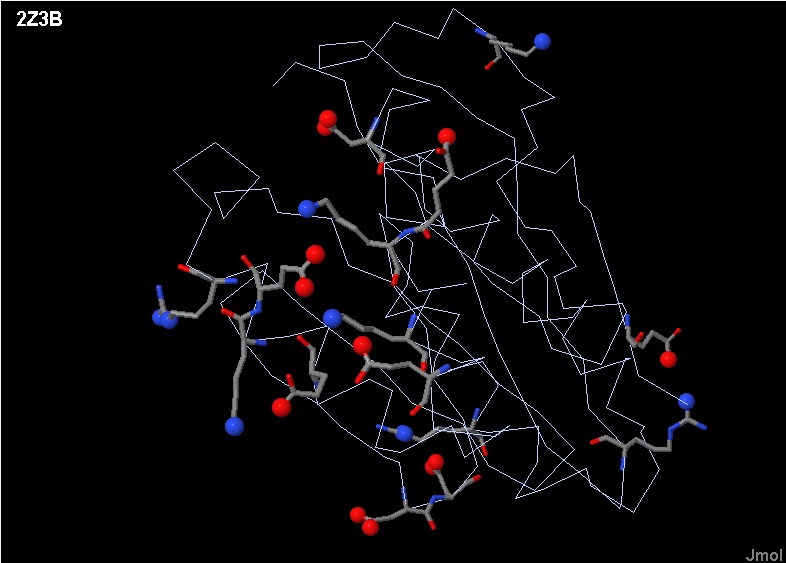 |
| Рис. 12 В цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы показаны все соляные мостики.
Атомы участвующие в образовании соляного мостика обозначены более крупными сферами, положительно заряженый обозначен синим цветом,а отрицательно-красным. Некоторые сферы, судя по рисунку, не имеют пары для солевого мостика, но это только по тому, что их пара находится в другой цепи (см. Рис. 11). |
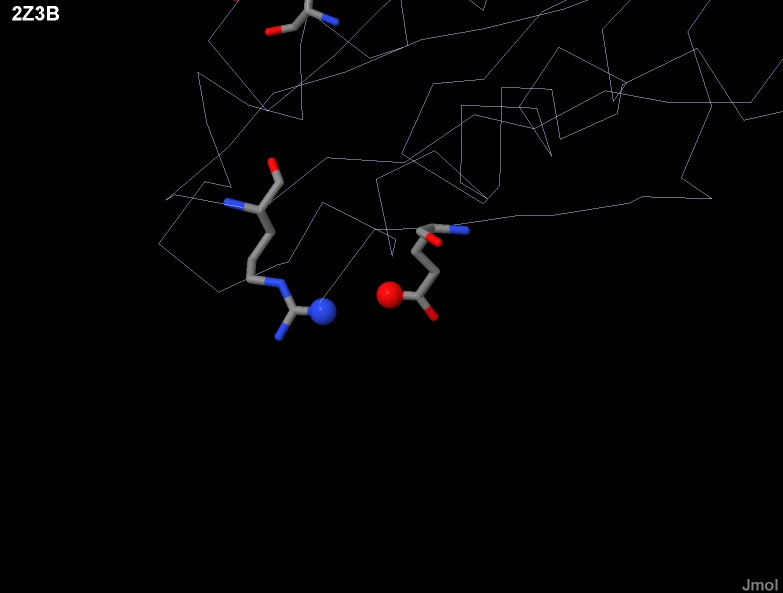 |
| Рис. 13 В цепи A белка ClpQ-субъединицы двухкомпонентной АТФ-зависимой протеазы показан соляной мостик между
остатком №16 цепи А (Arg) и остатком №178 цепи A (Glu). Атомы участвующие в образовании соляного мостика обозначены более крупными сферами, положительно заряженый обозначен синим цветом,а отрицательно-красным. |
