I.Истоия поисковых запросов в PubMed по белку Cytochrome c
| Запрос | Запрос как его понял PubMed из Search details | Всего находок | Всего в открытом доступе | Всего обзоров |
|---|---|---|---|---|
| Cytochrome c | "cytochromes c"[MeSH Terms] OR "cytochromes c"[All Fields] OR "cytochrome c"[All Fields] | 40467 | 13038 | 1952 |
| Cytochrome c NOT oxidase | ("cytochromes c"[MeSH Terms] OR "cytochromes c"[All Fields] OR "cytochrome c"[All Fields]) NOT ("oxidoreductases"[MeSH Terms] OR "oxidoreductases"[All Fields] OR "oxidase"[All Fields]) | 21436 | 7158 | 993 |
| Cytochrome c NOT oxidase "2000/03/12"[PDat] : "2013/03/10"[PDat] | ("cytochromes c"[MeSH Terms] OR "cytochromes c"[All Fields] OR "cytochrome c"[All Fields]) NOT ("oxidoreductases"[MeSH Terms] OR "oxidoreductases"[All Fields] OR "oxidase"[All Fields]) AND "2000/03/12"[PDAT] : "2013/03/10"[PDAT] | 13444 | 4846 | 717 |
| Cytochrome c NOT oxidase "2000/03/12"[PDat] : "2013/03/10"[PDat] AND apoptose | ("cytochromes c"[MeSH Terms] OR "cytochromes c"[All Fields] OR "cytochrome c"[All Fields]) NOT ("oxidoreductases"[MeSH Terms] OR "oxidoreductases"[All Fields] OR "oxidase"[All Fields]) AND "2000/03/12"[PDAT] : "2013/03/10"[PDAT] AND ("apoptosis"[MeSH Terms] OR "apoptosis"[All Fields] OR "apoptose"[All Fields]) | 8786 | 3638 | 525 |
| Cytochrome c NOT oxidase "2000/03/12"[PDat] : "2013/03/10"[PDat] AND apoptose AND (Review[ptyp] AND "loattrfree full text"[sb]) | ("cytochromes c"[MeSH Terms] OR "cytochromes c"[All Fields] OR "cytochrome c"[All Fields]) NOT ("oxidoreductases"[MeSH Terms] OR "oxidoreductases"[All Fields] OR "oxidase"[All Fields]) AND "2000/03/12"[PDAT] : "2013/03/10"[PDAT] AND ("apoptosis"[MeSH Terms] OR "apoptosis"[All Fields] OR "apoptose"[All Fields]) AND (Review[ptyp] AND "loattrfree full text"[sb]) AND (Review[ptyp] AND "loattrfree full text"[sb]) | 105 | 105 | 105 |
II.Персональная коллекция публикаций на тему Cytochrome C в PubMed.
Смысл статьи: Цитохром c выделенный из коровьей печени фосфорилируется по TYR-48 и в связи с этим имеет некоторые особенности (в частности выход реакции с цитохром c оксидазой становится меньше на 50% в сравнении с обычным цитохромом c).
Эксперементальная методика:
- Изолирование цитохрома c из коровьей печени, путем продолжительной химической обработки образца, последующим многократным центрифугированием, повторной химической обработкой с последующей заморозкой.
- Использование методики Вестерн-блоттинга на SDS-полиакриламидном геле.
- Измерение активноси выделенного цитохрома c с цитохром c оксидазой.
- Массспекроскопоия полученых образцов
- Сравнение по базам данных
- Моллекулярное моделирование
Выводы работы: Эксперементальные исследования показали, что выделенный из коровьей печени цитохром с действитлеьно фосфорилируется по TYR-48, что приводит к очень сильному уменьшению активности цитохрома c с цитохром c оксидоазой.
Регуляция выхода цитохрома c и формирование апоптосомы через фосфолирирование цитохрома c.
Выход Cytc из митохондрии и последующее формирование апоптосомы яявляется ключевым шагом, контролирующим судьбу клетки, и предпологается, что это должно иметь тонкие механизмы регуляции,возможно вкрлючающие фосфориляцию Cytc. Недавно было показано, что Cytc из коровьей печени фосфорилируется по Tyr48 in vivo. (Yu et al., 2008). Поразительно, мутантный Cytc имеющий отрицательный заряд и фосфорилированый аминокислотный остаток Glu48 вместо Tyr48 абсолютно невключаем в поток реакций активации каспазы (Pecina et al., 2010), предполажительно это может быть переключателем в регуляции апоптоза.
Критичные белок-белковые взаимодействия, включающие Cytc и Apaf-1 и происходящие в цитозоле, могут быть изменены путем фосфорилирования Cytc. Эта связка захватывает несколько пверхностных остатков Cytc и в результате Adaf-1 оборачивает моллекулу. Мутантный анализ Cytc показал, что существует несколько аминокислот, необходимых для формирования апоптосомы, среди них и Lys7,без которого взаимодействие в связке очень уменьшается.(Yu et al., 2001). Lys7 пространственно расположен рядом с Tyr97, который, как было показано ранее, фосфорилируется в коровьем сердце (Lee et al., 2006). Фосфорилированный Tyr97 может препятствовать образованию связки, путем обазования соляного мостика с Lys7 и, таким образом, предотвращая образование апоптосомы, в результате чего и происходит регулирование процесса апоптоза в тканях сердецной мышцы, где и происходит фосфорилирование. В будущем планируется проверка данной гипотезы.
Катализируемое Cytc окисление кардиолипина предшествует выходу Cytc из митохондрии.
Обычно, около 15-20% Cytc связано в кардиолипине, митохондриально-специфичной внутренней липидной мембраной (Schlame et al., 2000, Kagan et at., 2004) Эта фракция из гидрофобно связаныых с мембраной Cytc не может быть удалена с применением каких-либо решений, задействующих высокую ионную силу (Belikova et al., 2006), и, вероятно, не принимает участися в транспорте электронов в связи с очень отрицательным окислительно-восстановительным потенциалом. Во время апоптоза, гранс-мембранная меграция кардиолипина облегчается его взаимодействием с Cytc в межмембранном пространстве и образованием Cytc/кардиолипинн комплекса. (Kagan et al, 2005).
Cytc связавается с кардиолипином через два сайта: A-сайт и C-сайт (Rytomaa and Kinnunen, 1994) (рис.1). Эти два сайта различаются тем, что взаимодействие А-сайта преимущественно электростатической природы, и принимает участвие в транспорте электронов, как одной из функций Cytc. В противовес, в C-сайте используются гидрофобные взаимодействия и водородные связи для жесткой конформации, связанной с окислением кардиолипина, т.е. Cytc-катализируемой реакции которая происходит во время процесса апоптоза. Именно по этому и необходимо окисление рардиолипида для выхода Cytc из митохондрии.(Kagan et al., 2009).
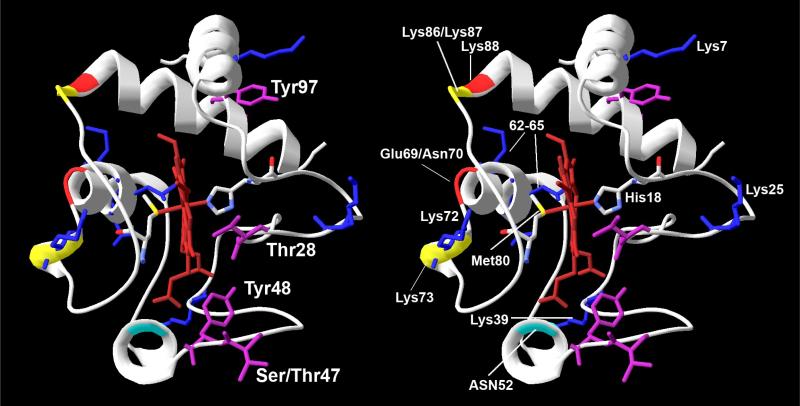
Рис.1
Связывание кардиолипина с А-сайтом Cytc обратимо и легко смещается АТФ или путем увеличения ионной силы (ионной силы раствора прим.перев.)(Rytomaa and Kinnunen, 1994; Rytomaa et al., 1992). Связывание С-сайта гораздо более стабильно. Изменение спектра, наблюдаемое при связывании с С-сайтом, предполагает возникновение коформационных изменений в белке, которые влияют на область вкруг гема в Cytc (Tuominen et al., 2002), в то время как связывание А-сайта не приводит к каким-либо видимым изменениям в спектре.
С-сайт формируется с помощю гидрофобной полости проходящей от поверхности Cytc до встроенной в него гем-группы(Dickerson et al., 1971). Взаимодействие кардиолипина с С-сайтом приводит к сильно фиксированной конфигурации, в которой одна ацильная цепь кардиолипина вставляется в гидрофобную полость,однако при этом остальные цепи сохраняются во внутренней мембране митохондрий (Tuominen et al., 2002). Это в конечном счете приводит к частичному разворачиванию белка и конформационным изменениям в Met80-геме, приводящие к именению спектрального состояния железа в геме (Tuominen et al., 2002). Эти изменеиния могут позволить Н2О2 получить доступ к области около гема цитохрома с (Choi and Swanson, 1995; Tuominen et al., 2002) что может вызвать пероксид-зависимую инициацию цитохром-с катализируемой реакции пероксидного окисления кардиолипина. (Kagan et al., 2005).
Перед выходом Cytc из митохондрии во время процесса апоптоза происходит перераспределение кардиолипина (Garcia Fernandez et al., 2002). Большая часть кардиолипина, почти 80%, локализована во внутренней мембране митохондрий и составляет около 20% всех находящихся там мембранных липидов. В клетках подверженных процессу апоптоза происходит перераспределение в мембране, в результате чего почти 40% кардиолипина из внутренней мембраны митохондрий перемещается в наружную мембрану. (Kagan et al., 2006). В ней он участвует в формировании Cytc/cardiolipin комплекса с участием пероксидазы и, после того, как кардиолипин окислится, формируется пора в митохондрии, способствующая выходу Cytc и других факторов, направленных на апоптоз, прямо в цитозоль.
Окислительная активность, происходящая во время апоптоза, является специфичной для кардиолипина и целиком зависит от Cytc (Kagan et al., 2005). Степень окисления кардиолипида и чувствительность к апоптоз-инициирующему агенту,актиномицину D, прямо пропорцианальна примерному к-ву Cytc (Kagan et al., 2005). После того, как кардиолипин окислен, сходство между кардиолипином и Cytc резко уменьшается. (Kagan et al., 2005; Nakagawa, 2004) Уменьшение сходства между Cytc окисленным кардиолипином также обеспечивает большое к-во свободного Cytc в межмембранном пространстве. Свободный Cytc необходим для высвобождения в цитозоль для последующей активации каспазы.
Окислительная активность Cytc зависит от физического взаимодействия между Cytc и кардиолипином. Когда кардиолипин связан с Cytc в присудствии H2O2, гем группа Cytc реагирует с образованием высокореакционно способных соединения I и II (см. уравнения 2 и 3 ниже). Соединение I быстроразрущающийся фериллпорфиринный радикал образованным при взаимодействии H2O2 с железом в центре гема (Barr et al., 1996). Железо в геме окисляется с восстановлением H2O2 до воды, аж до Fe(V), а соединение II формируется при помощи изъятия электрона из остатка тирозина, в результате происходит восстановление Fe(V) до Fe(IV) и формирование тирозил-радикала (Dunford, 1987; Tyurina et al., 2006). В присутствии неокисляемого кардиолипина этот тирозильный радикал может димерилизоваться с другим радикалом (см. уравнеие 4).
Описаннные выше реакции Cytc-катализируемого окисления кардиолипина (CL) (Tyurina et al., 2006):
CL + Cytc-[Fe3+ + Tyr] → CL/Cytc-[Fe3+ + Tyr]
CL/Cytc-[Fe3+ + Tyr] + H2O2 → CL/Cytc-[Fe5+=O + Tyr] (соединение I) + H2O
CL/Cytc-[Fe5+=O + Tyr] → CL/Cytc-[Fe4+=O + Tyr•] (соединение II)
2x Compound II → Cytc-Tyr–Tyr-Cytc (Cytc димеры и олигомеры)
CL/Cytc-[Fe4+=O + Tyr•]→ CL•/Cytc-[Fe4+=O + Tyr]
CL•/Cytc-[Fe4+=O + Tyr] + O2 →→ CL-OO• + Cytc-[Fe4+=O + Tyr]
