Выбор белка для работы
Для дальнейшей работы была выбрана структура белка CLPQ_BACSU (PDB: 2Z3B). Основыне особенности структуры в свете данной работы представленны в Таблице 1.
| PDB id |  2Z3B 2Z3B |
| Разрешение структуры | 2.50 Å |
| Длинна цепи белка, аа | 180 |
| Известность сервиу EDS (Electron Density Server) | Да. Возможно получение  данных структурных факторов. данных структурных факторов. |
| Наличие подходящих структурных гомологов белка по данным сервиса PDBeFold | Да. |
Изображение ЭП вокруг полипептидной цепи
При помощи  скрипта получены изображения электронной плотности вокруг всей структуры 2Z3B и отдельно для цепи A при уровне подрезки: 0.5σ, 1σ, 1.5σ, 2σ, 2.5σ и 3σ.
скрипта получены изображения электронной плотности вокруг всей структуры 2Z3B и отдельно для цепи A при уровне подрезки: 0.5σ, 1σ, 1.5σ, 2σ, 2.5σ и 3σ.
Полученные изображения представлены на Рисунках 1-6.
 |
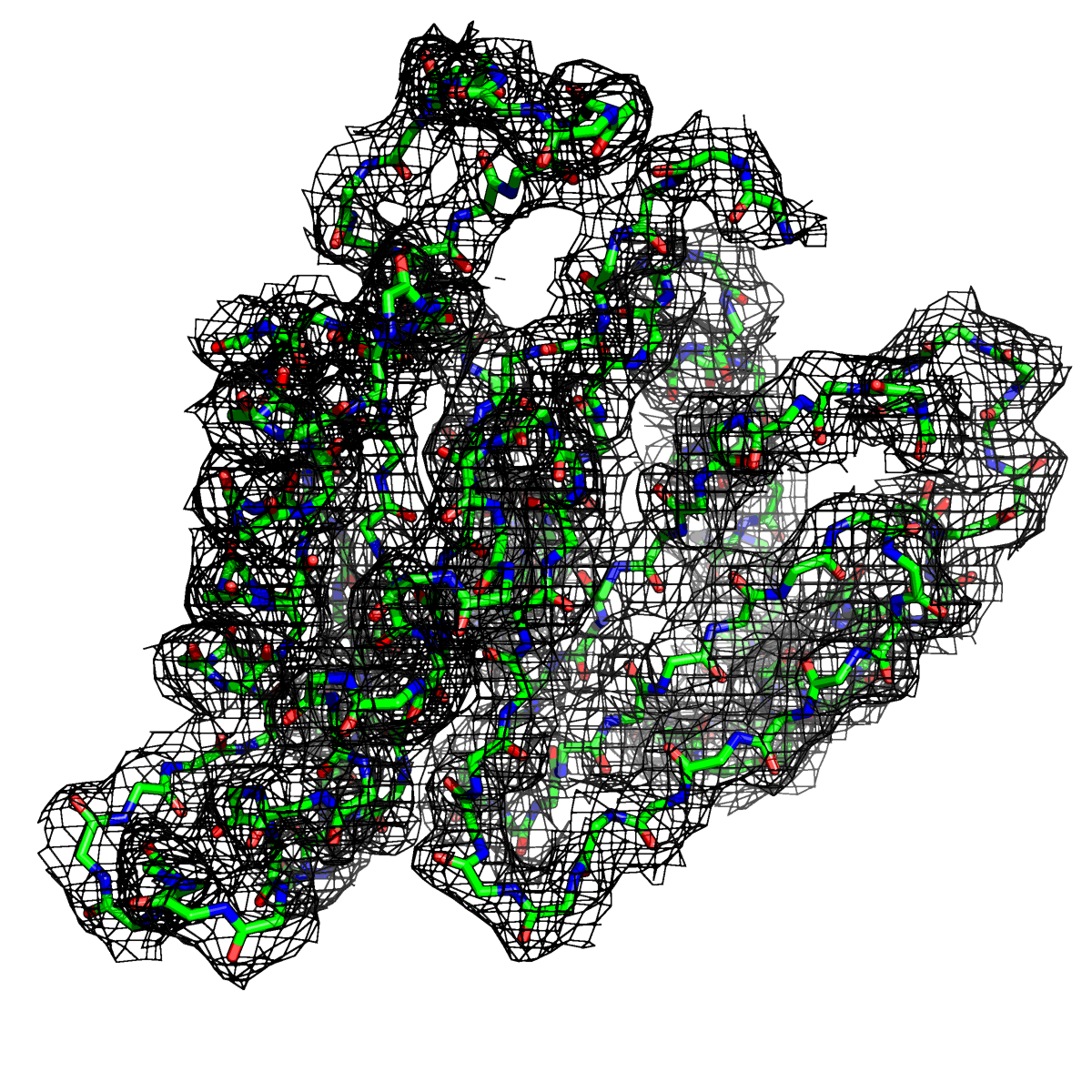 |
Рисунок 1. Структура 2z3b. Визуализирована только полипептидная цепь и электронная плотность с уровенем подрезки 0.5σ.
Слева показана вся структура. Справа только цепь А.
 |
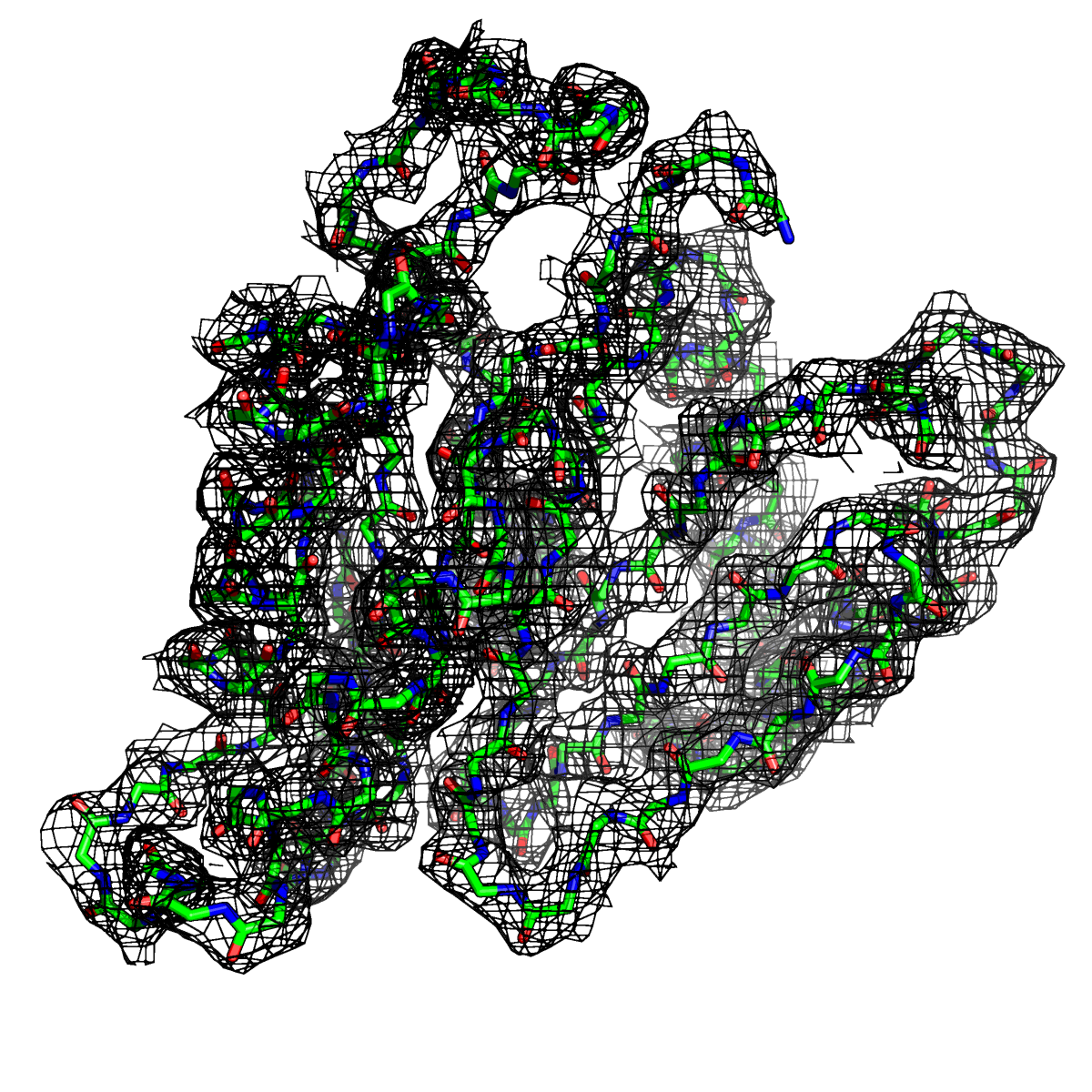 |
Рисунок 2. Структура 2z3b. Визуализирована только полипептидная цепь и электронная плотность с уровенем подрезки 1σ.
Слева показана вся структура. Справа только цепь А.
 |
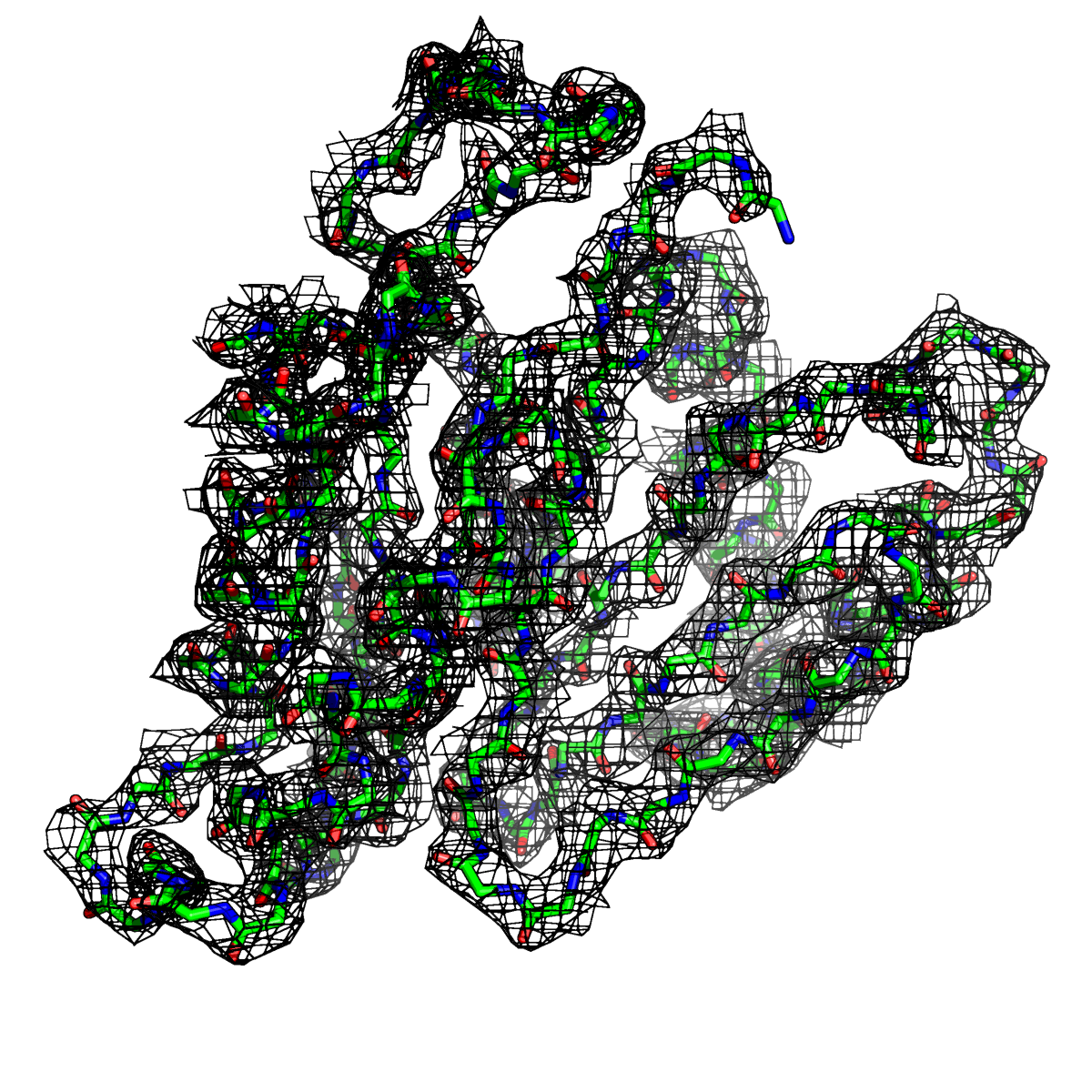 |
Рисунок 3. Структура 2z3b. Визуализирована только полипептидная цепь и электронная плотность с уровенем подрезки 1.5σ.
Слева показана вся структура. Справа только цепь А.
 |
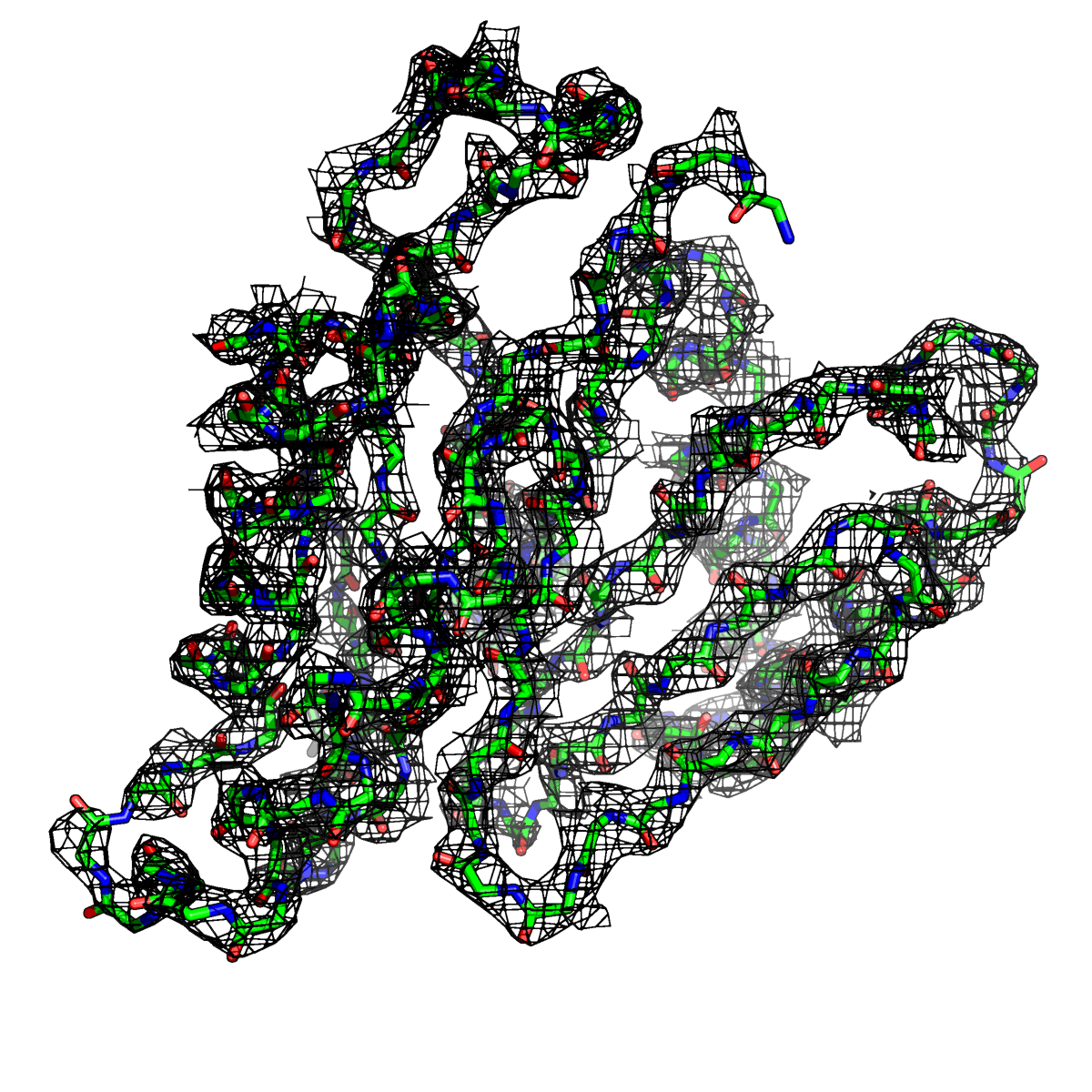 |
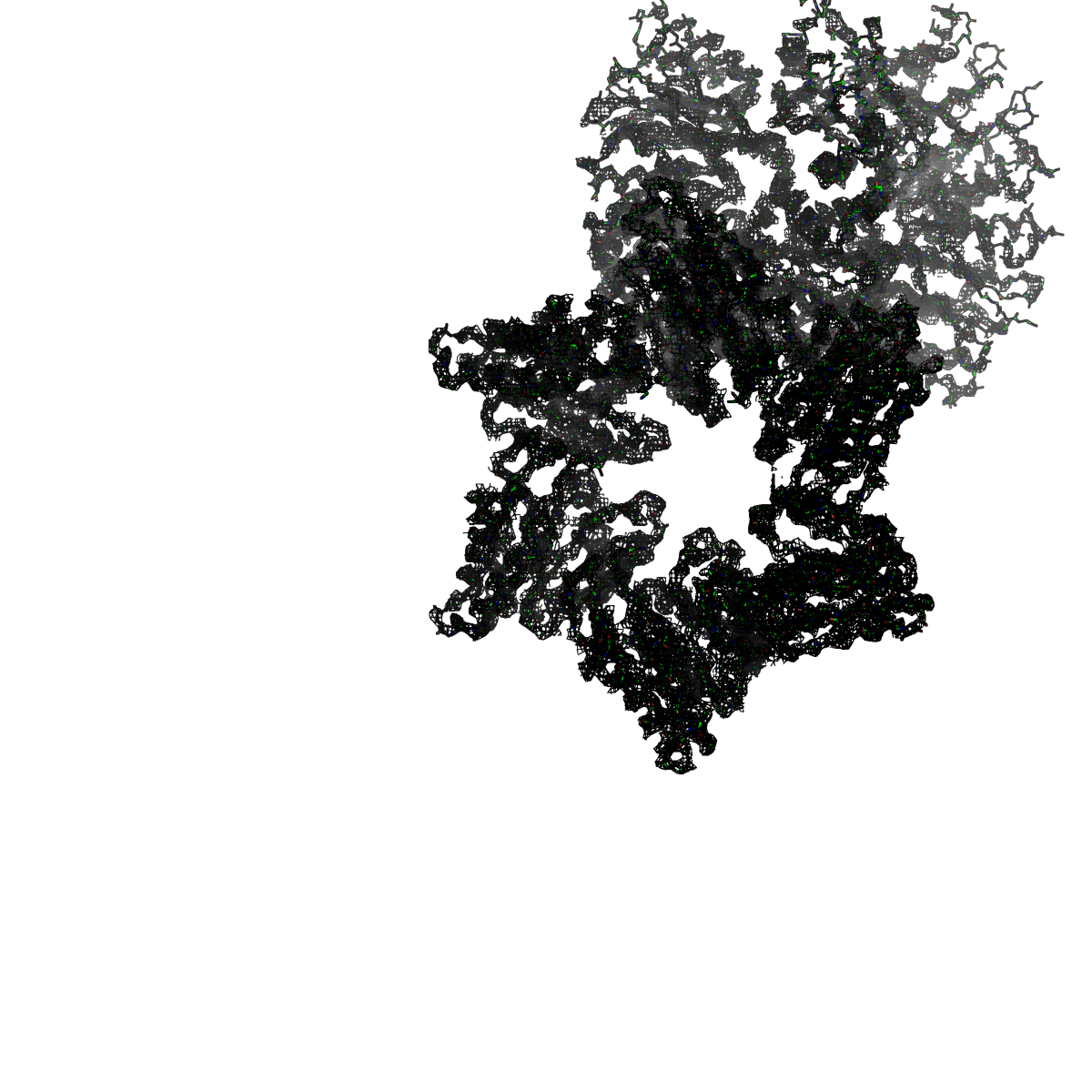
Рисунок 4. Структура 2z3b. Визуализирована только полипептидная цепь и электронная плотность с уровенем подрезки 2σ.
Слева показана вся структура. Справа только цепь А.
 |
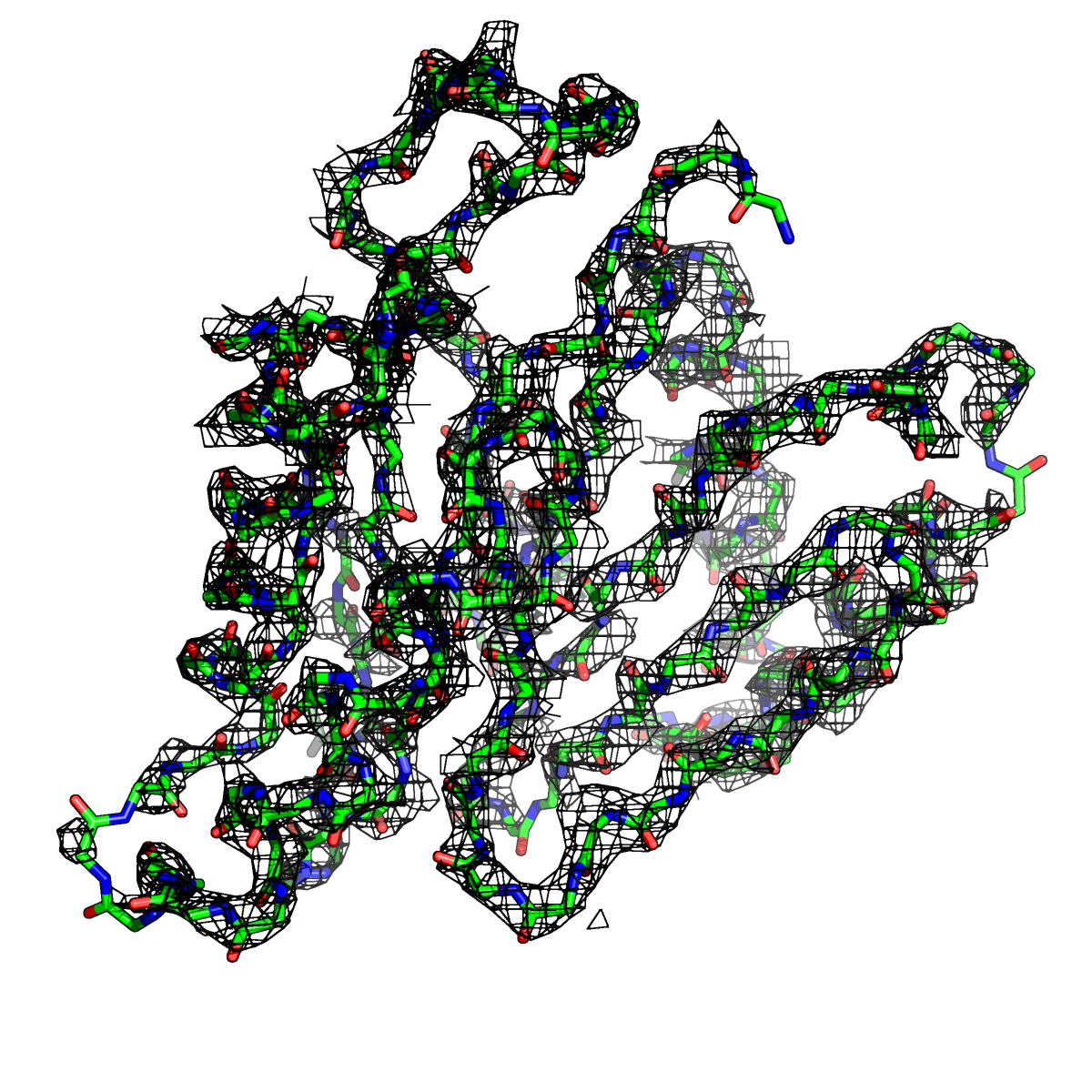 |
Рисунок 5. Структура 2z3b. Визуализирована только полипептидная цепь и электронная плотность с уровенем подрезки 2.5σ.
Слева показана вся структура. Справа только цепь А.
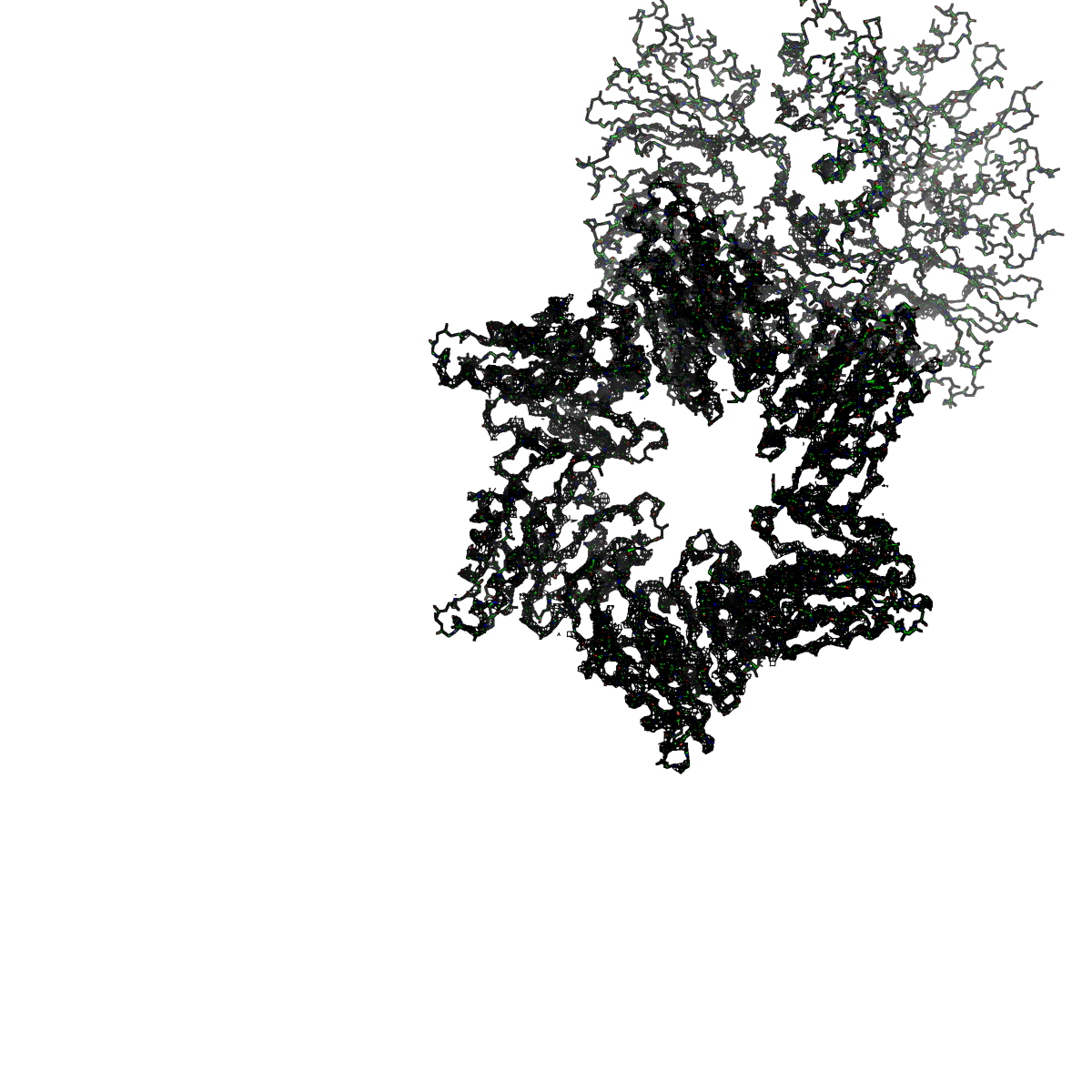 |
 |
Рисунок 6. Структура 2z3b. Визуализирована только полипептидная цепь и электронная плотность с уровенем подрезки 3σ.
Слева показана вся структура. Справа только цепь А.
Из рисунков 1 - 6 следует,что при увеличении уровня подрезки покрытие атомов полипептидной цепи электронной плотностью уменьшается, т.е. при большем уровне подрезки остаются видны только участки с большей электронной плотностью.
Но не смотря на это, большая часть структуры хорошо покрывается картой электронной плотности, однако общее качество модели структуры (при учете разрешения 2.5 Å) довольно посредственное.
Изображение ЭП вокруг отдельных аминокислот
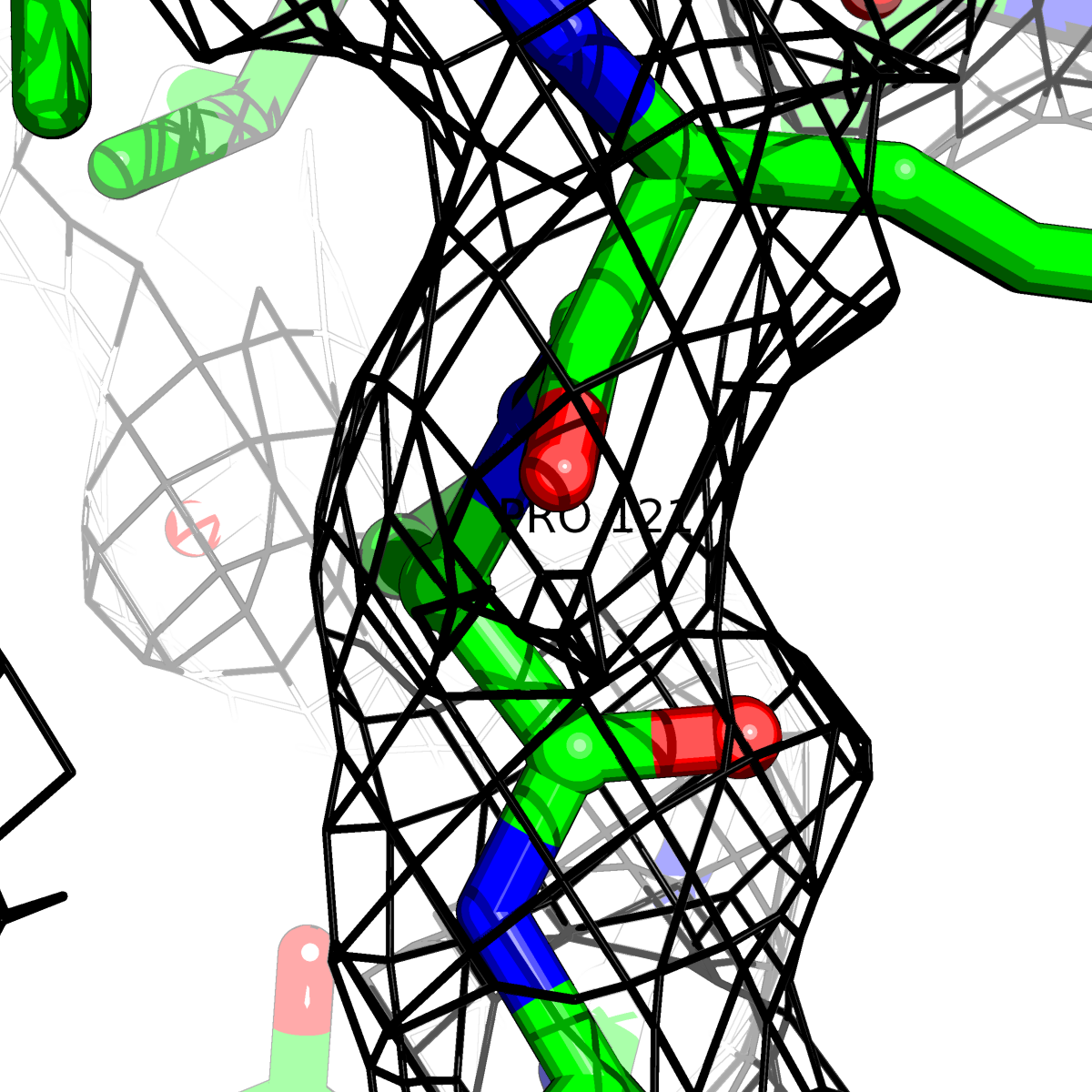
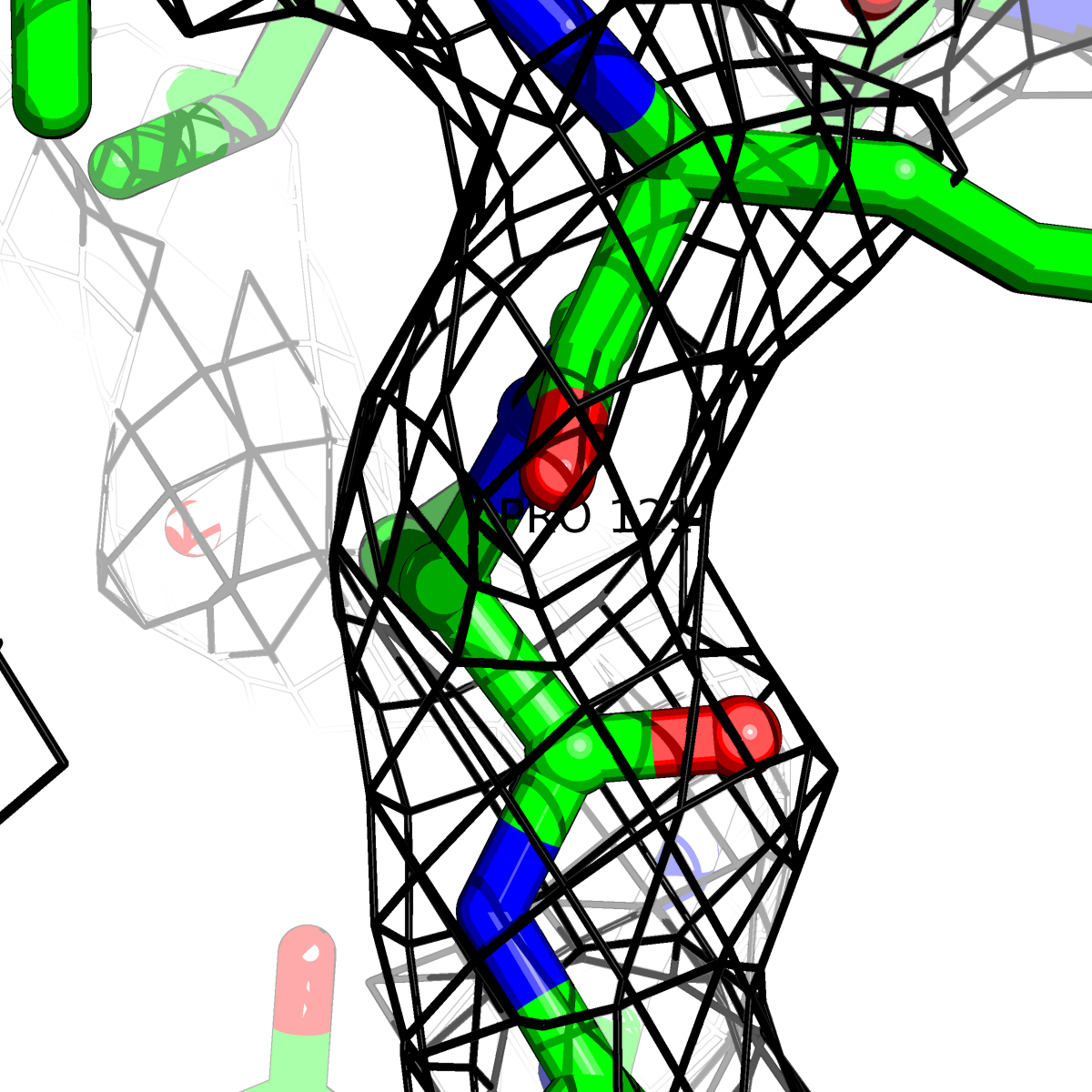
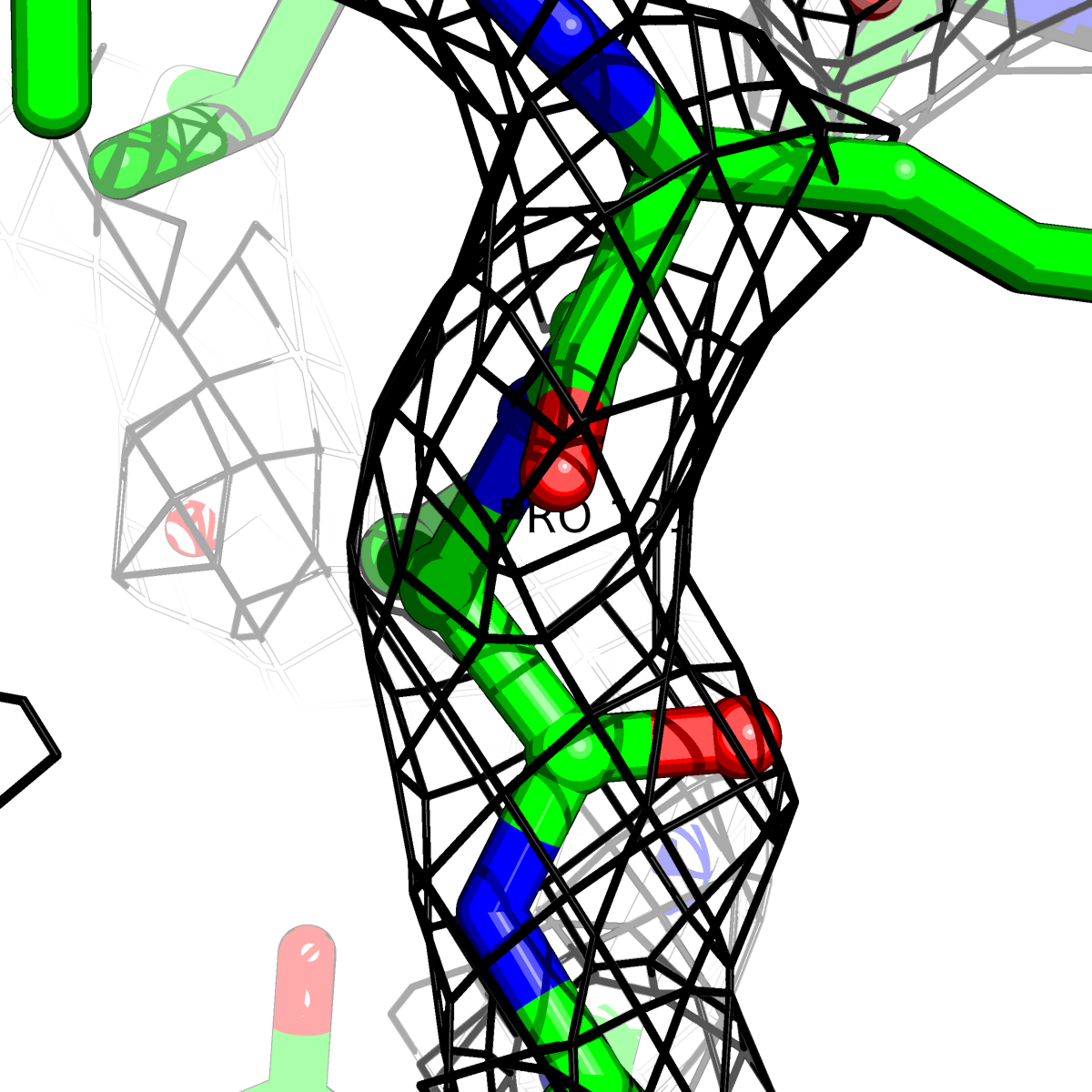
При помощи скрипта получены изображения электронной плотности вокруг отдельных аминокислот разных типов () при уровне подрезки: 0.5σ, 1σ, 1.5σ, 2σ, 2.5σ и 3σ.
Данные представлены в Таблице 2.
скрипта получены изображения электронной плотности вокруг отдельных аминокислот разных типов () при уровне подрезки: 0.5σ, 1σ, 1.5σ, 2σ, 2.5σ и 3σ.
Данные представлены в Таблице 2.
| остаток | уровень подрезки 0.5σ | уровень подрезки 1σ | уровень подрезки 1.5σ | уровень подрезки 2σ | уровень подрезки 2.5σ | уровень подрезки 3σ |
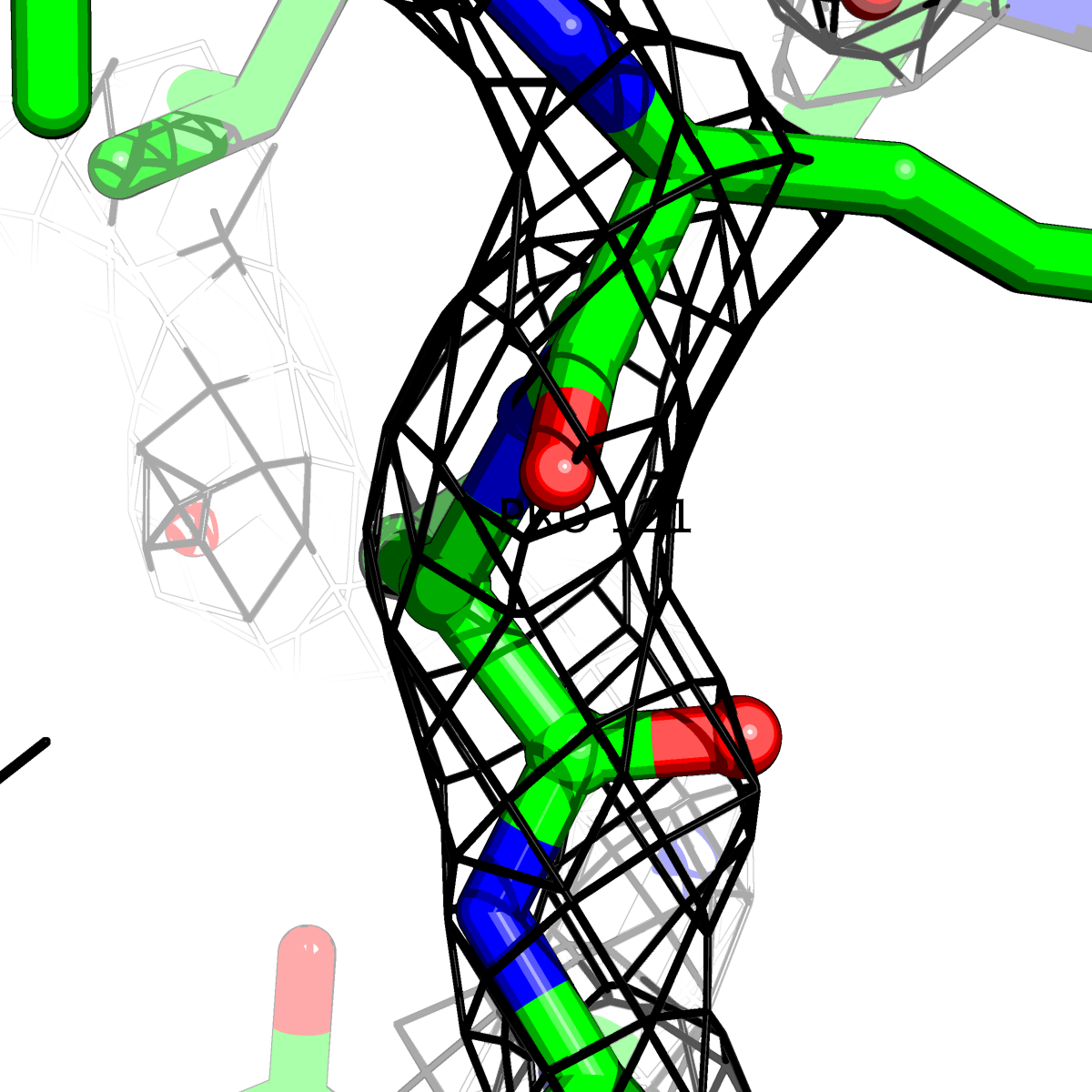
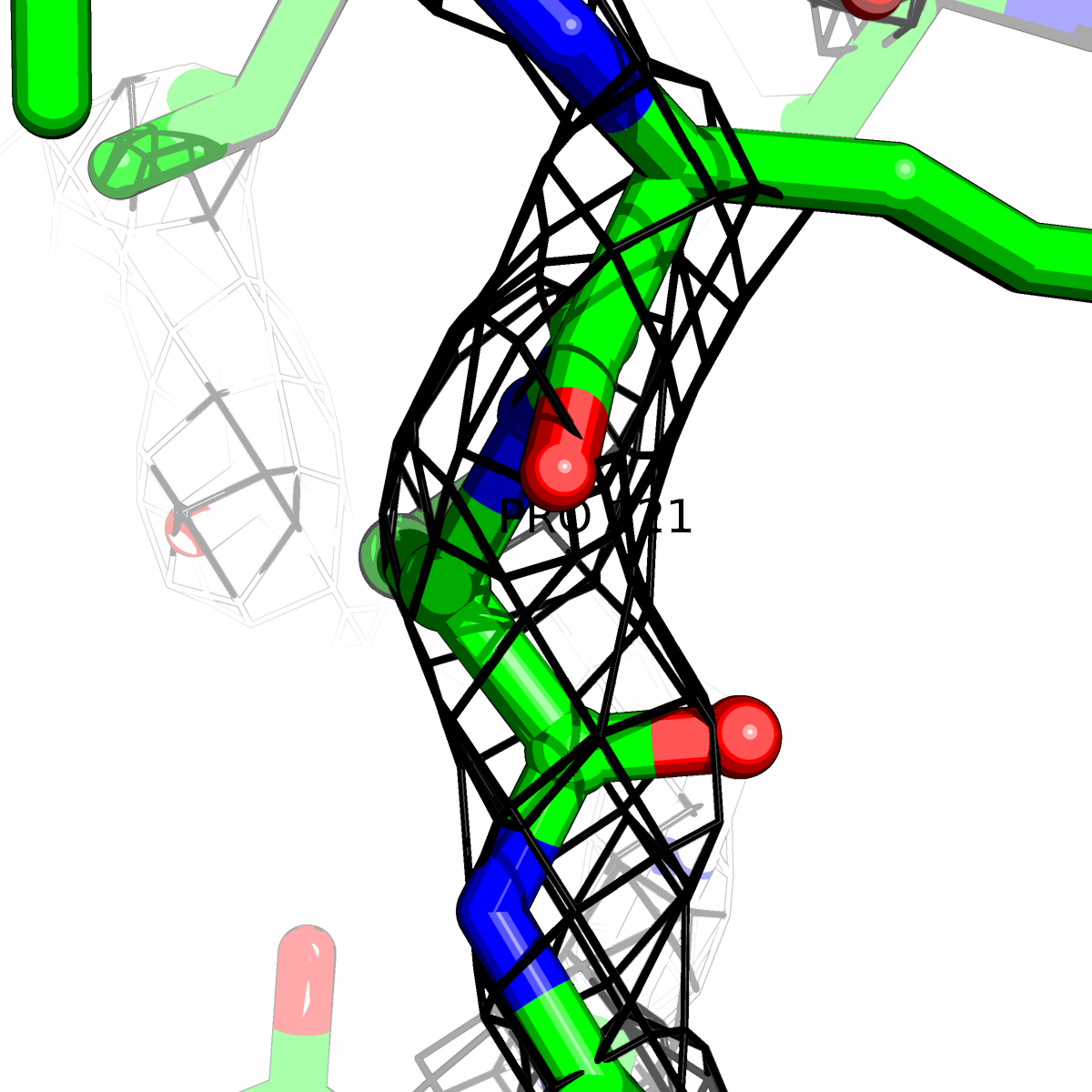
| Цепь А: поролин -121 | 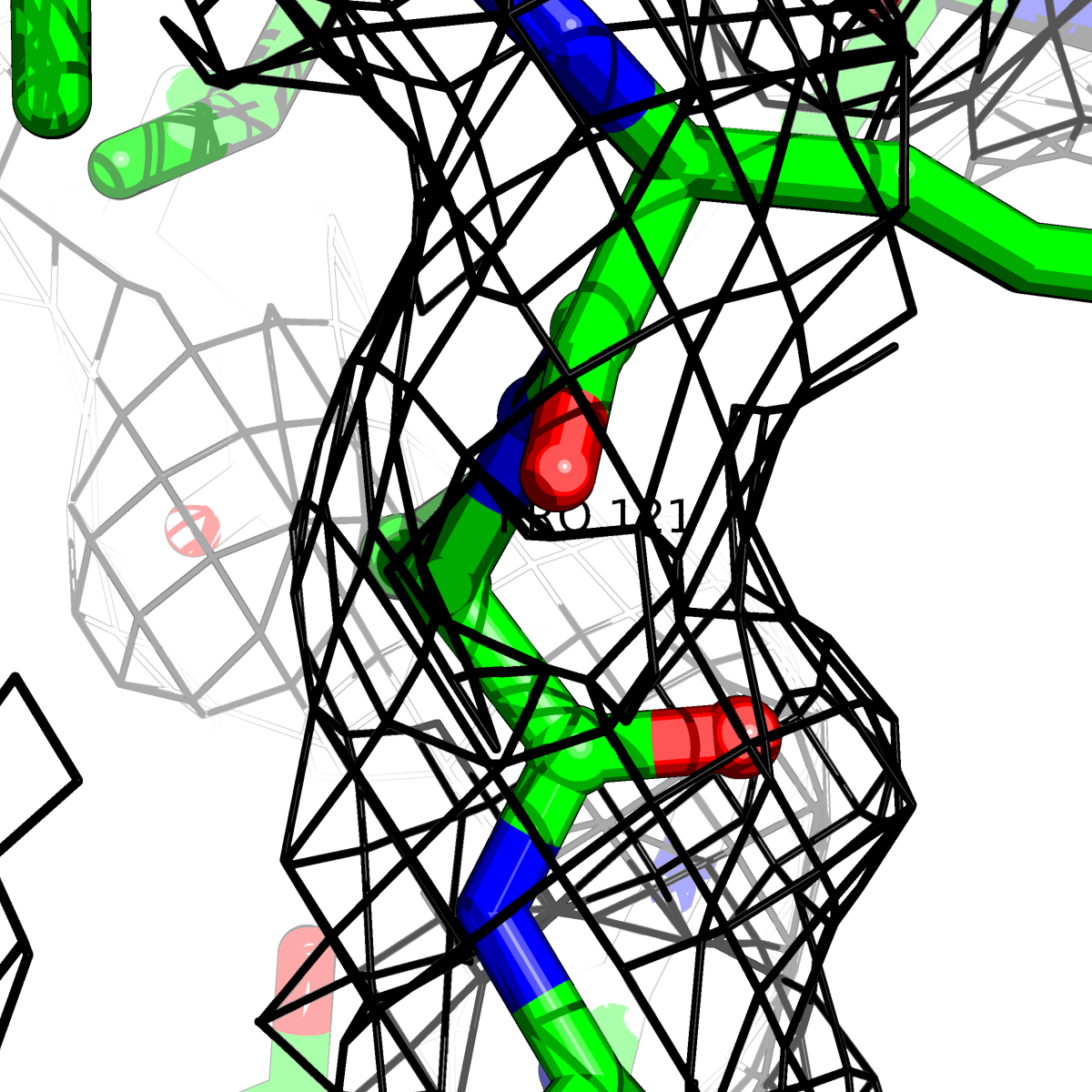 |
 |
 |
 |
 |
 |
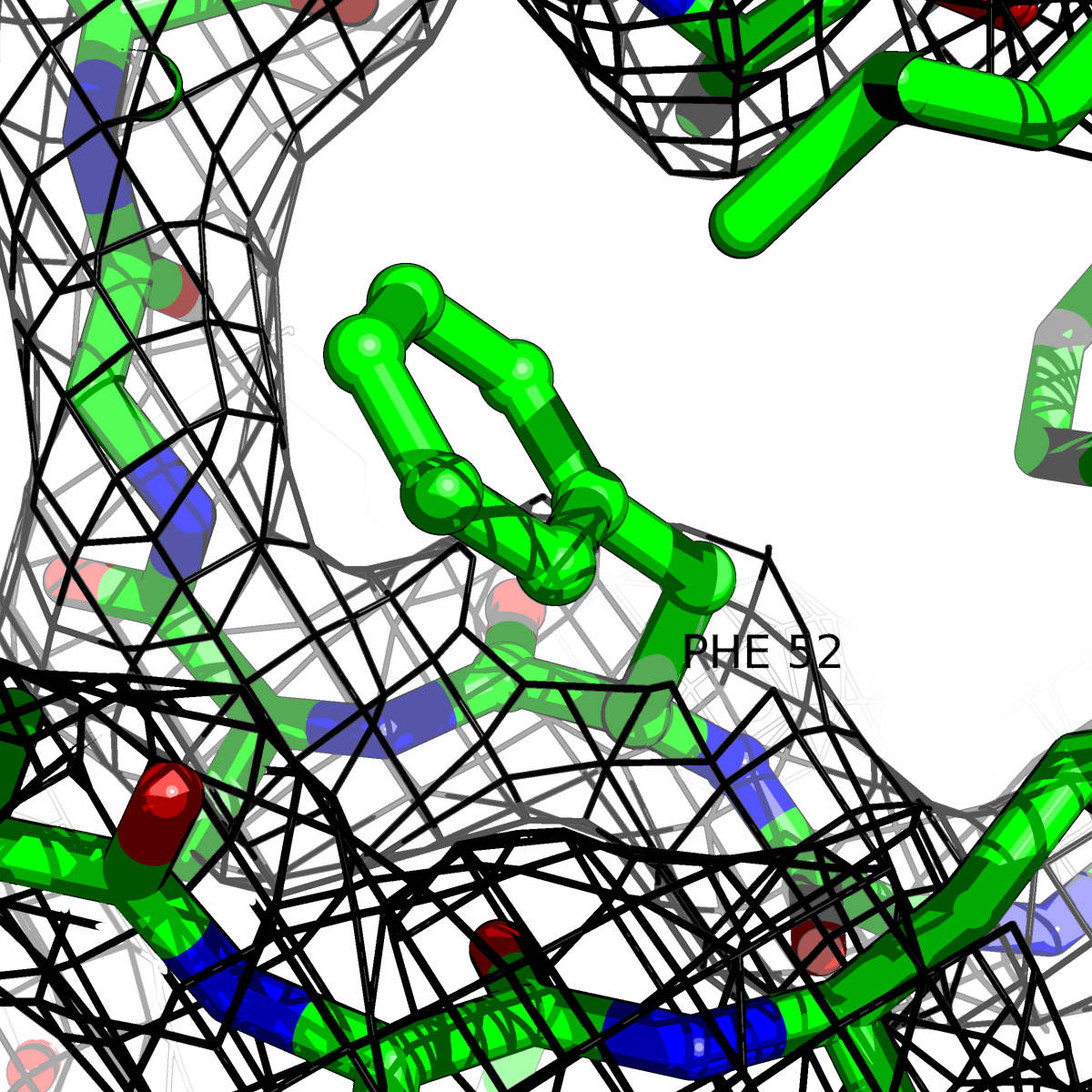
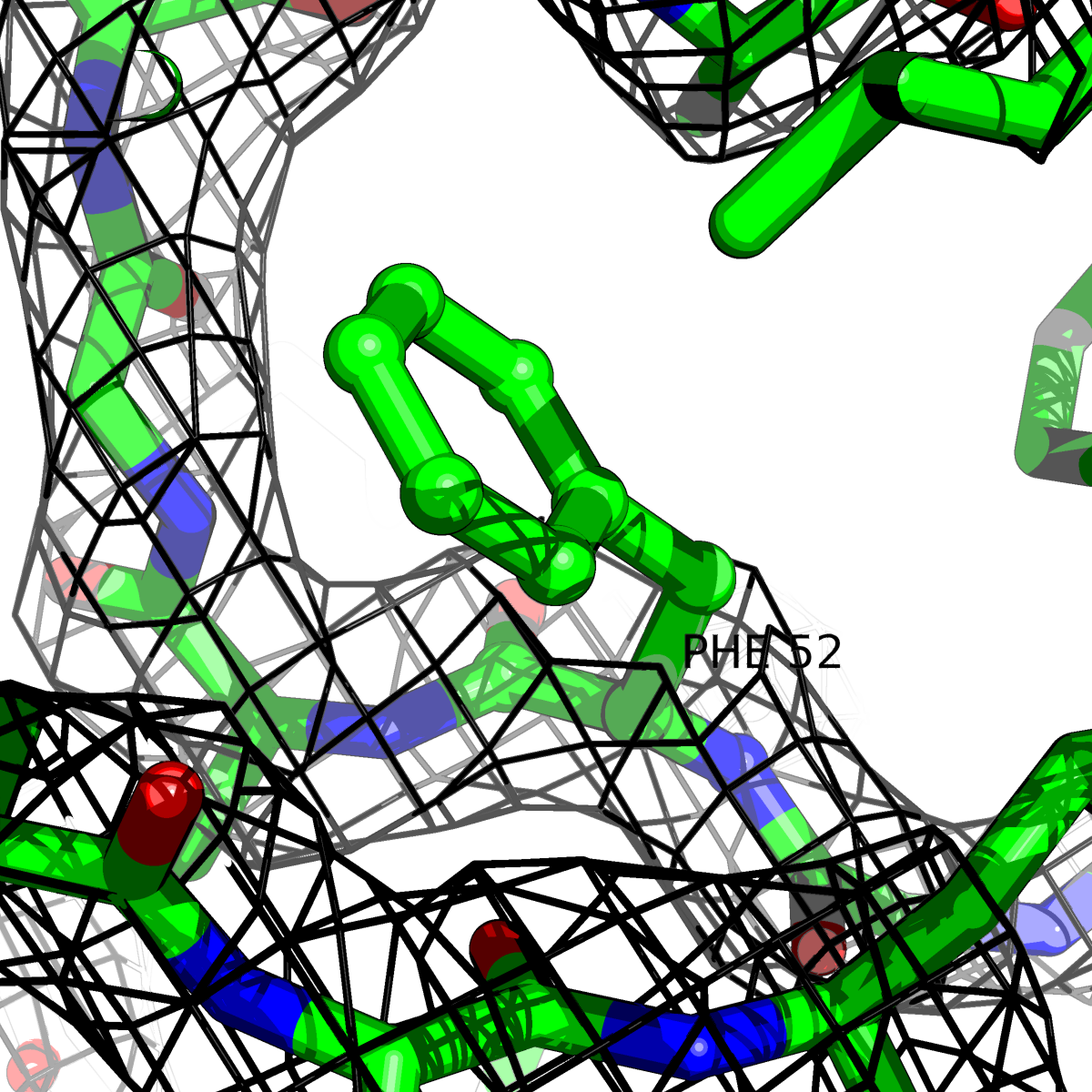
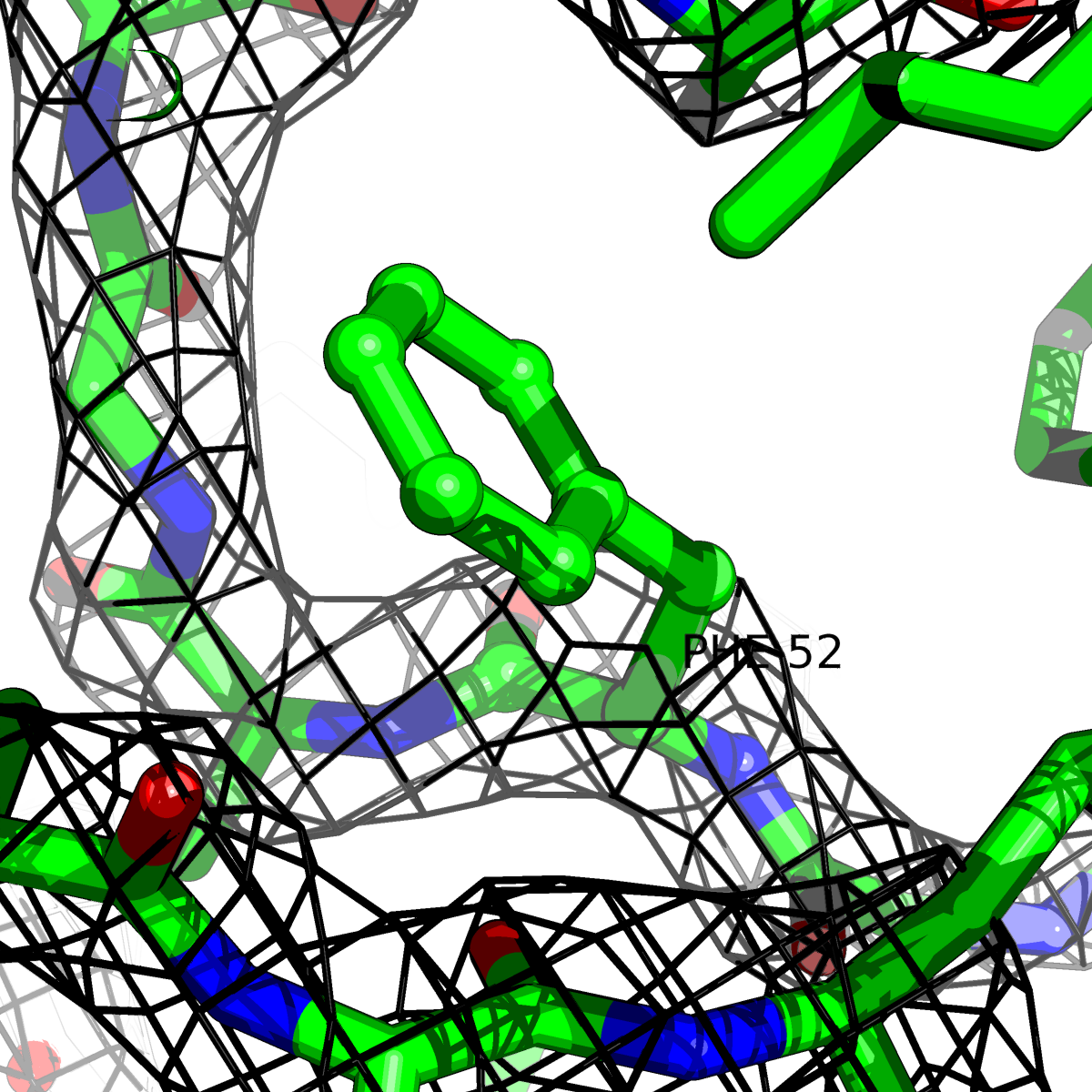
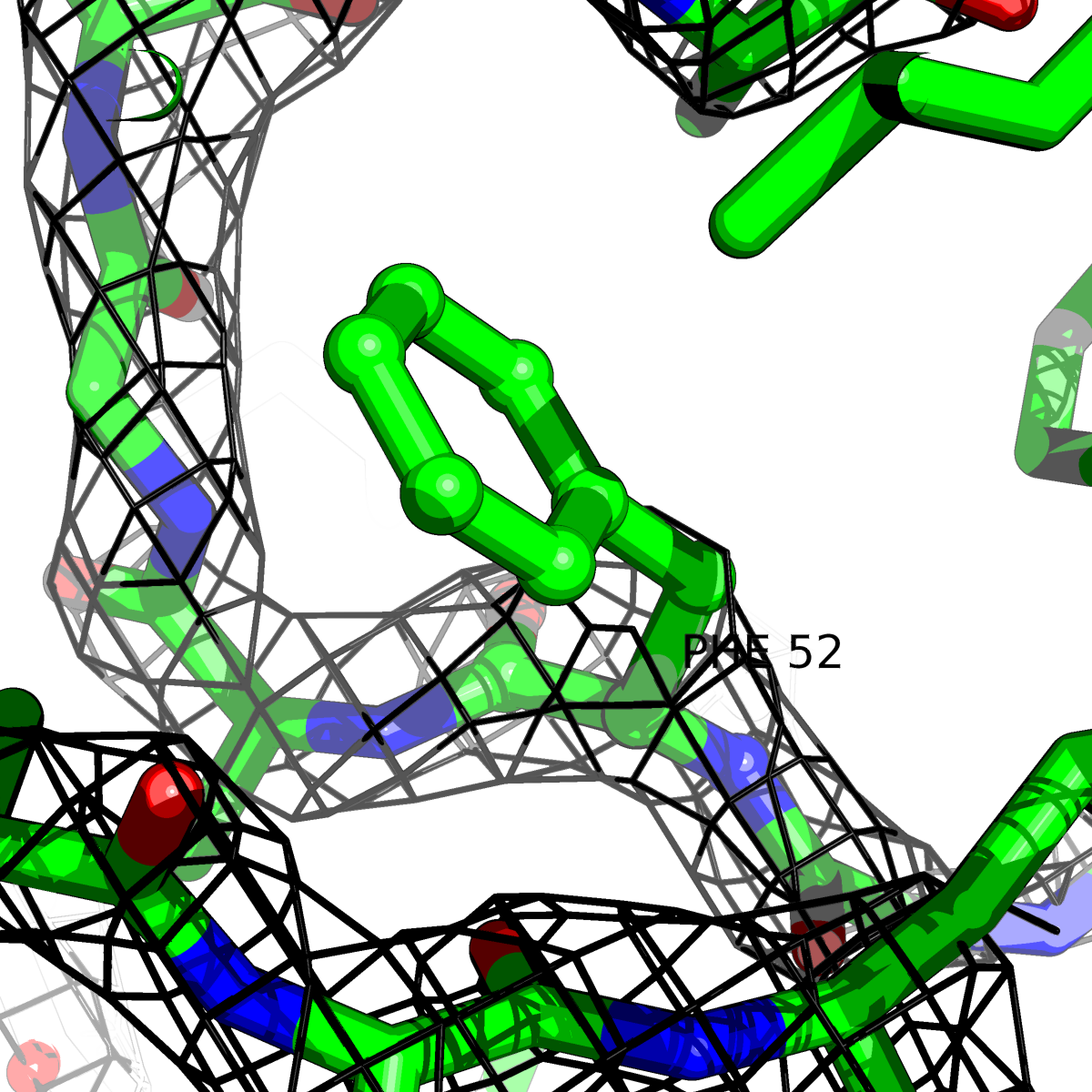
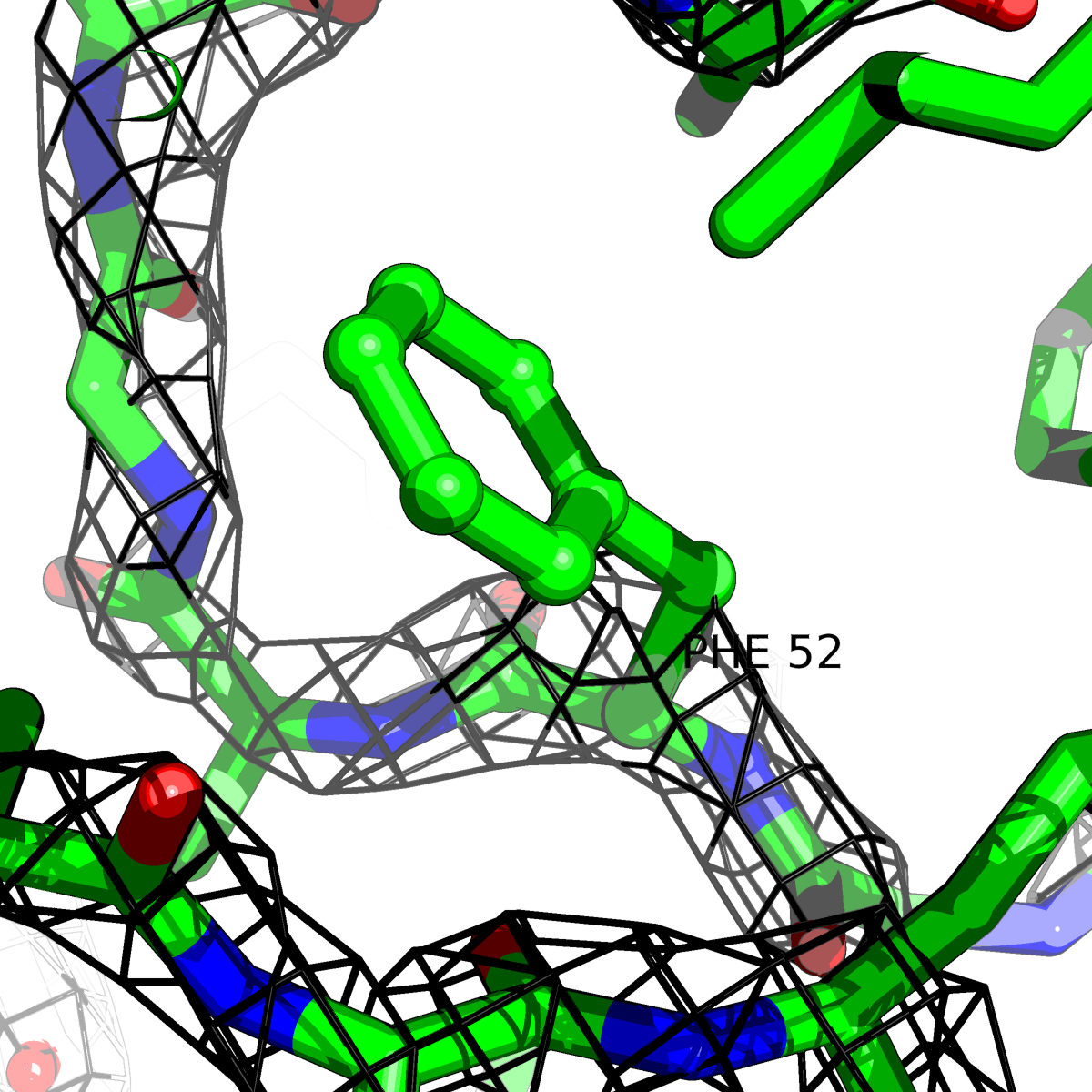
| Цепь А: фенилаланин - 52 | 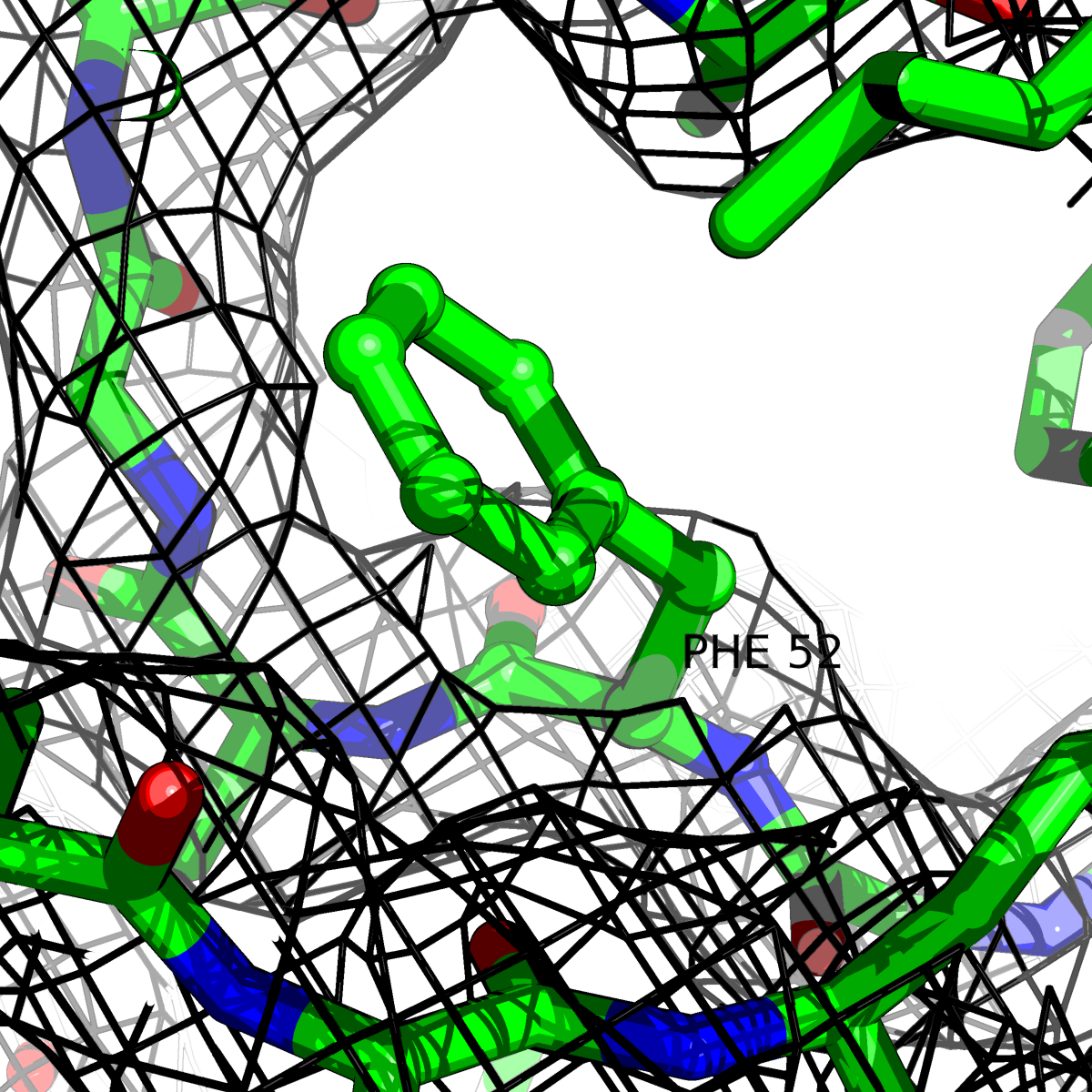 |
 |
 |
 |
 |
 |
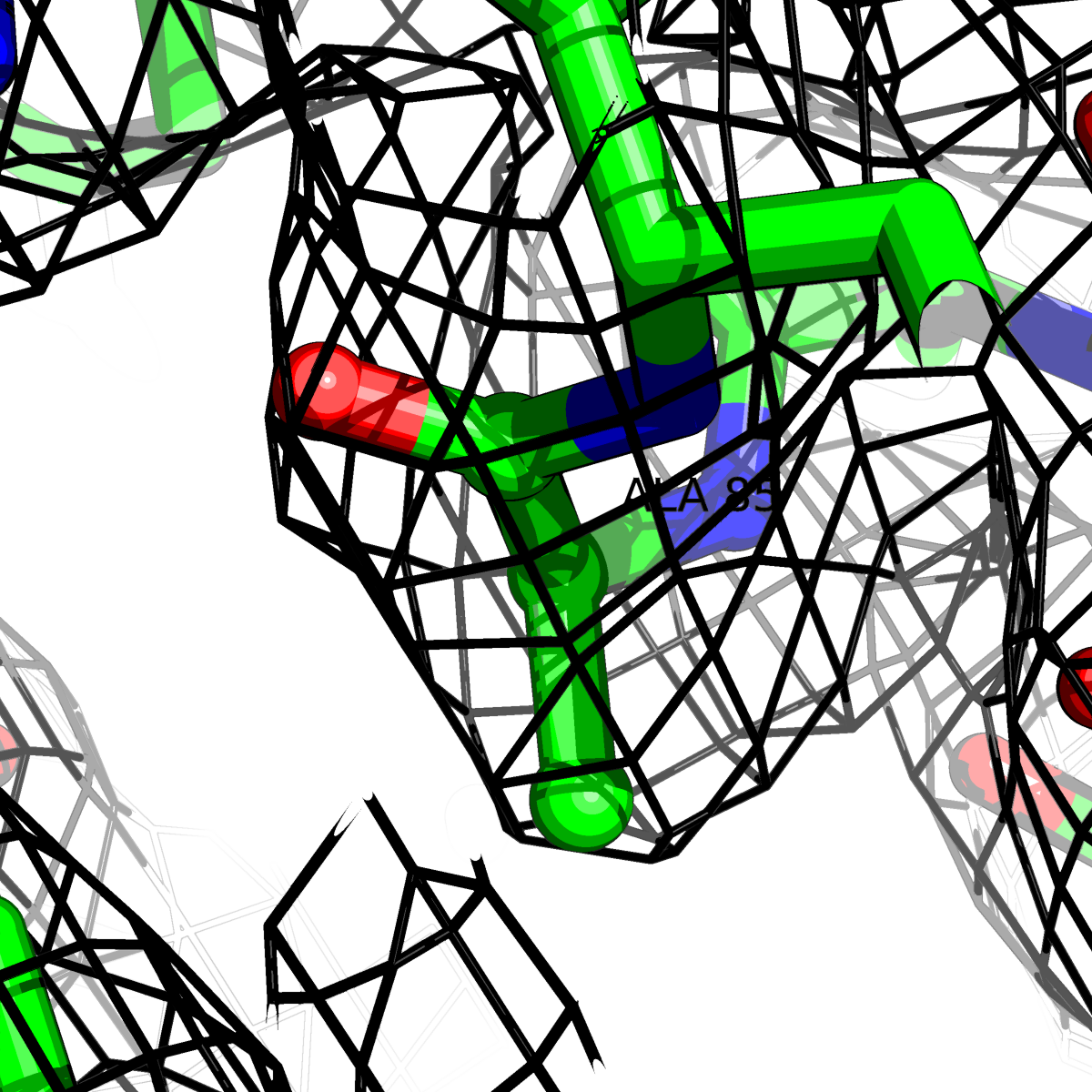
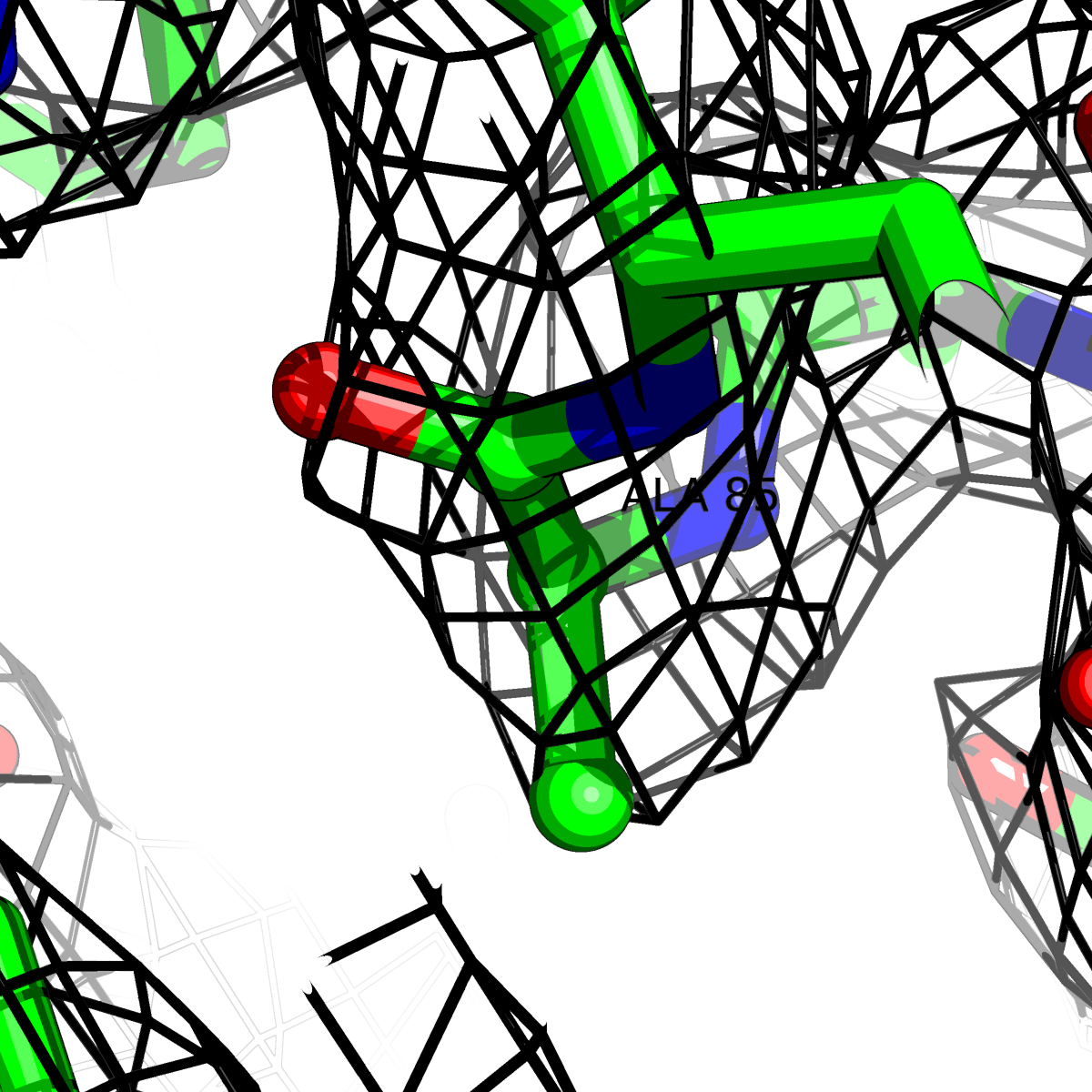
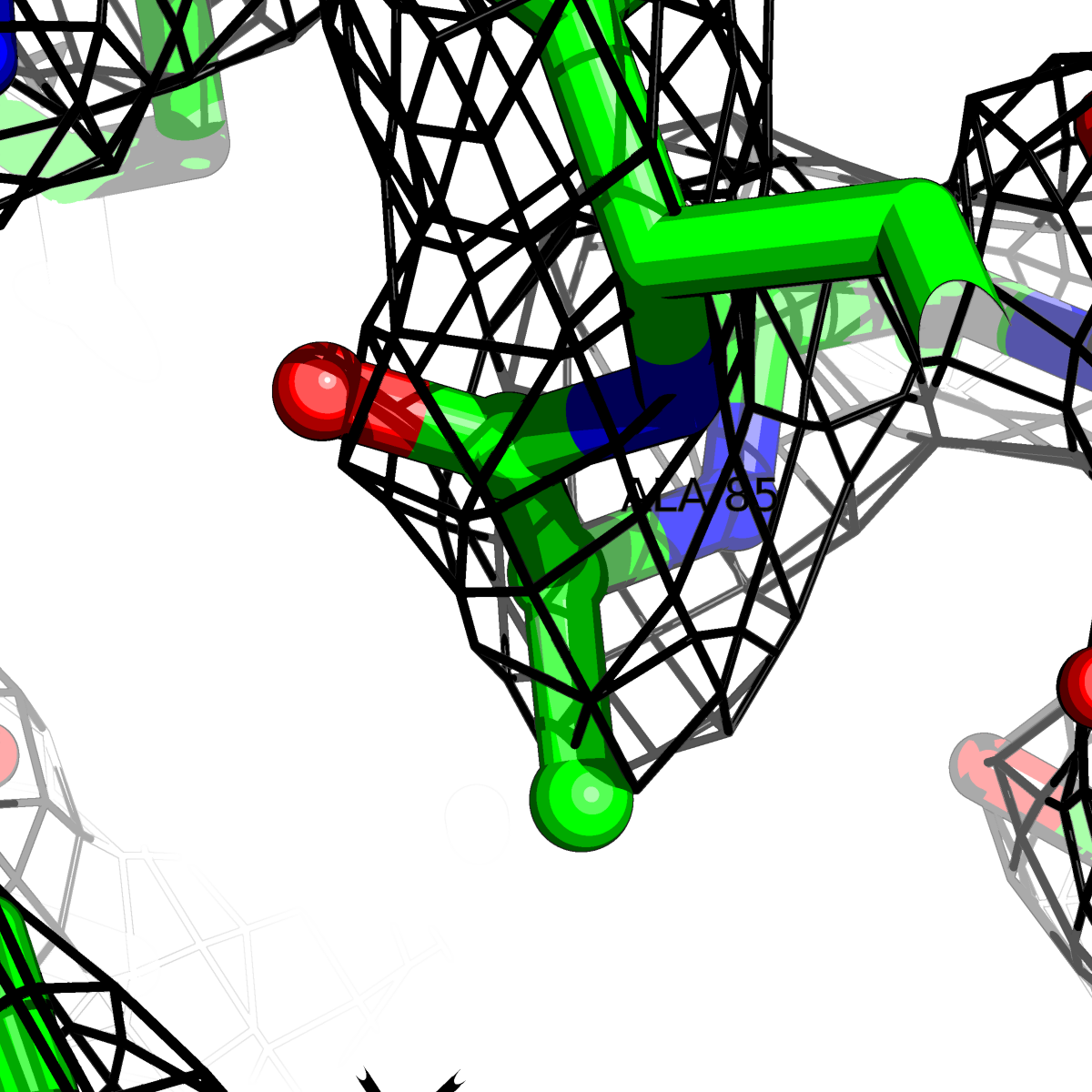
| Цепь А: гистидин -85 | 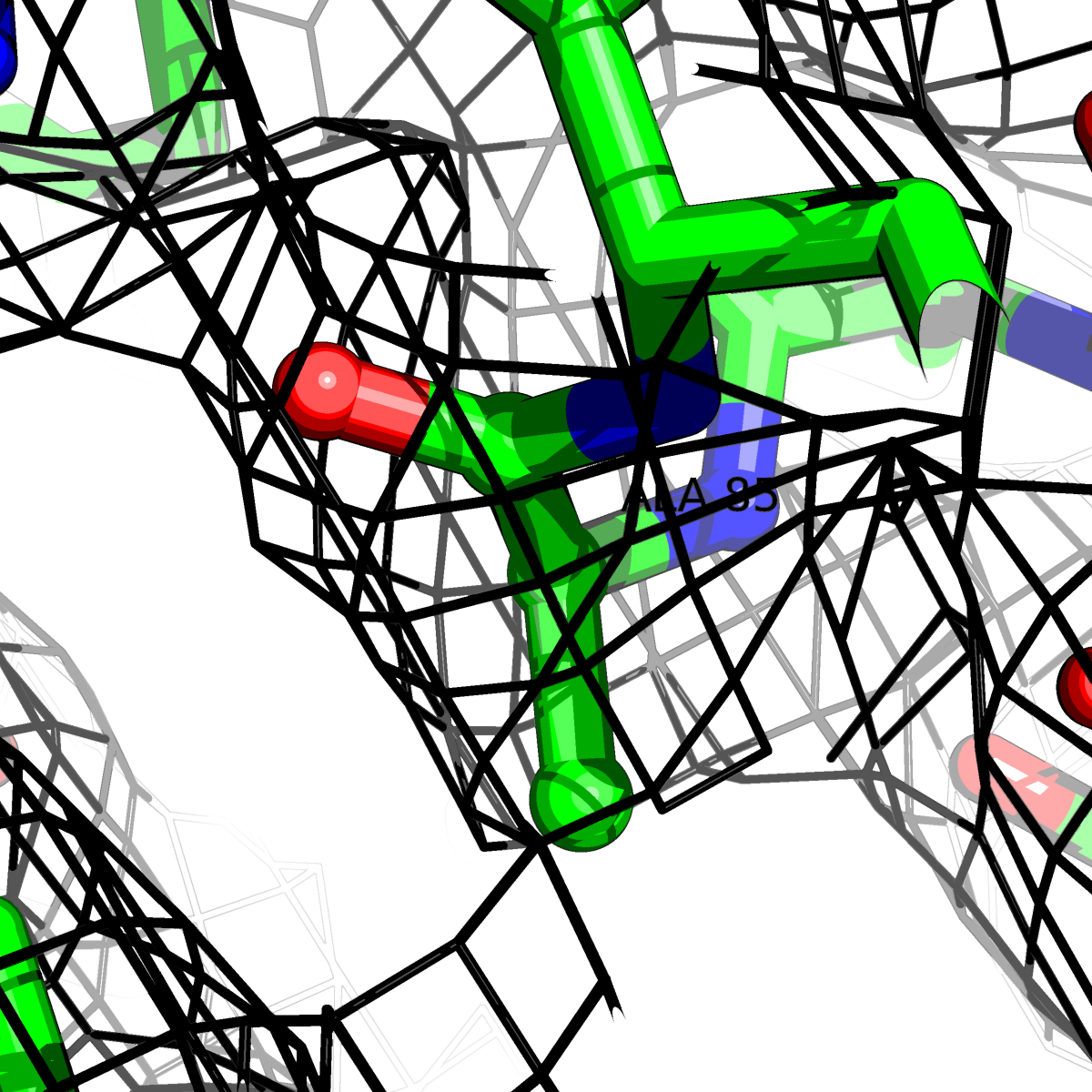 |
 |
 |
 |
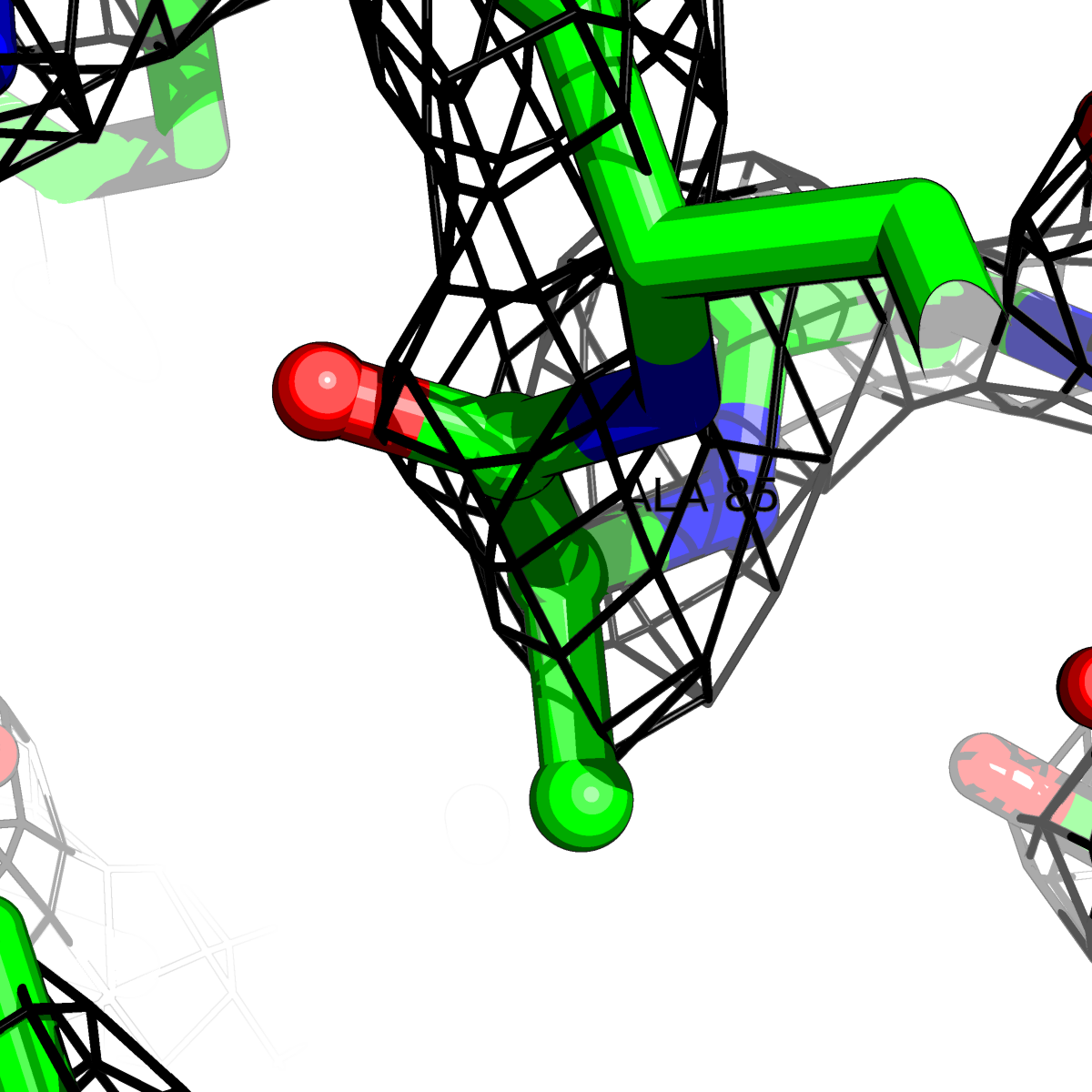 |
 |
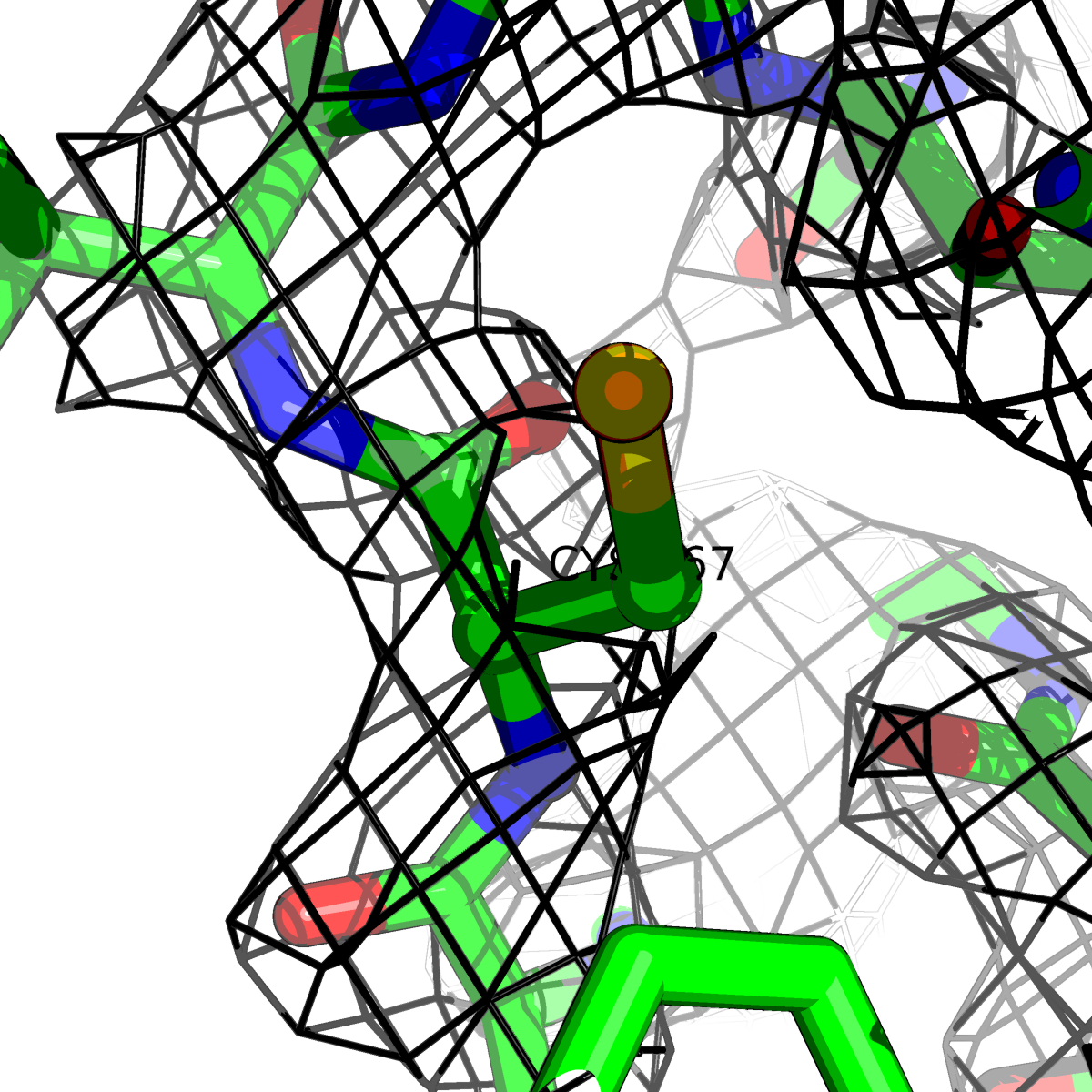
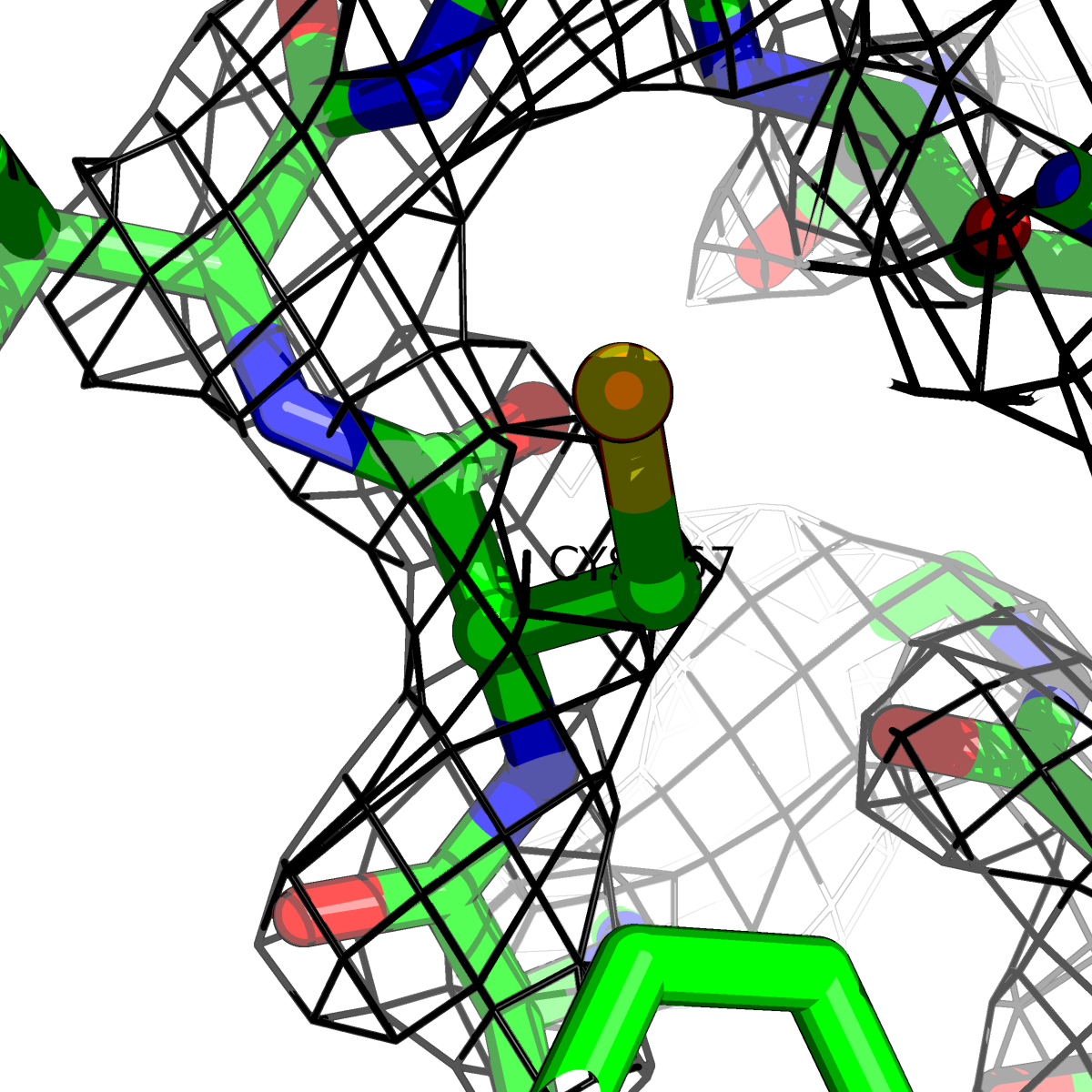
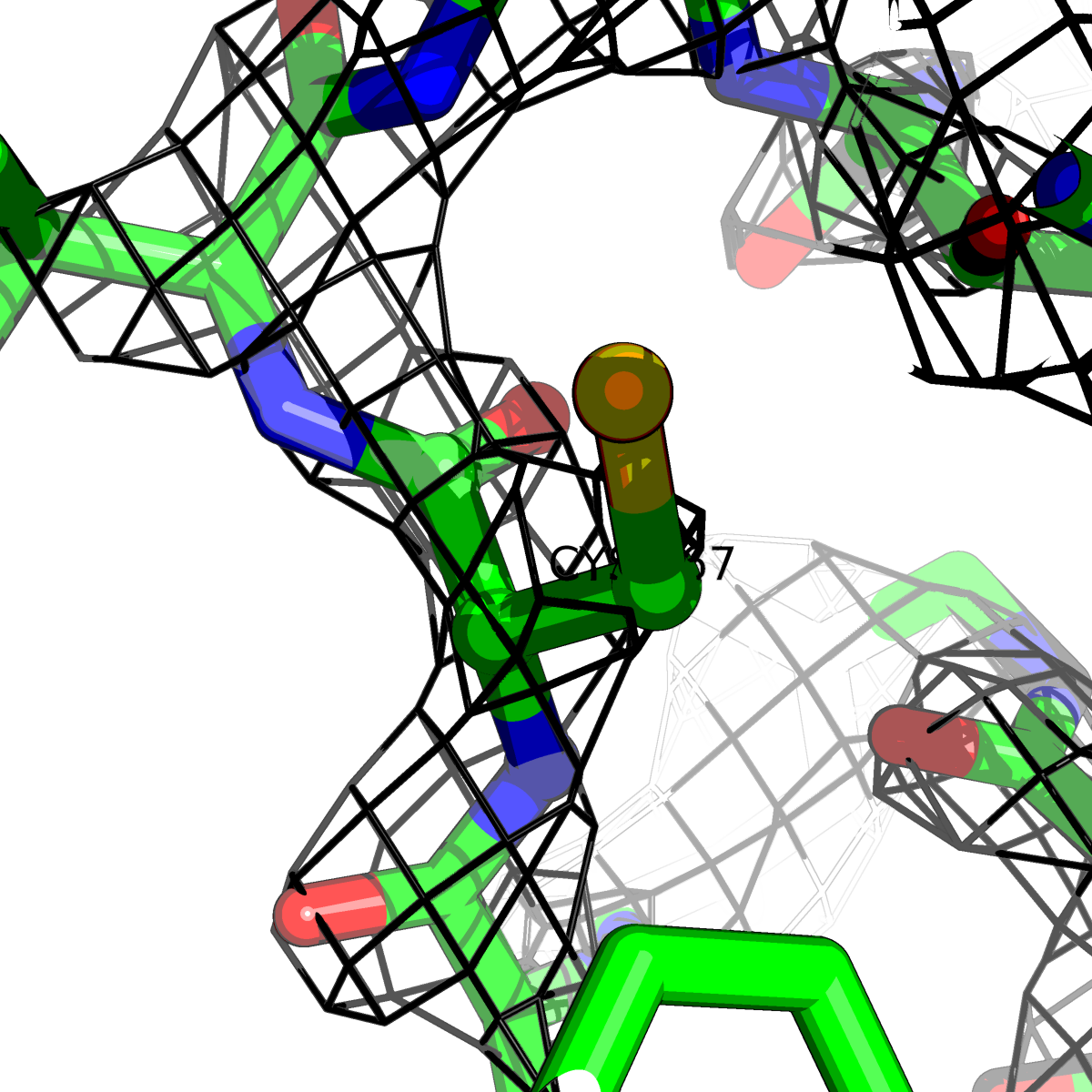
| Цепь А: цистеин - 167 | 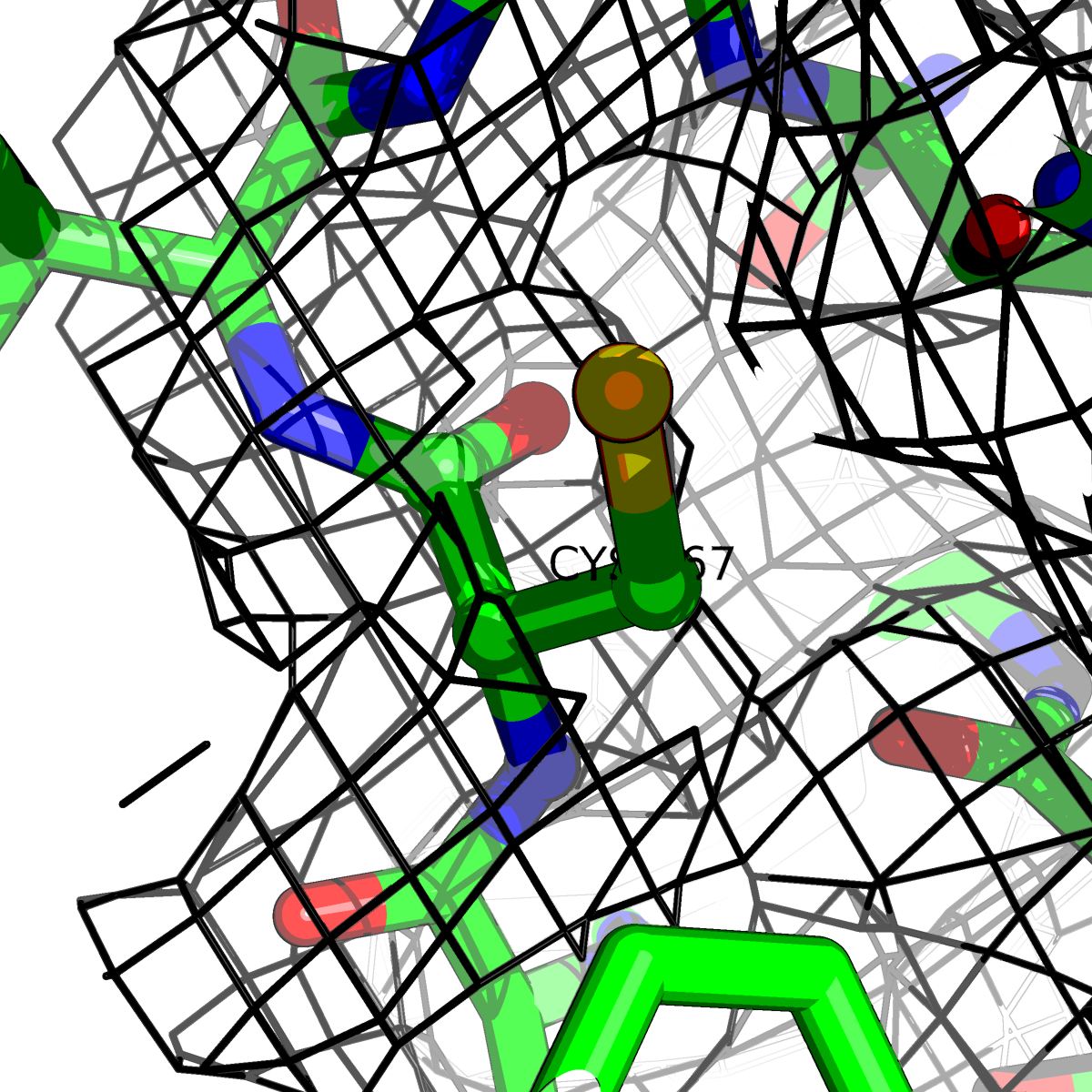 |
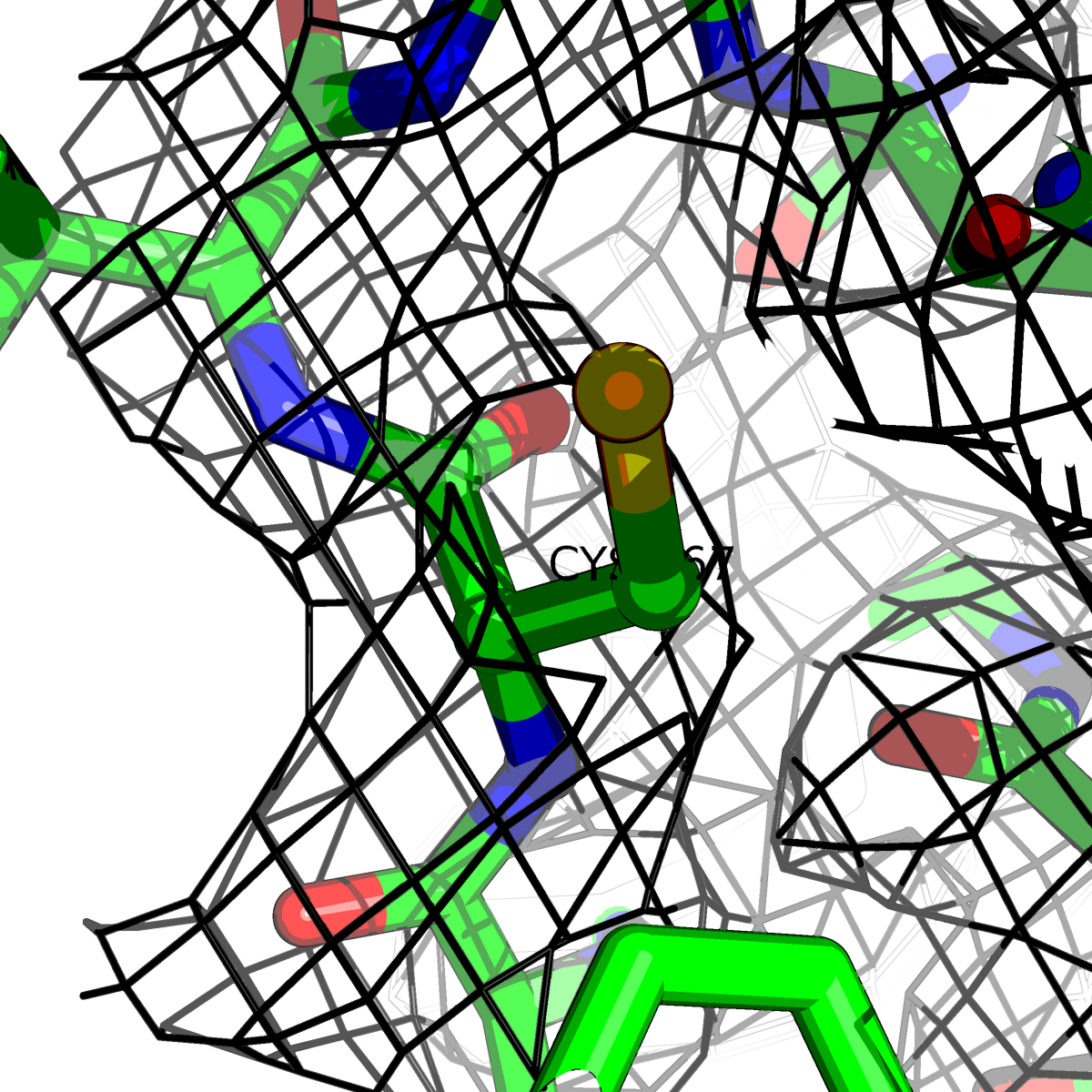 |
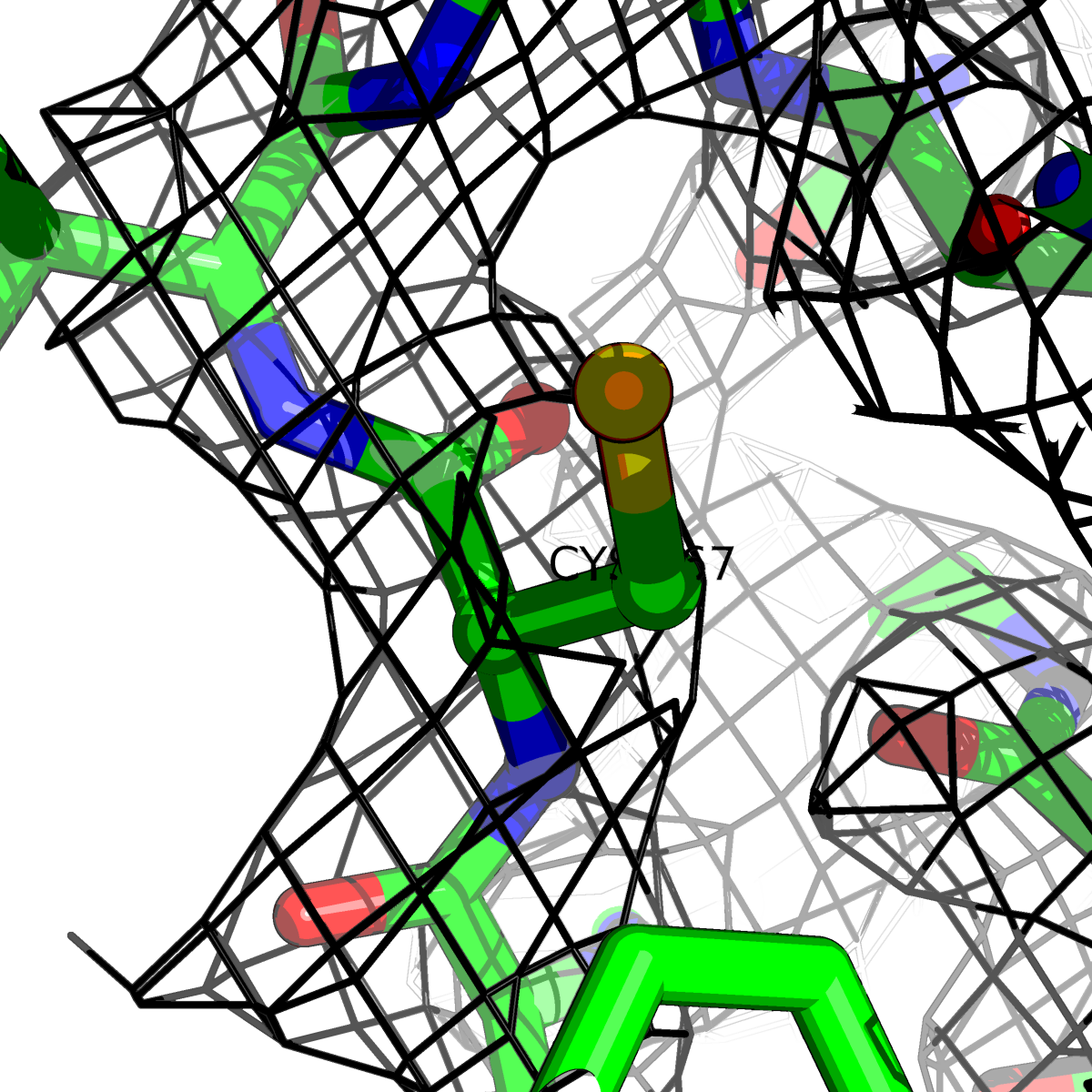 |
 |
 |
 |
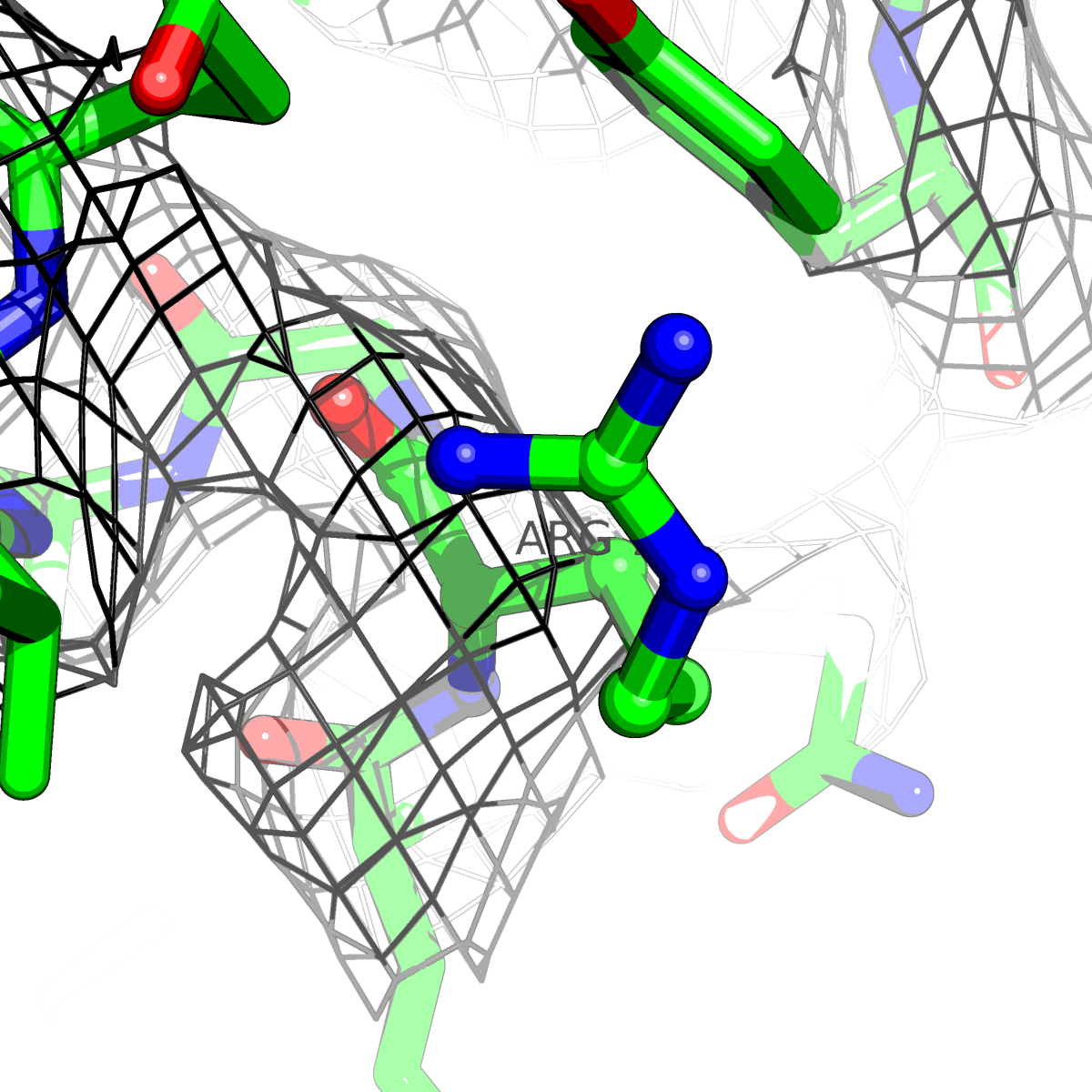
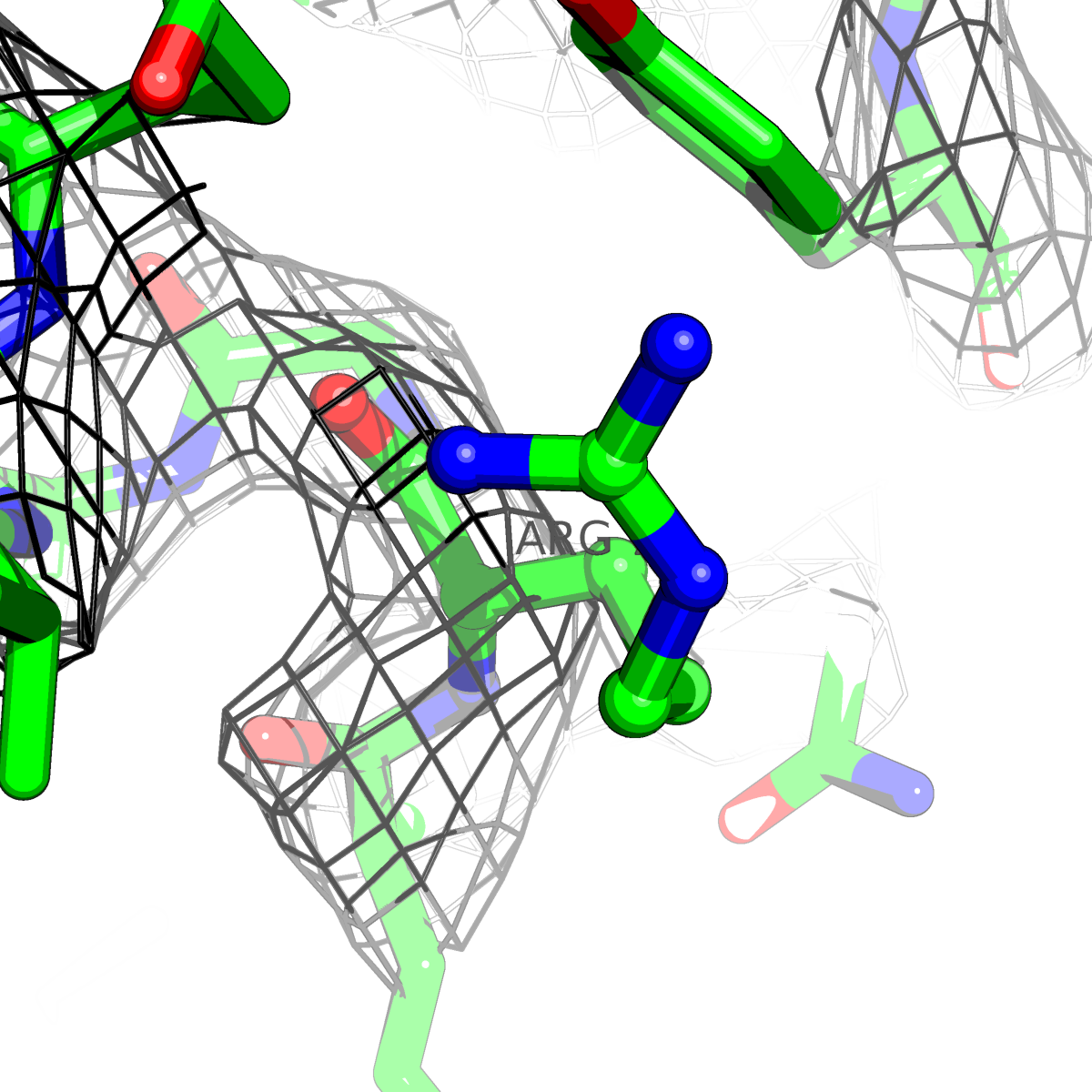
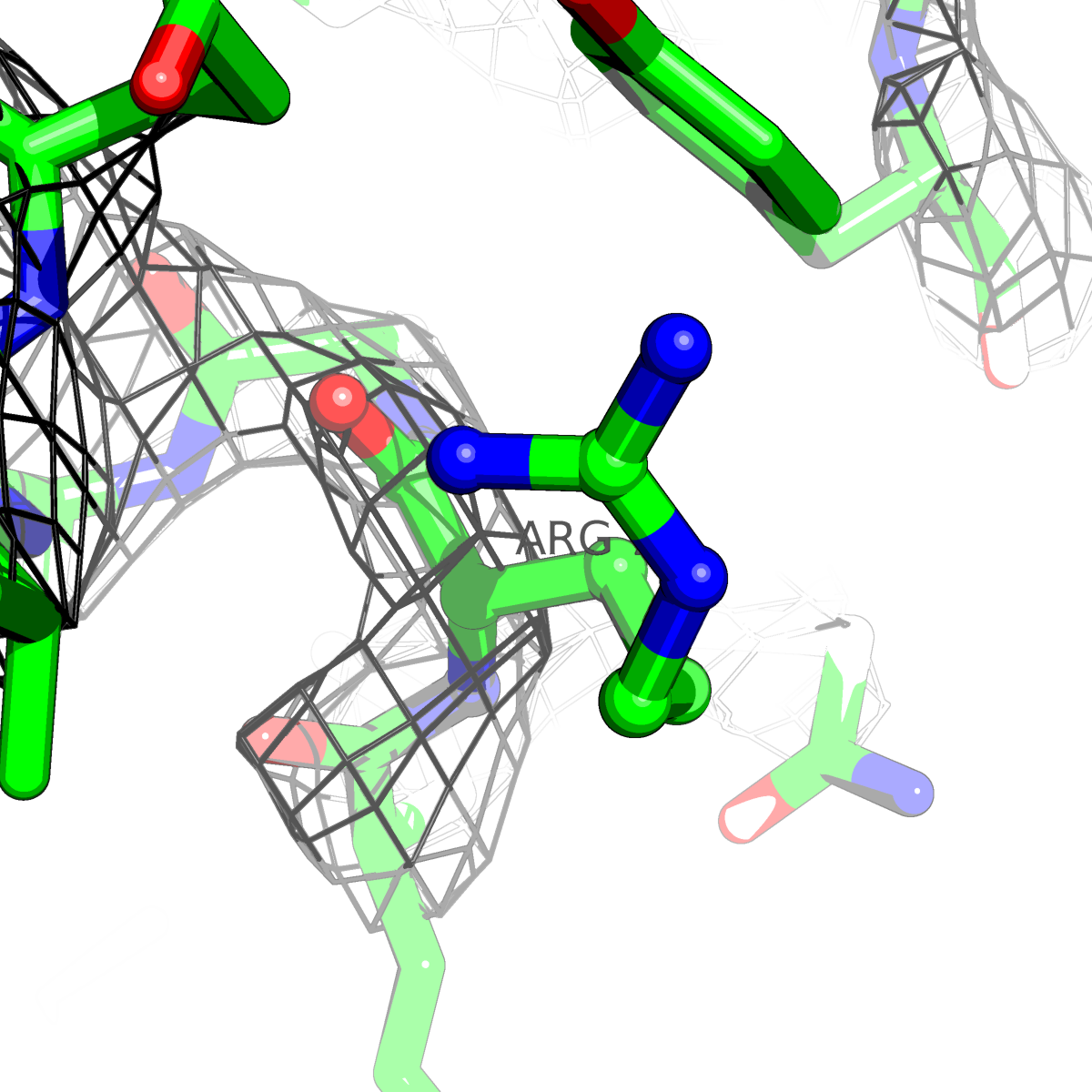
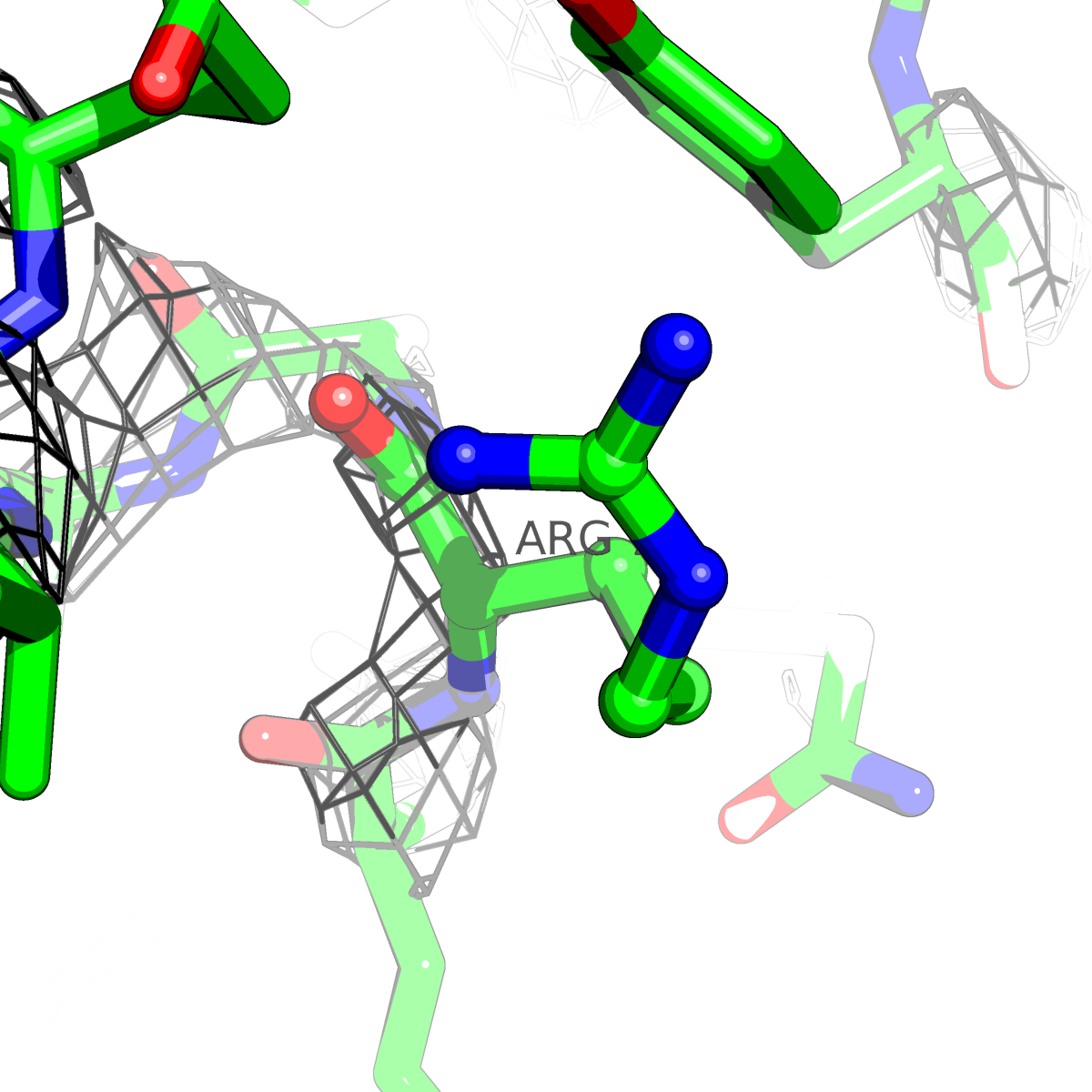
| Цепь А: аргенин - 79 | 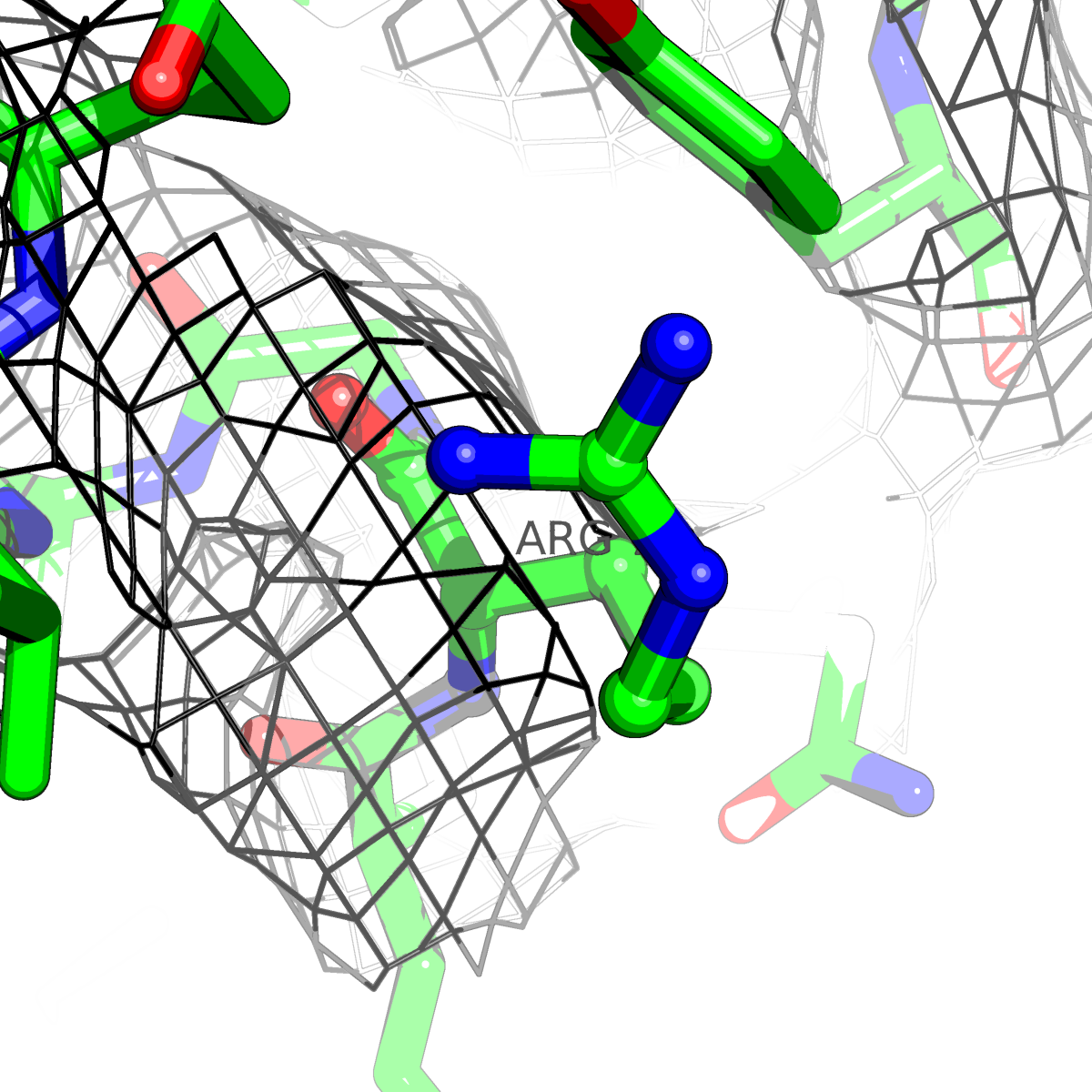 |
 |
 |
 |
 |
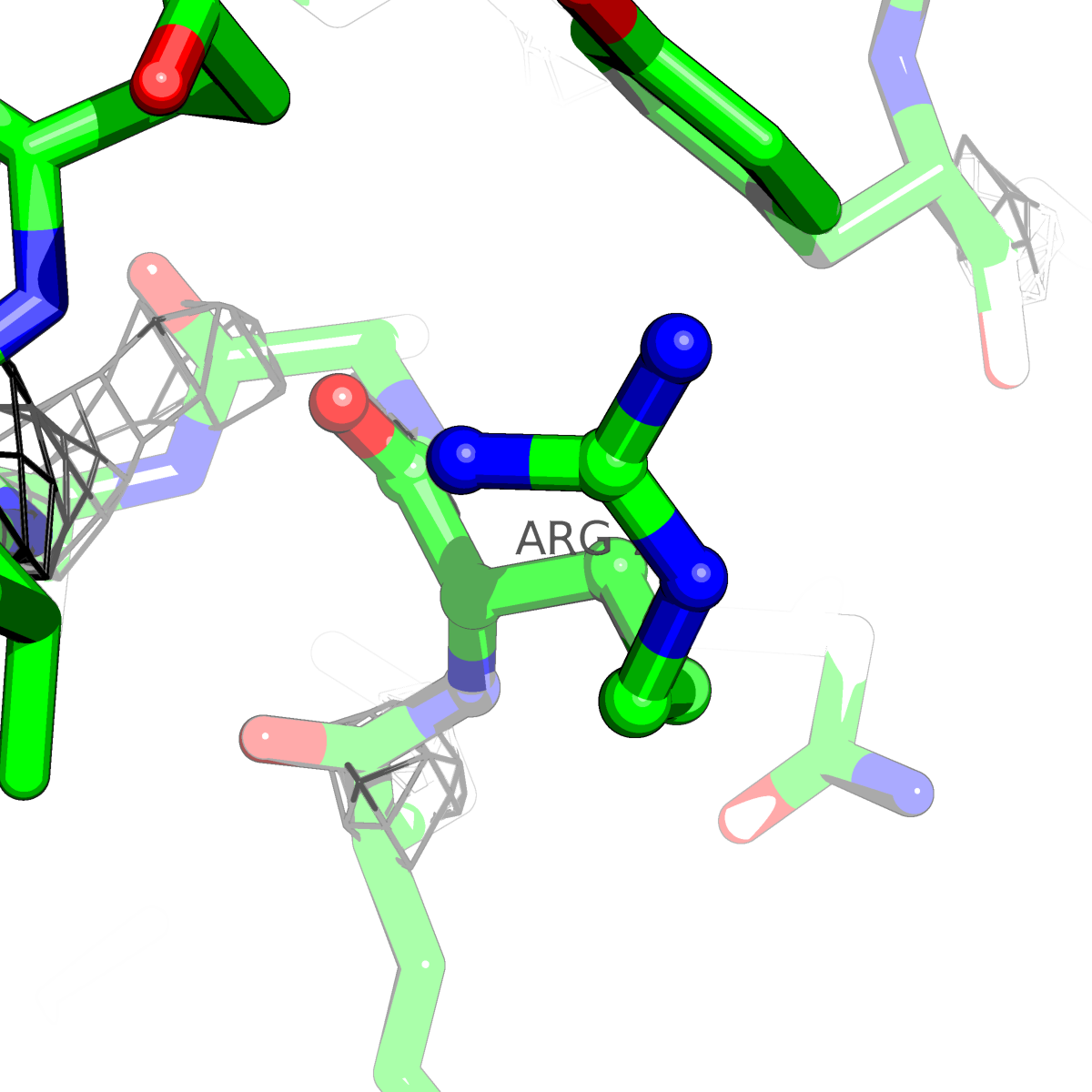 |
Таблица 2. Структура 2z3b. Визуализированы только избранные аминокислотные остатки и электронная плотность с уровенем подрезки 0.5σ, 1σ, 1.5σ, 2σ, 2.5σ и 3σ.
Из данных Таблицы 2 видно,что при увеличении уровня подрезки могут быть видны места с высокой электронной плотностью (кратные или сопряженные связи). Но при этом не всегда различимо соответствие электронной плотности и ядер атомов. Это подтверждает высказанную ранее идею о недостаточном качестве структуры.
