Выбор структур и их описание
Для сравнения выбран блеок циклофилин А из бактерии Escherichia coli.
Данный белок является цитозольной пептидилпролил изомеразой.
У данного белка в PDB содержатся структуры, полученные:
- ЯМР (PDB id 1OCA, число моделей - 20)
- РСА (PDB id 1W8L, разрешение 1.8 Å)
Совмещение структур представлено на Рисунке 1. Как видно из Рисунка 1, структуры, даже полученные разными методами, весьма похожи.
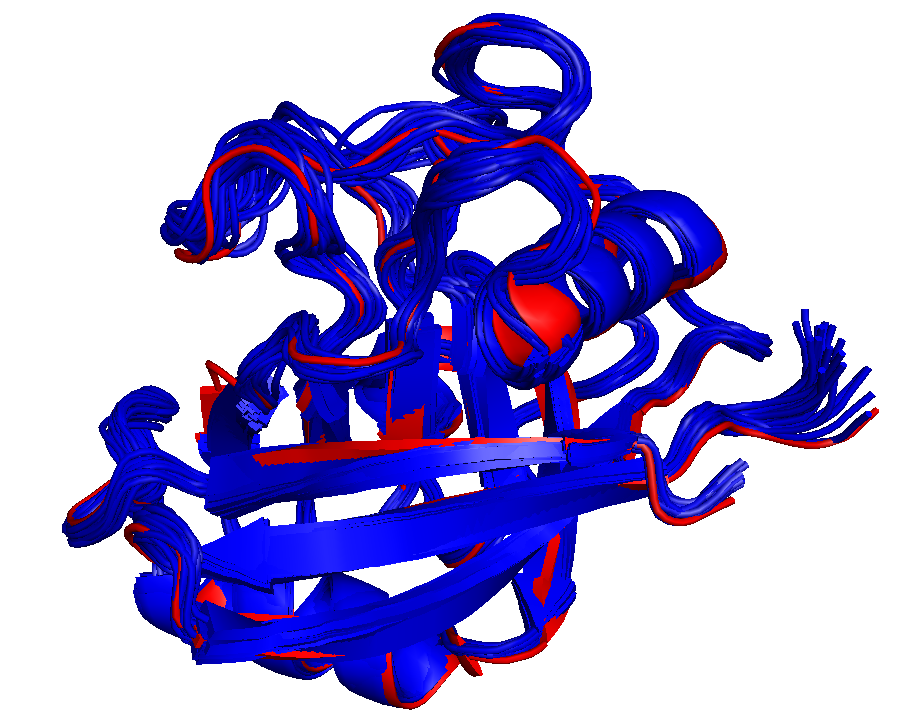
Рисунок 1. Наложение структур белка циклофилина А, полученных разными способами.Красным - РСА,синим - ЯМР.
Водородные связи в различных местах белка
Для анализа выбраны следующие водородные связи:
- внутри α-спирали (Рисунок 2): между карбоксильным кислородом Ala38 и аминогруппой Gly42
- в ядре белка (Рисунок 3):NH-Ser99 и O-Phe113
- на поверхности белка (Рисунок 4): между аминогруппой боковой цепи Arg37 и кислородом боковой цепи Gln163
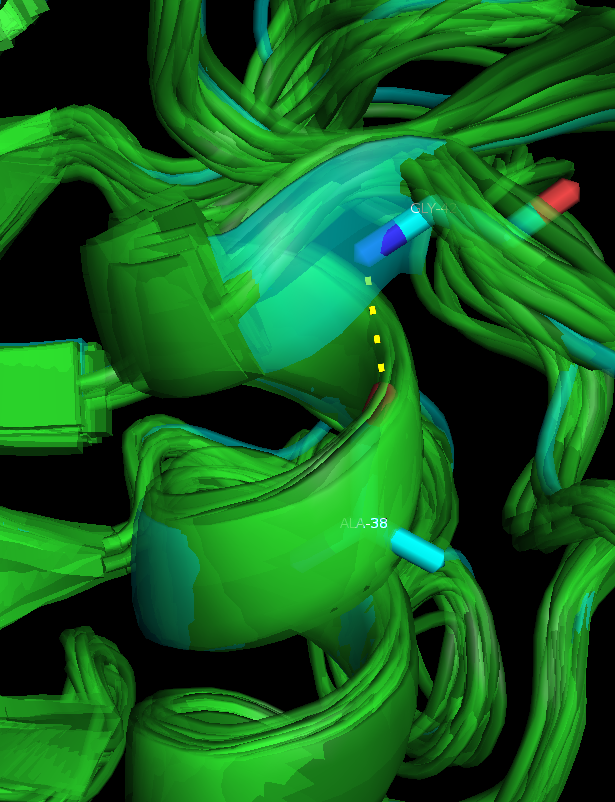
Рисунок 2. Водородная связь внутри α-спирали: между карбоксильным кислородом Ala38 и аминогруппой Gly42
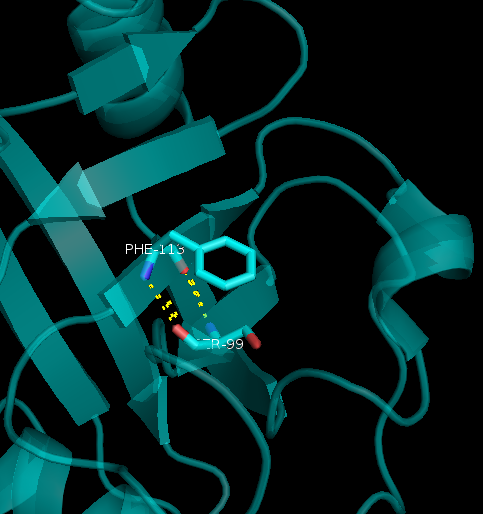
Рисунок 3. Водородная связь внутри в ядре белка:NH-Ser99 и O-Phe113
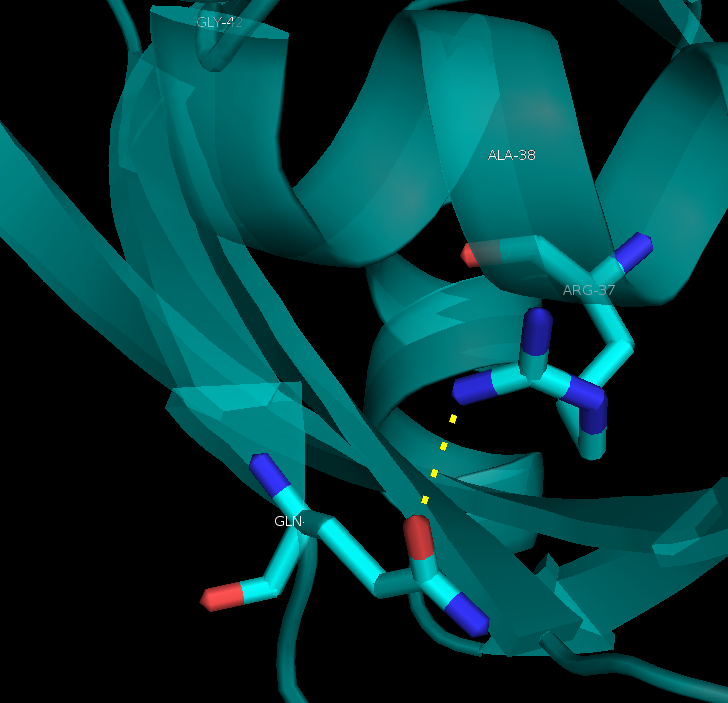
Рисунок 4. Водородная связь на поверхности белка : между аминогруппой боковой цепи Arg37 и кислородом боковой цепи Gln163
| Связь | Положение | Расстояние между атомами (Å) | Встречаемость в моделях ЯМР (%) | |||
| РСА | ЯМР | |||||
| минимум | медиана | максимум | ||||
| Ala38 O и Gly42 N | остов белка в α-спирали | 2.9 | 0 | 0 | 0 | 0 |
| Ser99 NH и Phe113 O | в глобуле белка между двумя бета-тяжами | 3.0 | 2.9 | 3.4 | 3.0 | 100 |
| Gln163 ОE1 и Arg37 NH1 | боковые радикалы на поверхности белка | 3.0 | 2.7 | 4.9 | 6.4 | 30 |
Таблица 1. Данные о выбранных водородных связях различных типов.
восстановленная функция – пунктирной линией.
Выводы
Не смотря на то, что внешне структуры, полученные ЯМР и РСА, выглядят похожими, существуют некоторые различия. Скорее всего это обусловалено тем, что в растворе некоторые части белка более подвижны из-за чего расстояния между некоторыми остатками могут отличаться. Внутри элемента вторичной структуры, в частности α-спирали, наблюдается относительная стабильность, но при этом возможна вариативность на концах. Такие же вещи наблюдаются у боковых радикалов аминокислотных остатков внутри ядра белка. Поверхностные петли наименее стабильны.
Из этого следует,что результаты полученные в статье  Sikic et al.,
посвященной поиску систематических различий между методами ЯМР и РСА согласуются с наблюдаемыми тут, а именно, что, в общем случае, в растворе бета-листы
стабильнее альфа-спиралей.
Sikic et al.,
посвященной поиску систематических различий между методами ЯМР и РСА согласуются с наблюдаемыми тут, а именно, что, в общем случае, в растворе бета-листы
стабильнее альфа-спиралей.
