Определение вторичной структуры
На сервере kodomo была определена вторичная структура белка с PDB-кодом 4LDC программой DSSP с помощью команды:
mkdssp -i 4LDC.pdb -o 4LDC.dssp
Выдача представлена в файле  .
.
Также было проведено определение вторичной структуры этого же белка с помощью Stride командой:
stride 4LDC.pdb -f4LDC.stride -h
Выдача в файле  . Сравнение найденных элементов вторичной структуры с указанными в заголовке pdb-файла приведено в таблице 1.
. Сравнение найденных элементов вторичной структуры с указанными в заголовке pdb-файла приведено в таблице 1.
| Элемент | PDB | DSSP | Stride | ||||
|---|---|---|---|---|---|---|---|
| Начало | Конец | Начало | Конец | Начало | Конец | ||
| 1 | Тяж | 266 | 277 | 266 | 277 | 266 | 277 |
| 2 | Тяж | 282 | 291 | 282 | 291 | 282 | 291 |
| 3 | Спираль-3 | 342 | 349 | 343 | 348 | 343 | 348 |
| 4 | Спираль | 377 | 390 | 378 | 389 | 378 | 389 |
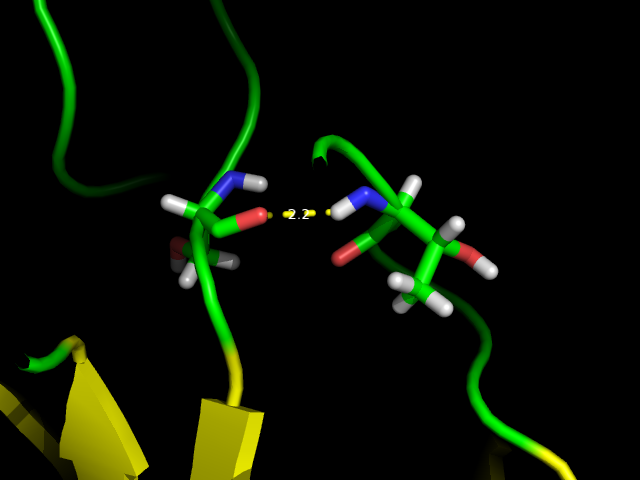
Стоит отметить, что под номером 3 указана "перекрученная" спираль 310. Её длина составляет 6-8 аминокислотных остатков, что довольно не характерно, т.к. такие спирали обычно короче. Также программой Stride обнаружен мостик в петлях между остатками Ser302 и Thr328 длиной 2.2 Å (см. рис. 1).
Следует сказать, что длина β-тяжей, определённых DSSP и Stride в точности совпадает с данными из pdb-файла. Но длины спиралей по версии DSSP и Stride должны быть на один аминокислотный остаток с каждого конца короче, чем в заголовке pdb-файла.
Карта β-листов
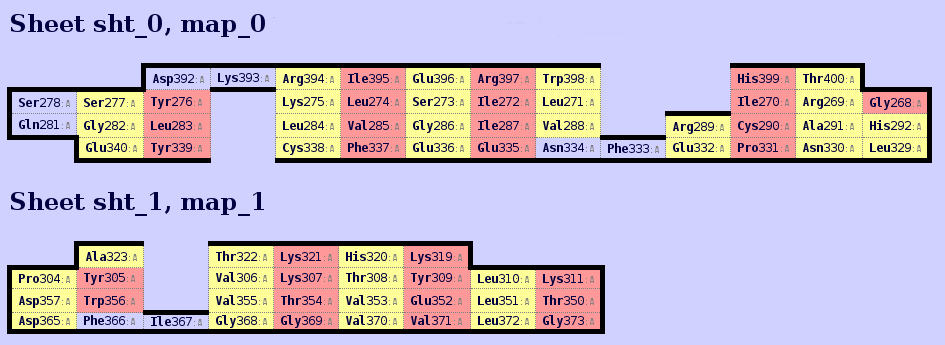
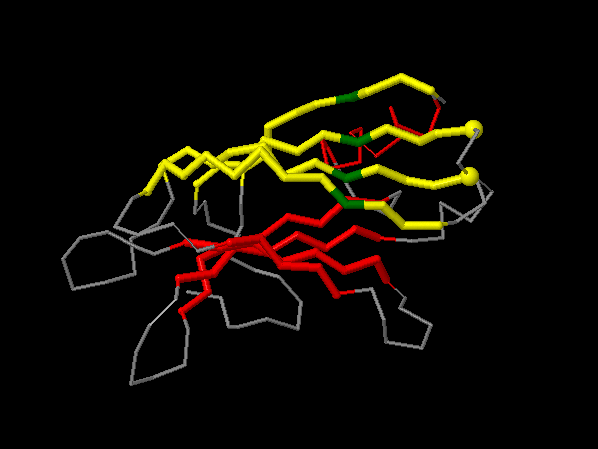
С помощью программы SheeP была построена карта β-листов структуры 4LDC (см. рис. 2), которые представлены на рис. 3.
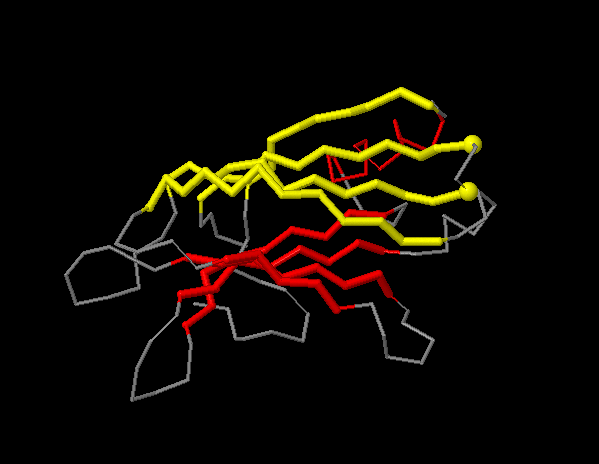
Рисунок 3. Изображение β-листов, представленных на карте рисунка 2, sht_0 - жёлтый, sht_1 - красный. Позади видна спираль, также выделенная красным.
На рисунке 4 выделен хребет β-листа, соответсвующий столбцу Ile395, Leu274, Val285, Phe337 на карте листа sht_0. Данный хребет обращён внутрь белка и представлен гидрофобными аминокислотами.
На рисунке 5 выделены все аминоксилотные остатки листа sht_0, обращённые к гидрофобному ядру. На карте β-листа эти остатки отмечены красным.
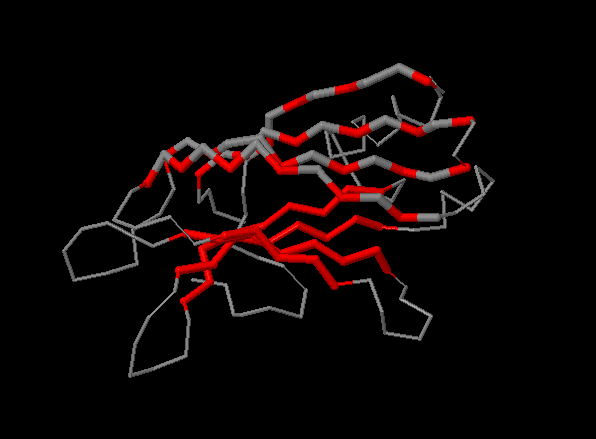
Рисунок 5. Красным цветом в верхнем β-листе выделены аминокислоты, обращённые внутрь белка, а серым (в верхем β-листе) - обращённые наружу.
Для β-листа sht_1 ниже представлена схема водородных связей. Положение водородных связей соответсвтует выдаче программы Stride. В этом листе присутствует нерегулярность (выпячивание), представленная Ile367, который смотрит в сторону гидрофобного ядра, как и гребень Thr322-Gly368.
O ALA323 N --- O THR322 N --- O LYS321 N --- O HIS320 N --- O LYS319 N
| | |
N PRO304 O --- N TYR305 O --- N VAL306 O --- N LYS307 O --- N THR308 O --- N TYR309 O --- N LEU310 O --- N LYS311 O
| | | | | | | |
O ASP357 N --- O TRP356 N --- O VAL355 N --- O THR354 N --- O VAL353 N --- O GLU352 N --- O LEU351 N --- O THR350 N
| | / / | | | | | |
N ASP365 O --- N PHE366 O --- N ILE367 O --- N GLY368 O --- N GLY369 O --- N VAL370 O --- N VAL371 O --- N LEU372 O --- N GLY373 O