Восстановление кристаллической ячейки
В качестве объекта для анализа используется структура 1XTM (белок, подобный супероксид дисмутазам).
В поле CRYST1 pdb-файла указана следующая информация:
CRYST1 52.462 104.350 58.756 90.00 90.00 90.00 P 21 21 2 8
Отсюда получаем кристаллографические характеристики:
- Длины направляющих векторов кристалла:
- a = 52.46 Å
- b = 104.35 Å
- c = 58.76 Å
- Углы между направляющими векторами кристалла:
- α = 90.00°
- β = 90.00°
- γ = 90.00°
- Кристаллографическая группа: P 21 21 2
- Число молекул в ячейке: 8
P - примитивная пространственная группа
21 - винтовая ось 21 по оси X и Y
2 - поворотная ось 2 по оси Z
Для восстановления ячейки использовалась команда symexp в PyMol с последующим отбором нужных цепей:
symexp sym, 1xtm, all, 3
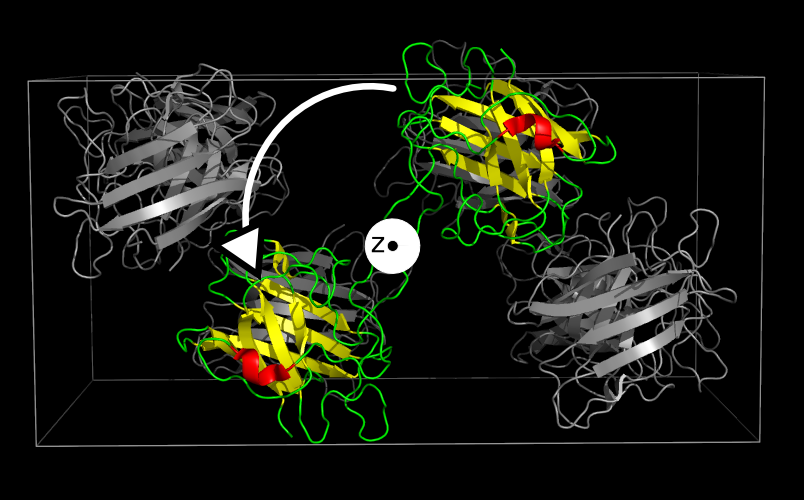
В результате была получена ячейка с 8 молекулами белка (см. рис. 1).
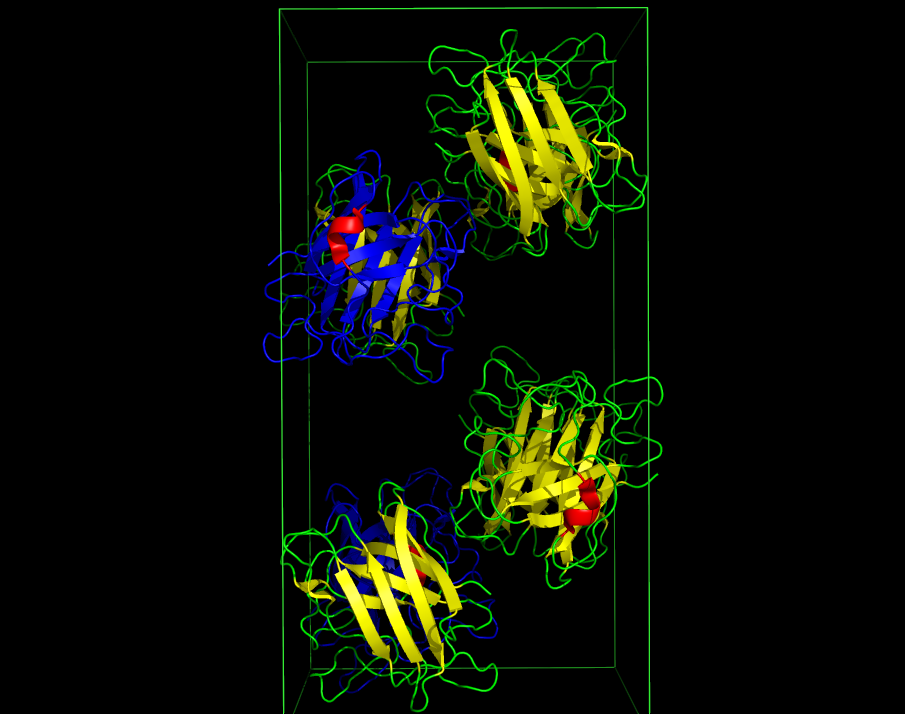
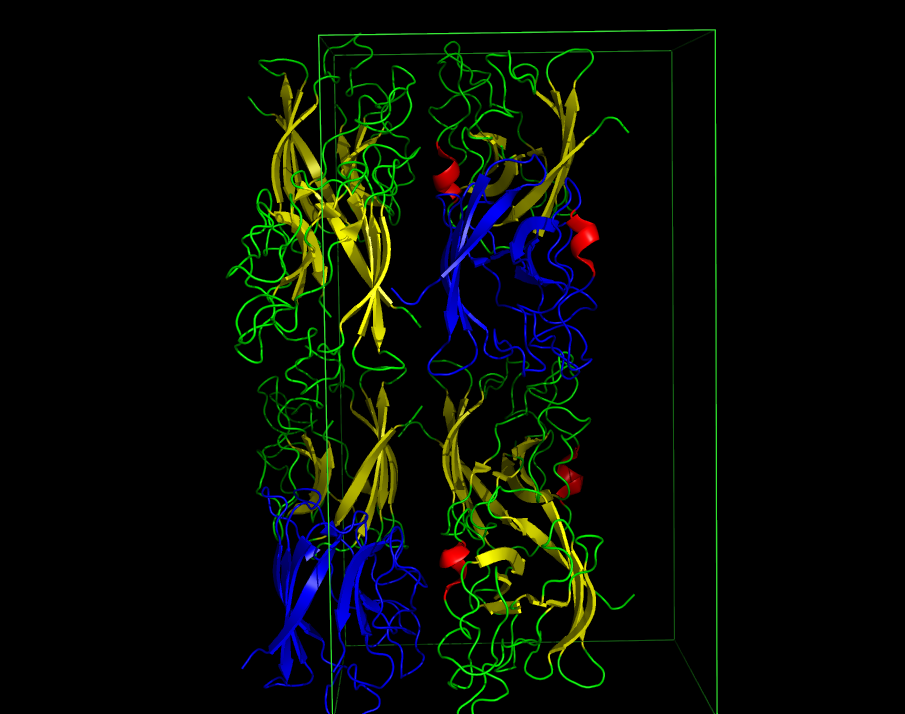
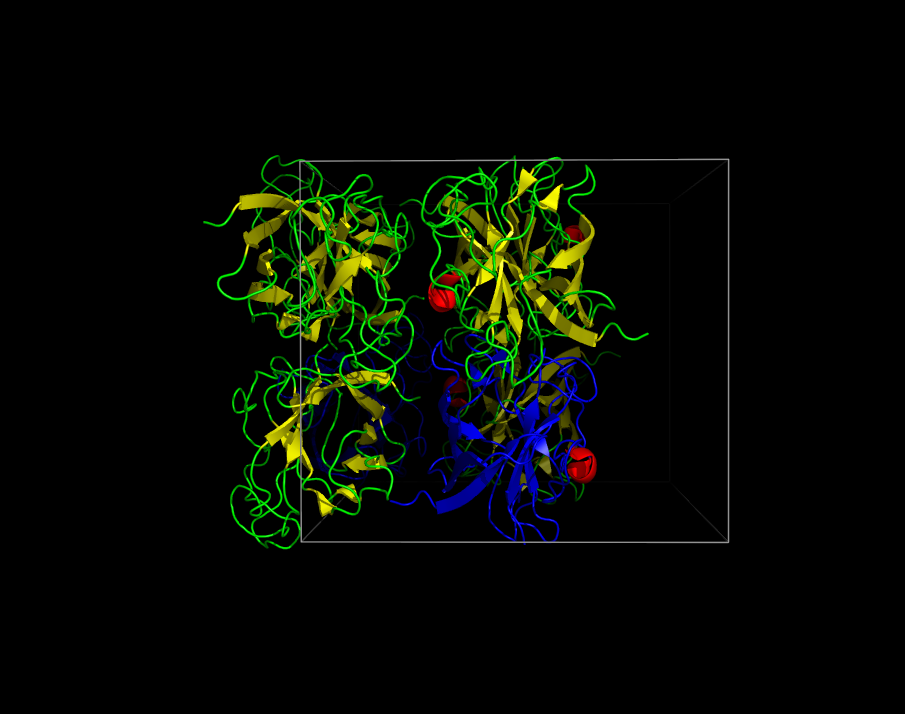
Рисунок 1. Изображение кристаллической ячейки 1XTM в 3 проекциях. Синим показана асимметрическая единица.
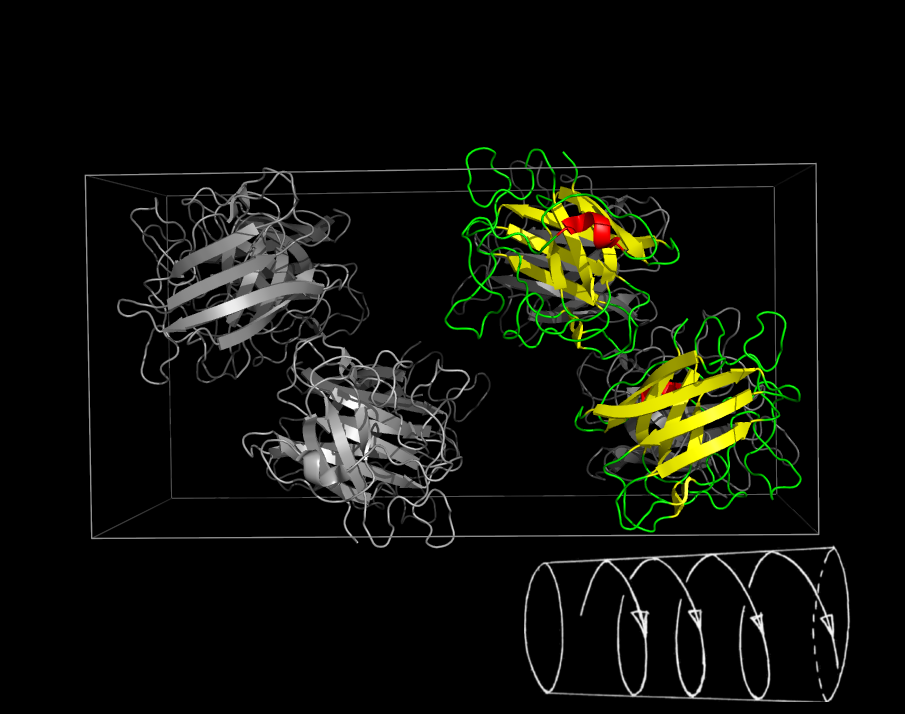
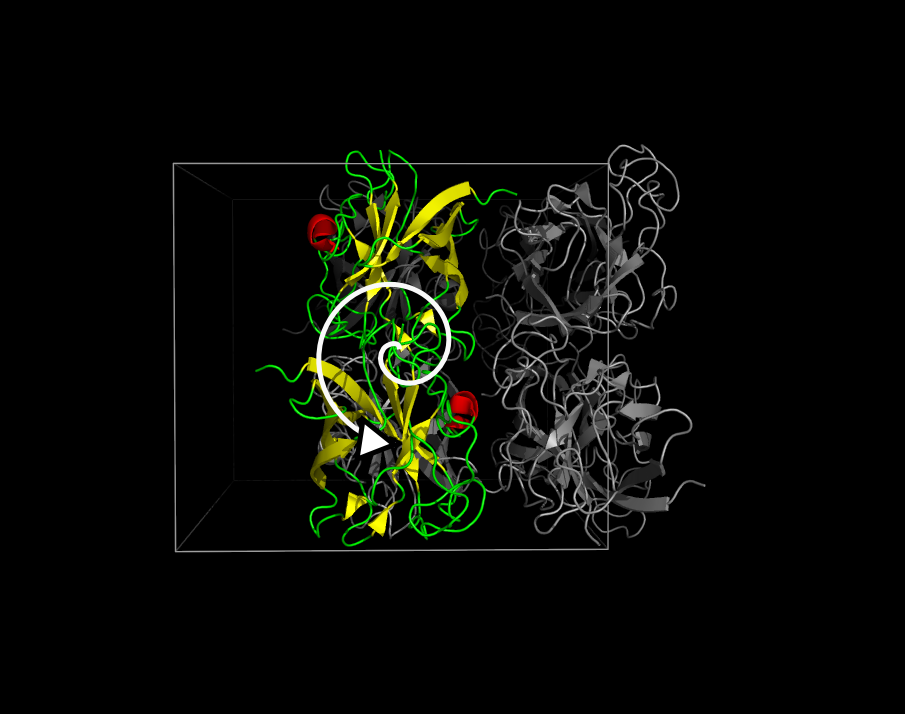
В полученной ячейке на примере цепи B можно убедиться в поворотной (см. рис. 2) и винтовой (см. рис. 3) симметриях. Красная спираль служит хорошим ориентиром.
Затем модель была раширена до части кристалла (несколько соседних ячеек). Структура кристалла представлена на рисунке 4. Немного изменённая версия получившейся модели доступна в виде сессии PyMol.


Рисунок 4. Демонстрация части кристалла. Красным выделена асимметрическая единица (и спирали), цветным - кристаллическая ячейка, синим - соседние ячейки.
Дальнейшие изображения имеют обозначения аналогичные предыдущим.
Взаимодействие с белками из соседних ячеек
Для определения и визуализации контактов к указанной сессии PyMol применялся скрипт  . С его помощью детектируются сильные и средние водородные связи (до 3.2 Å). С соседними ячейками было обнаружено 6 контактов между белками:
. С его помощью детектируются сильные и средние водородные связи (до 3.2 Å). С соседними ячейками было обнаружено 6 контактов между белками:
-
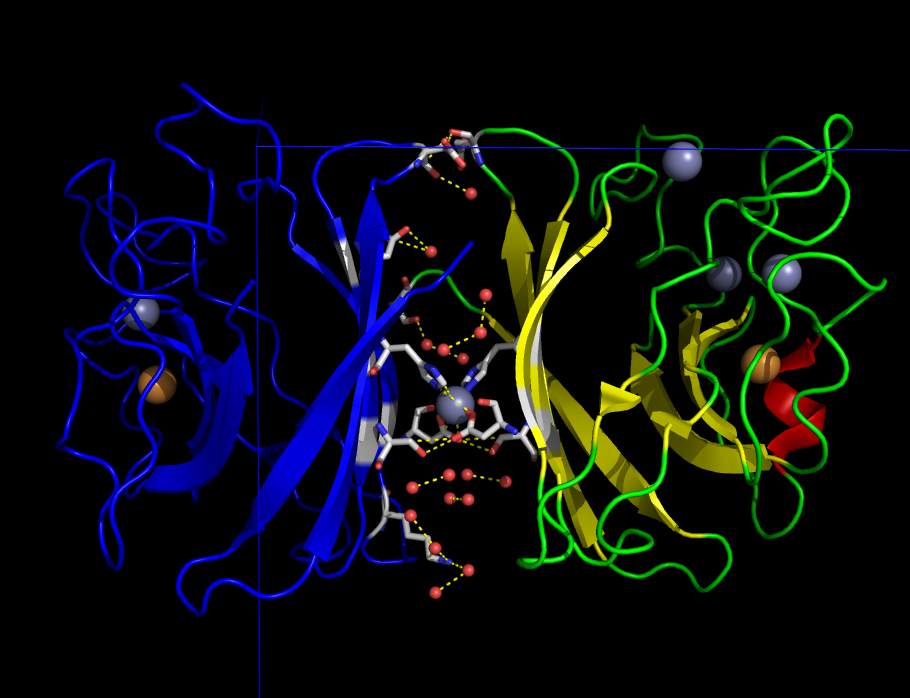
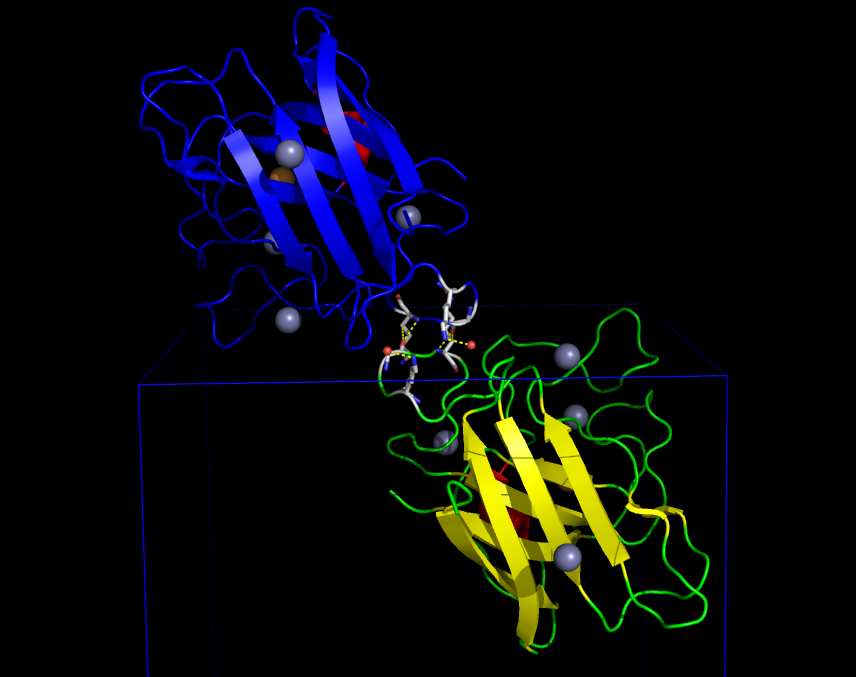
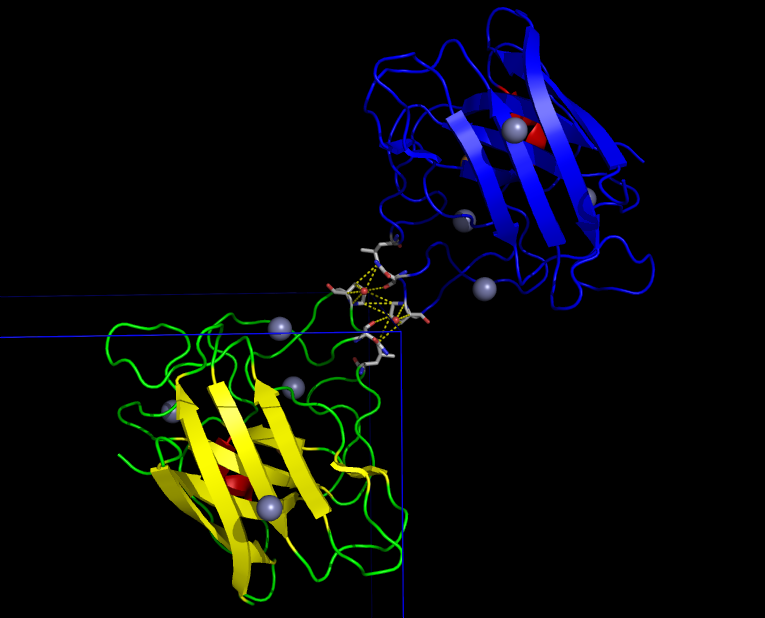
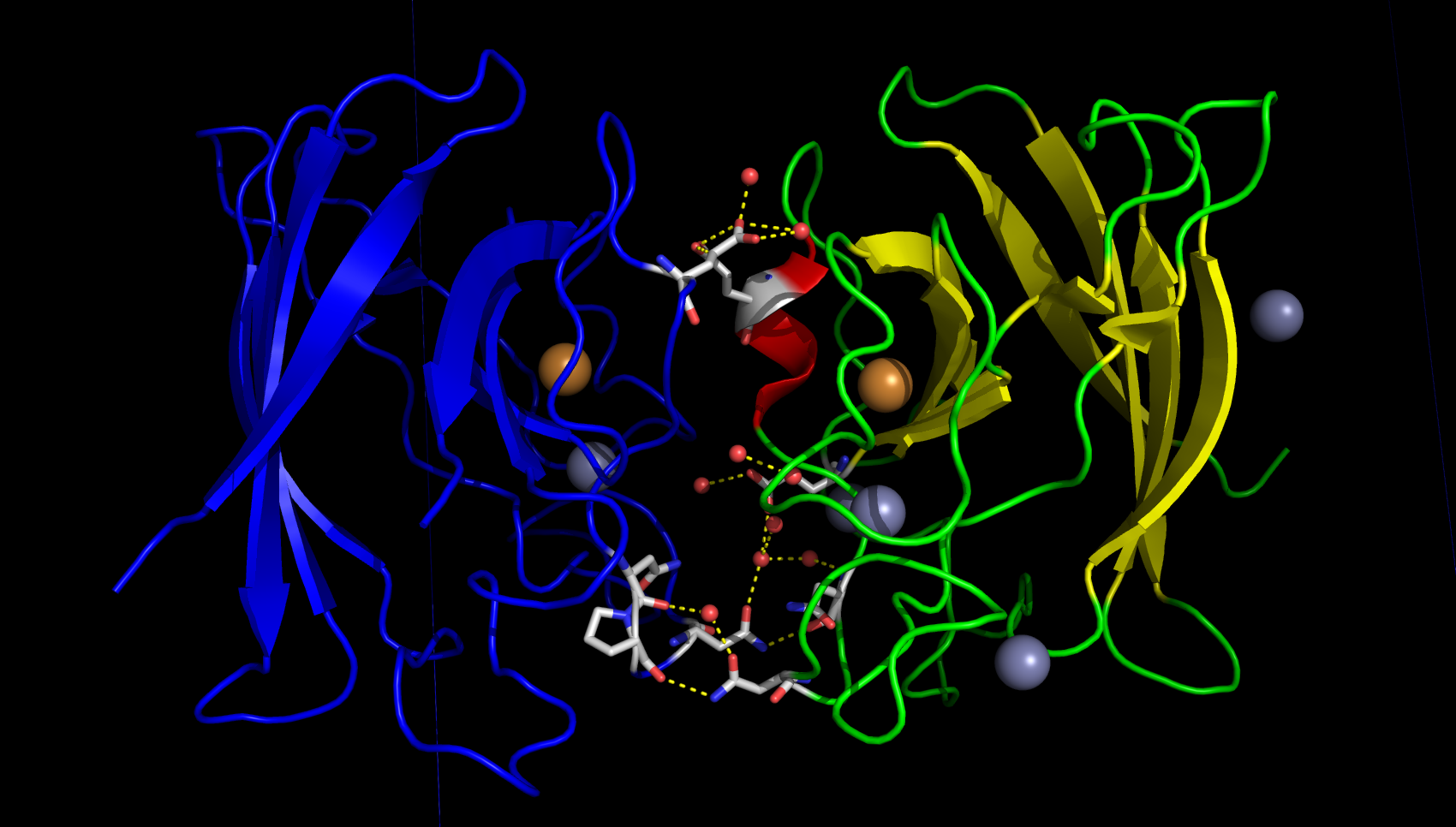
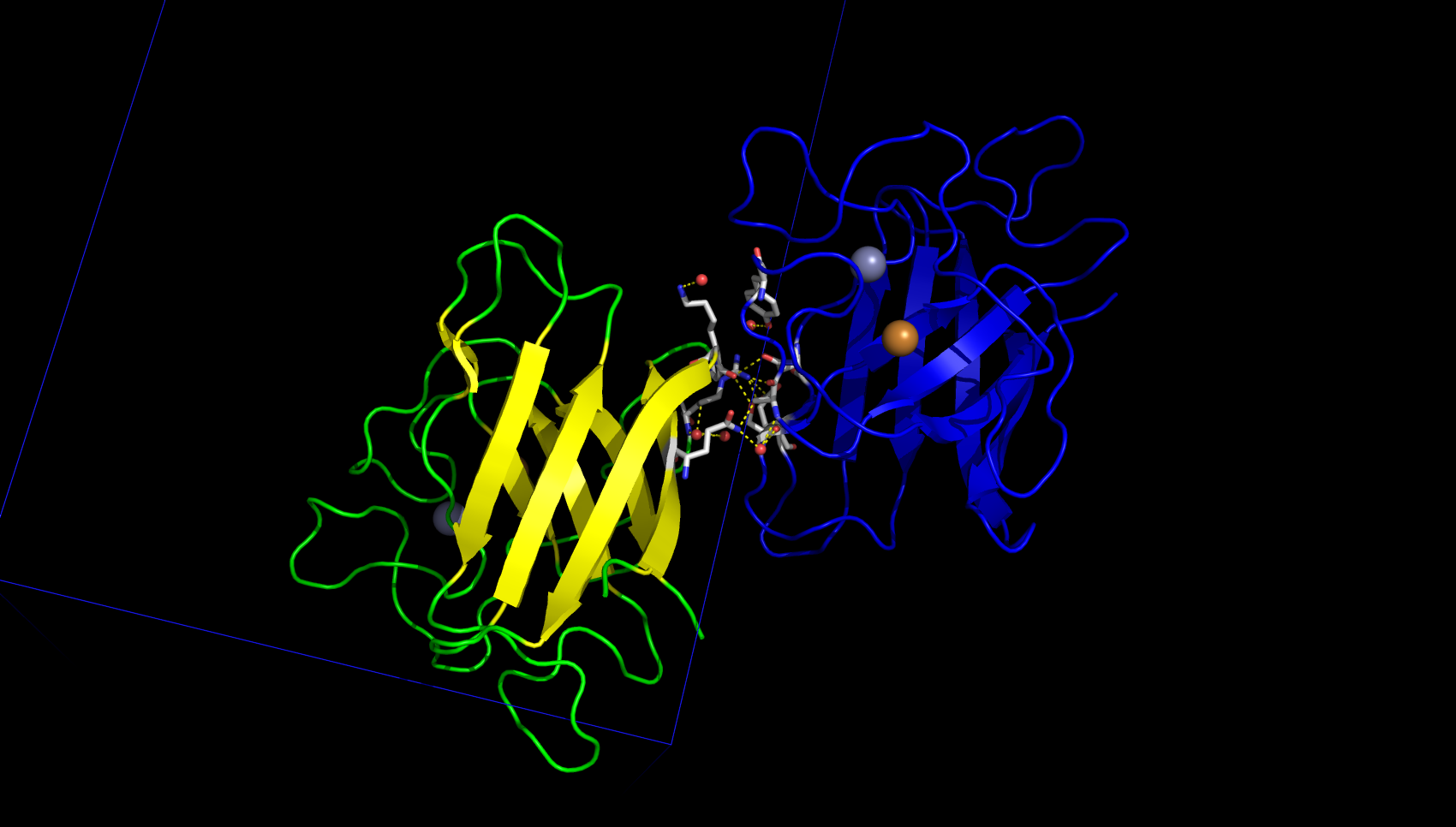
Один из значимых контактов изображён на рисунке 5. В этом взаимодействии между белками принимают участие молекулы воды и ион цинка. Связывание цинка является биологически значимым - именно оно обуславливает образование гомодимера.
-
Намного менее значимыми для кристалла (и белка), являются контакты по диагонали (см. рис. 6). Они лишь поддерживают определённое положение петель.
-
О взаимодействии сказано в предыдущем пункте.
-
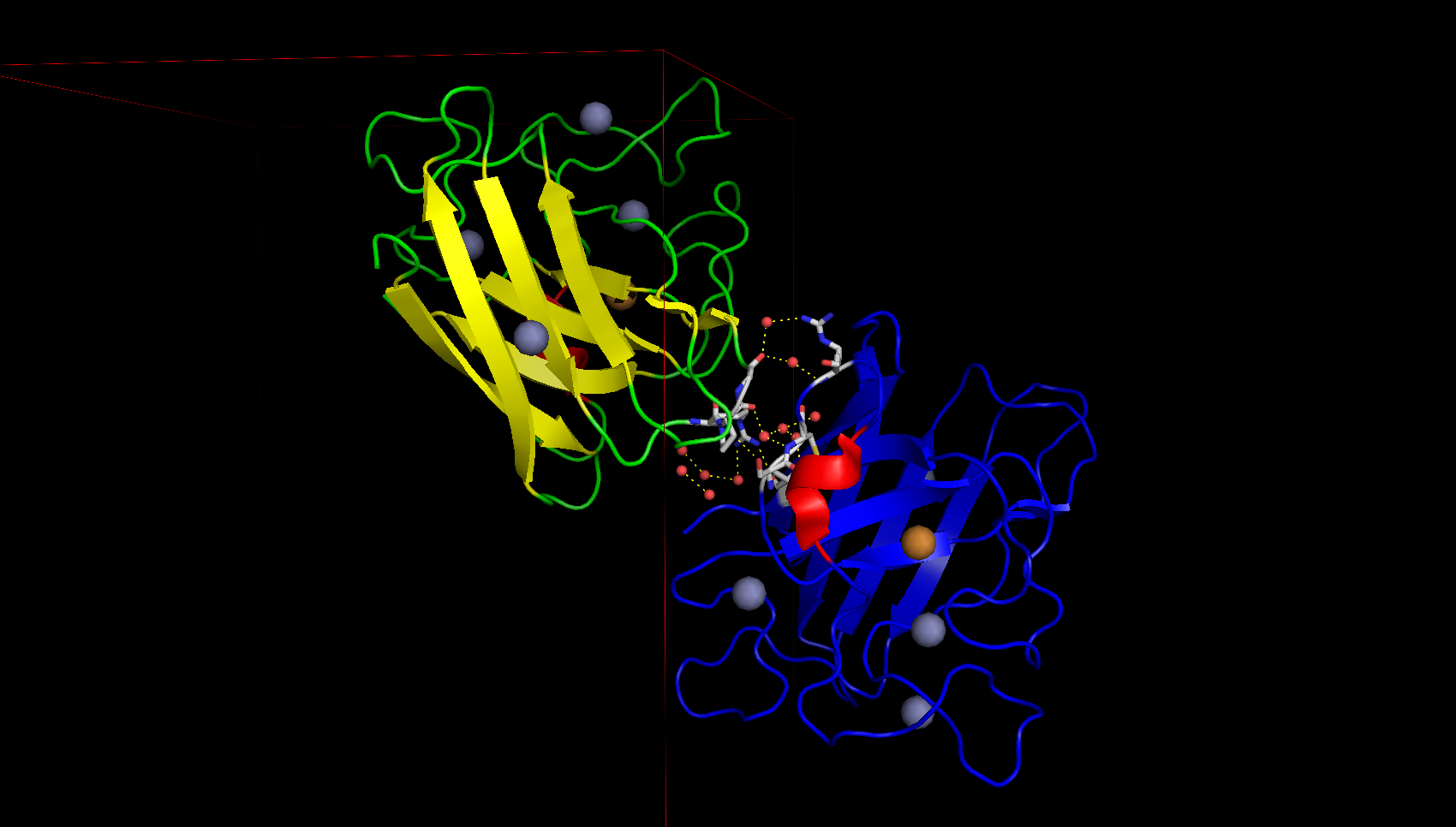
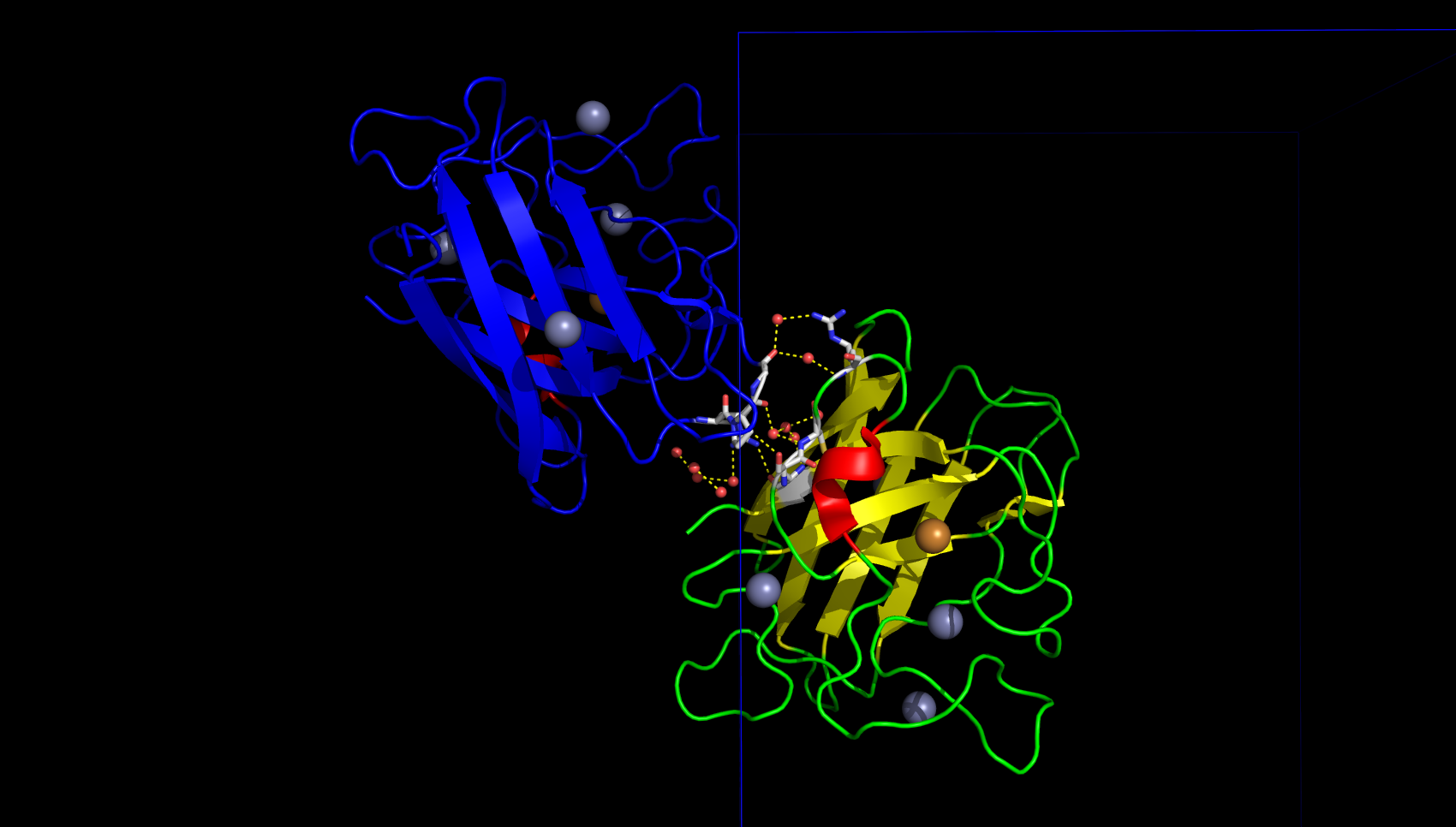
В контакте, изображённом на рисунке 7, содержится много молекул воды. Интересно, что в этом контакте есть взаимодействие белков через 3 молекулы воды. Возможно, данный контакт важен для поддержания структуры кристалла.
-
На рисунке 8 изображён контакт противоположными контакту 1 сторонами.
-
Ещё один тип контакта изображён на рисунке 9.
Все возможные контакты между белками внутри кристаллы продемонсрированы на рисунке 10, а также в виде сессии PyMol.
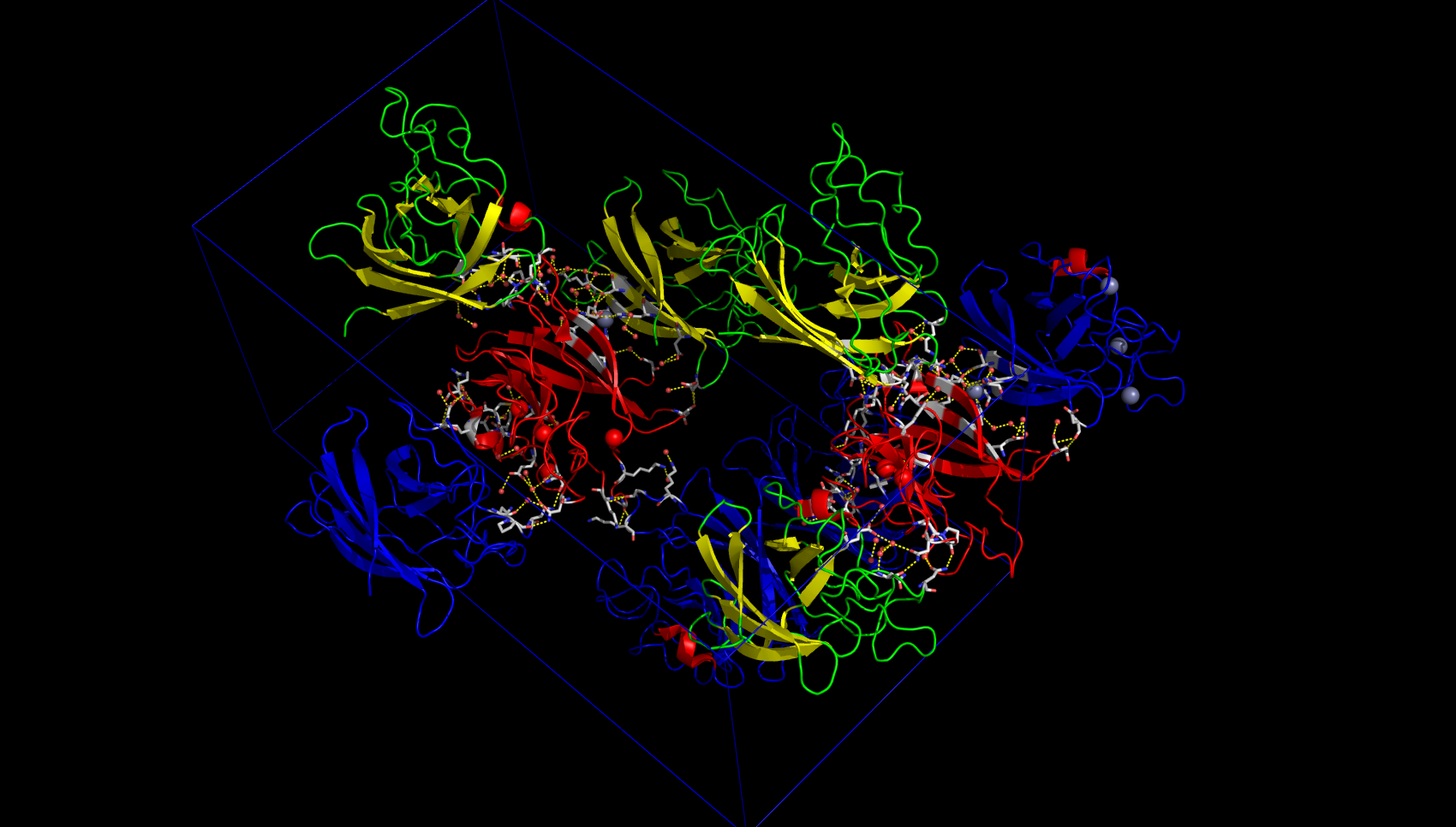
Рисунок 10. Все возможные контакты белков с ассиметрической единицей (выделена красным). Обозначения в описании к рис. 5.
Таким образом, было найдено природное взаимодействие (димеризация) белков для связывания иона цинка и ещё 5 различных контактов между белками, поддерживающих кристалл (не учитывались слабые водородные связи длиной больше 3.2 Å), которые в природе скорее всего не характерны.
Странное расположение белковой цепи в структуре ДНК-белкового комплекса 3hdd
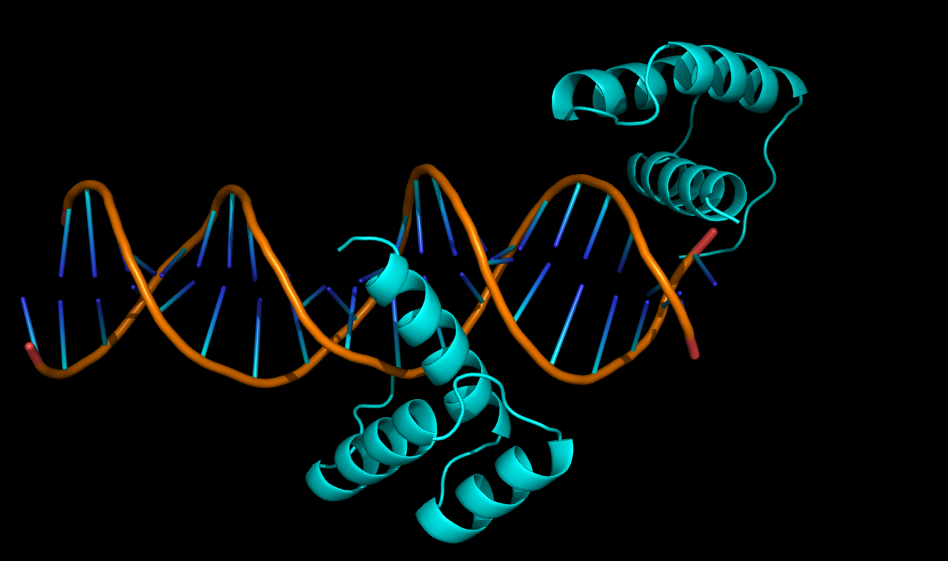
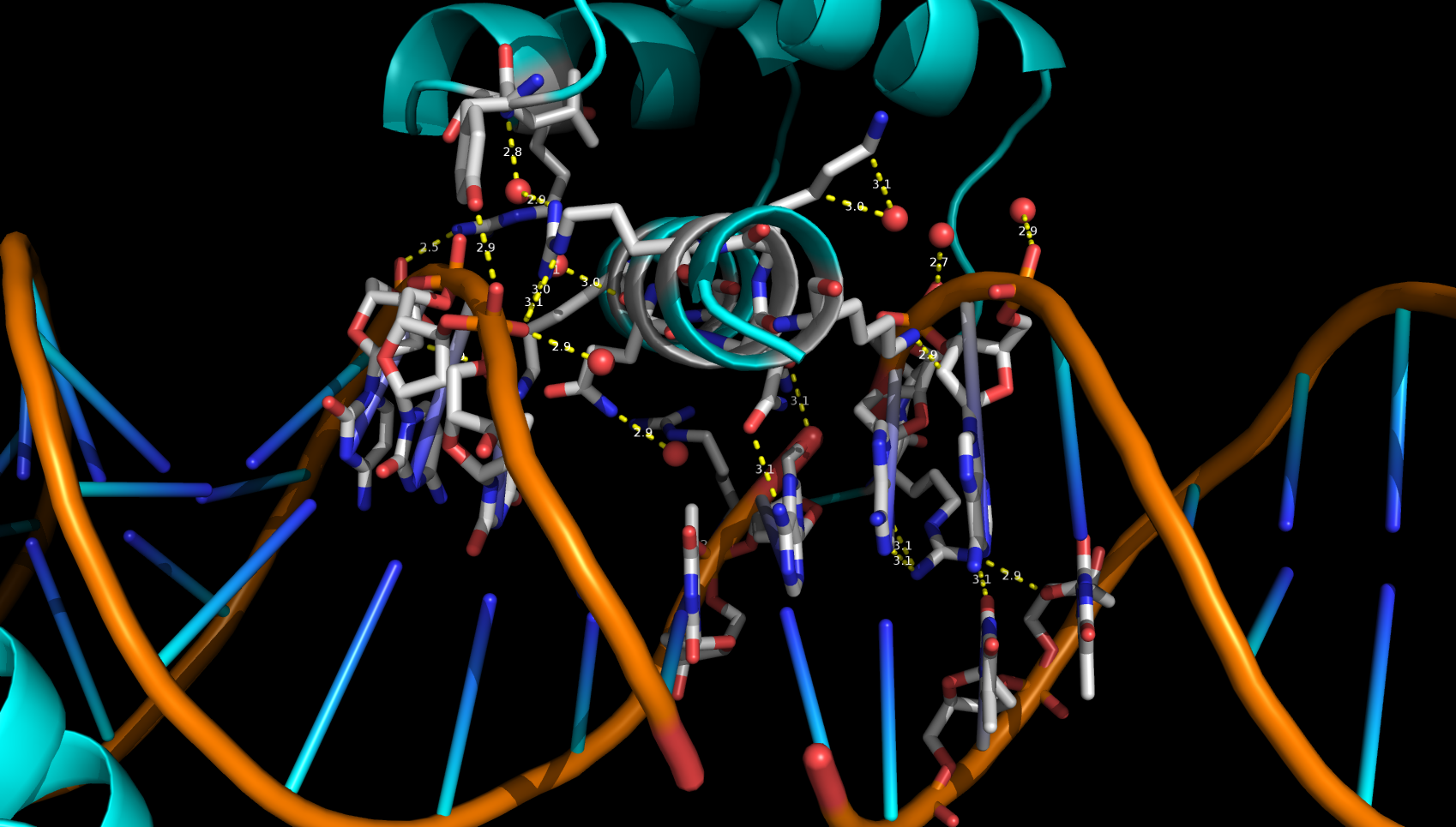
В ДНК-белковом комплексе 3hdd (см. рис. 11) белковая цепь B расположена на самом конце молекулы ДНК. Это представляет собой некую странность, т.к. эта цепь, в отличии от цепи A, может контактировать с сахаро-фосфатным остовом ДНК только с одной стороны.
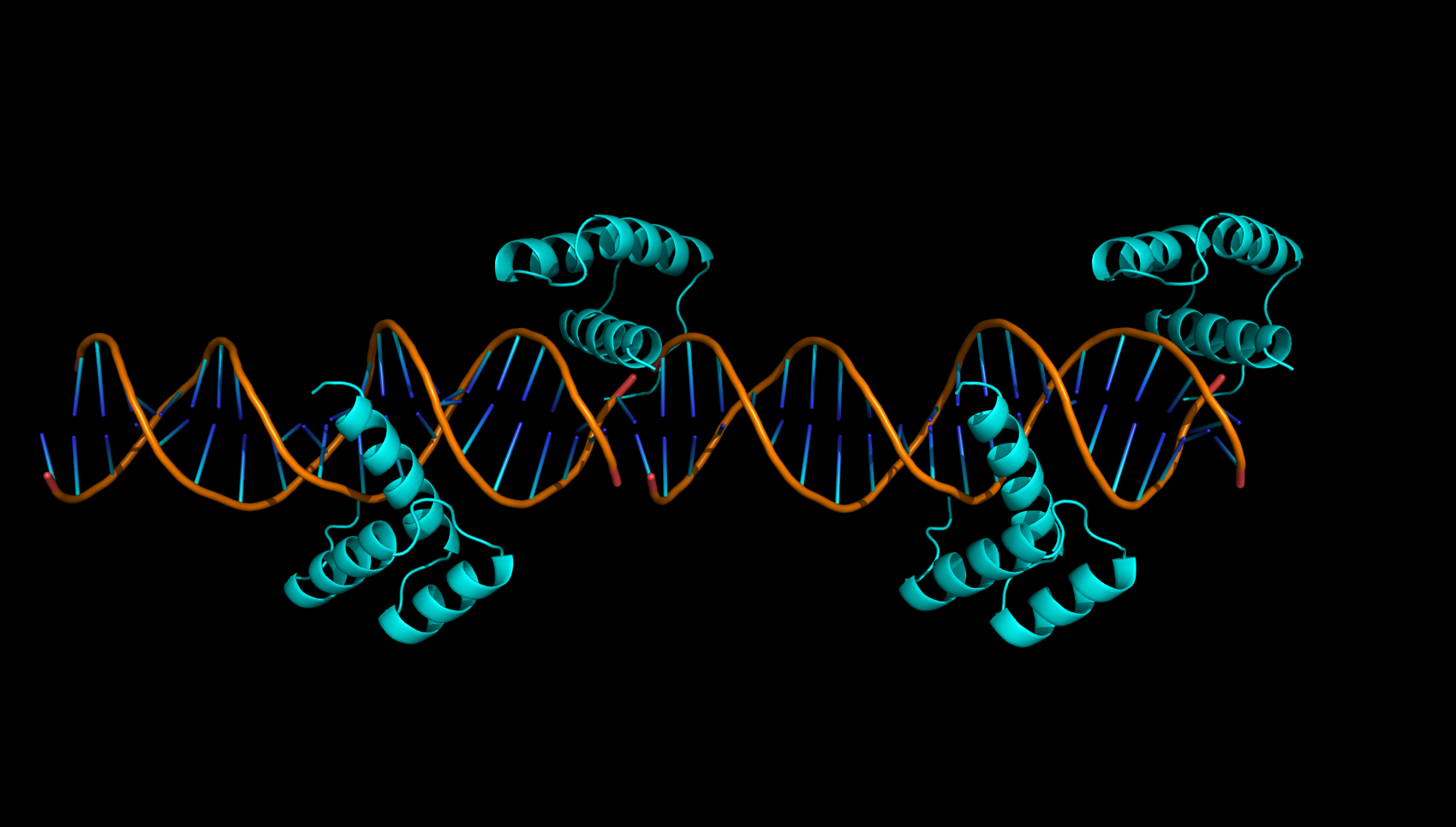
Однако если восстановить соседнюю с этой белковой цепью ячейку (см. рис. 12), то такое странное расположение белка легко объяснить. Дело в том, что одна из цепей ДНК на 1 нуклеотид длинее другой, что позволиляет второй молекуле ДНК в кристалле отжечься на фрагменте первой молекулы ДНК, образовав новую более длинную молекулу. А белковая цепь B как раз распологается на месте стыка двух молекул ДНК, из-за чего в ассиметрической единице она оказывается на краю.
В подтверждение на рисунке 13 приведена область контакта.